诸葛菜小孢子培养及其单倍体减数分裂染色体配对观察
2020-01-02殷家明钟荣棋唐章林李加纳
殷家明 钟荣棋 林 呐 唐章林 李加纳
诸葛菜小孢子培养及其单倍体减数分裂染色体配对观察
殷家明1,2,**钟荣棋1,2,**林 呐1,2唐章林1,2李加纳1,2
1西南大学农学与生物科技学院, 重庆 400715;2重庆市油菜工程技术研究中心, 重庆 400715
诸葛菜是一种极有价值的观赏、蔬菜、饲料和油料作物种质资源。为建立诸葛菜小孢子胚状体诱导再生植株技术, 并为诸葛菜染色体组的起源与进化研究提供相关数据资料, 本研究通过对诸葛菜游离小孢子的培养, 研究了热激培养时间和活性炭浓度对胚状体产量的影响, 并采用常规压片法对诸葛菜单倍体减数分裂染色体配对行为进行了观察。结果表明, 添加活性炭和热激培养对胚状体诱导是必需的。在直径6 cm培养皿中培养4 mL密度为1花蕾花粉 mL-1的小孢子NLN悬液时, 每皿添加1 mg活性炭和32℃热激3 d的培养条件下子叶形胚状体和总胚状体产量最高, 分别为每花蕾0.92±0.18个和1.32±0.25个。子叶形胚状体在1/2 MS培养基上萌发率为27.73%。花粉植株中自然加倍率为25%, 加倍植株染色体数为24, 单倍体植株染色体数为12。诸葛菜单倍体减数分裂染色体的平均配对构型为= 12 = 6.352I + 2.008II + 0.384III + 0.12IV, 具有二价体及三价体和四价体的细胞比例高达96%, 少量细胞的12条染色体联会形成3个四价体, 说明诸葛菜很可能是起源于染色体基数= 3的同源八倍体。本试验结果对于诸葛菜新材料新品种选育和基础研究具有重要参考价值。
诸葛菜; 小孢子培养; 胚状体; 单倍体; 减数分裂; 染色体配对
诸葛菜()为十字花科(Bassicaceae)诸葛菜属植物, 主要分布在中国, 在许多地区都有自然分布或人工引种栽培[1], 通常被用作园林、城市绿化地被植物和花坛花卉, 别称“二月蓝(兰)”。除本身具有较高的观赏价值外, 还是创造红花观光兼用型油菜品种的优良基因供体材料。油菜近缘植物芥蓝()与诸葛菜杂交, 杂种即开紫红或粉红花[2]。诸葛菜基因在油菜花瓣中异位表达, 得到了开红花的油菜[3]。诸葛菜具有角果长、每角粒多和粒大的特点, 在油菜育种新材料创制上有重要价值[4]。诸葛菜是极具开发前景的蔬菜和饲料种质资源[5-6], 同时也具有潜在的药用价值, 其种子提取物具有护肝和细胞保护作用[7-8]。诸葛菜可作为绿肥植物增加作物产量、减少氮肥流失以及用于土壤修复[9-10]。其种子油组份特殊, 含有特殊的双羟基脂肪酸, 高温润滑性能优于蓖麻油, 是一种十分有价值的新型工业用油料作物种质资源, 可作为生产生物柴油和高级润滑油的原材料[11-12]。
诸葛菜在我国分布广, 遗传变异大, 多样性丰富, 通过花药或花粉培养可以快速获得单倍体和纯合二倍体, 这为诸葛菜的新材料新品种选育提供了材料基础[1,13-18]。吴沿友等[19]进行诸葛菜花药培养, 得到了少量胚状体和再生植株, 而且所得植株为混倍体。贾勇炯等[20]从4℃低温处理4 d的诸葛菜花药中分离小孢子进行培养, 获得了愈伤组织和再生植株。然而, 关于诸葛菜游离小孢子培养通过胚胎发生途径获得胚状体和再生植株还未见报道。
诸葛菜属()的系统分类位置存在较大争议, 甚至在十字花科中不能被有力支持聚到任何进化枝[21]。诸葛菜属于诸葛菜复合群(complex)的一种, 体细胞染色体数目2= 24[13,15]。减数分裂染色体配对观察结果表明, 该物种可能为自然多倍体[22]。李再云等[23-24]根据甘蓝型油菜与诸葛菜属间杂种染色体的细胞学行为的观察结果提出, 诸葛菜可能为= 6的同源四倍体。吴建国等[25]对甘蓝型油菜与诸葛菜的五倍体(AACCO)杂种及其后代的细胞遗传学研究表明, 诸葛菜可能是一天然的多倍体, 基数= 3。李再云等[26]利用原位杂交技术, 在诸葛菜体细胞染色体中检测到8个45S rDNA位点, 暗示诸葛菜染色体基数为3。Lysak等[27]通过染色体涂染分析发现, 十字花科祖先核型的保守区段F和U在诸葛菜减数分裂粗线期染色体中检测到2个同源异源拷贝。因此, 诸葛菜被认为是一个四倍体或中四倍体(mesotetra- ploid)[27-28]。对诸葛菜单倍体减数分裂染色体配对的观察, 可为了解诸葛菜染色体组的起源和进化提供新的数据。本研究通过诸葛菜游离小孢子培养, 观察胚胎发生过程和胚状体形态, 研究热激培养时间和活性炭浓度对胚状体产量的影响, 并观察诸葛菜单倍体减数分裂染色体配对行为, 其研究结果可为诸葛菜的利用和研究提供重要参考。
1 材料与方法
1.1 材料
诸葛菜(二月兰)种子收集于重庆北碚西南大学校园内野生开放授粉植株, 由重庆市油菜工程技术研究中心繁殖保存。9月中旬播种育苗, 成苗后将幼苗移栽到玻璃温室内土壤中, 成活后每窝施复合肥约5 g, 根据需要浇水。温室光照为自然光, 温度不做特殊控制。次年2月, 植株开花后取样进行小孢子培养, 10月将小孢子植株移栽到试验地, 来年开花后进行形态观察和结实性鉴定, 并取样用于观察花粉育性和减数分裂染色体配对构型。
1.2 方法
1.2.1 小孢子培养程序 花期上午8:00—9:00时, 从生长健康植株取4~5 mm长花蕾, 经5%氨替福民溶液消毒10~15 min后用无菌水清洗, 置培养皿中, 加适量B5-13培养液(pH 5.8, 含13%蔗糖), 用玻璃注射器内筒研磨挤压出花粉, 400目不锈钢筛网过滤, 将花粉悬液转移到离心管中, 160 ×离心3 min, 弃上清液, 再加入B5-13培养液摇匀离心。如此重复离心3次后, 用NLN-13培养液(pH 6.0)按1蕾花粉 mL-1密度悬浮。将小孢子悬液混匀, 分装于直径6 cm培养皿, 每皿4 mL, 在每皿中添加一定量的活性炭, 封口膜封口后在32℃暗培养数天, 然后转移到25℃下继续暗培养, 肉眼可见胚状体时转入25℃的振荡培养箱中60 r min-1培养14~20 d后统计胚状体产量。
1.2.2 活性炭储存液的配制 在100 mL超纯水中加入1 g活性炭和0.5 g琼脂糖, 121℃高温灭菌后储存备用。
1.2.3 热激培养时间对胚状体产量的影响 每皿添加1 mg活性炭, 32℃下分别热激培养0、1、3、5和7 d, 研究热激培养时间对胚状体产量的影响。在初花5 d后1周内重复取材3次, 每处理每次重复5皿。
1.2.4 活性炭浓度对胚状体产量的影响 每皿添加0、1、2和3 mg活性炭, 在32℃下热激培养3 d, 研究活性炭浓度对胚状体产量的影响。在初花5 d后1周内重复取材3次进行试验, 每处理每次重复5皿。
1.2.5 胚状体发生过程和形态观察 以每皿添加1 mg活性炭、32℃热激3 d的培养物为对象, 经1、3、5、7、10和14 d培养, 分别在倒置显微镜下观察胚状体发生过程。振荡培养14~20 d后, 在体式显微镜下观察胚状体形态。
1.2.6 植株再生、移栽、育性和倍性鉴定以及单倍体染色体配对观察 将振荡培养14~20 d的子叶胚转移到1/2MS+3%蔗糖+7 g L-1琼脂培养基(pH 5.8)上, 在20℃、12.5 µmol m-2s-116 h d-1光照条件下培养。出芽后将芽切下继代保存和扩繁到每个花粉植株无性系具有3~5芽。移栽前1个月, 将芽转移到1/2MS+0.5 mg L-1IBA+3%蔗糖+7 g L-1琼脂培养基(pH 5.8)上生根。生根后的试管苗经炼苗1周后移栽到试验地, 最初1周内用白色塑料膜遮蔽。在花期, 对植株进行形态观察, 取即将开放花朵, 取出花药并挤出花粉用2%醋酸洋红染液染色后在显微镜下观察统计花粉育性。取幼嫩花蕾用卡诺氏固定液(3份95%乙醇∶1份冰乙酸)固定24 h后转入75%酒精于冰箱内4℃保存备用, 用改良卡宝品红液染色观察花粉母细胞减数分裂后期I或前期II染色体数目, 观察单倍体减数分裂终变期-中期I染色体配对构型。对加倍的植株采用人工辅助授粉自交, 以了解自交结籽率; 同时, 辅助授以天然诸葛菜混合花粉, 以了解异交结籽率。
2 结果与分析
2.1 胚状体发生过程和形态
培养1 d后, 部分小孢子体积明显增大, 呈圆球形; 另一部分小孢子体积没有明显变化(图1-A)。培养3 d后, 观察到一些小孢子发生第1次细胞分裂。分裂方式有2种, 多为对称分裂, 形成2个大小近等的细胞(图1-B); 另一种是非对称分裂, 形成2个大小明显不同的细胞(图1-C)。培养5 d后, 可观察到多细胞团(图1-D)和具有胚柄状结构的原胚(图1-E)。培养7 d后, 胚发育到球形原胚阶段(图1-F)。培养10 d后, 胚发育到球形胚时期(图1-G)。培养14 d, 肉眼可见细小的白色颗粒状培养物, 在倒置显微镜下可见球形胚状体和心形胚状体, 包括圆球形(图1-H)和卵球形(图1-I)胚状体以及桃心形(图1-J)和心脏形胚状体(图1-K)。继续振荡培养14 d后, 胚状体发育到子叶期(图1-L)。
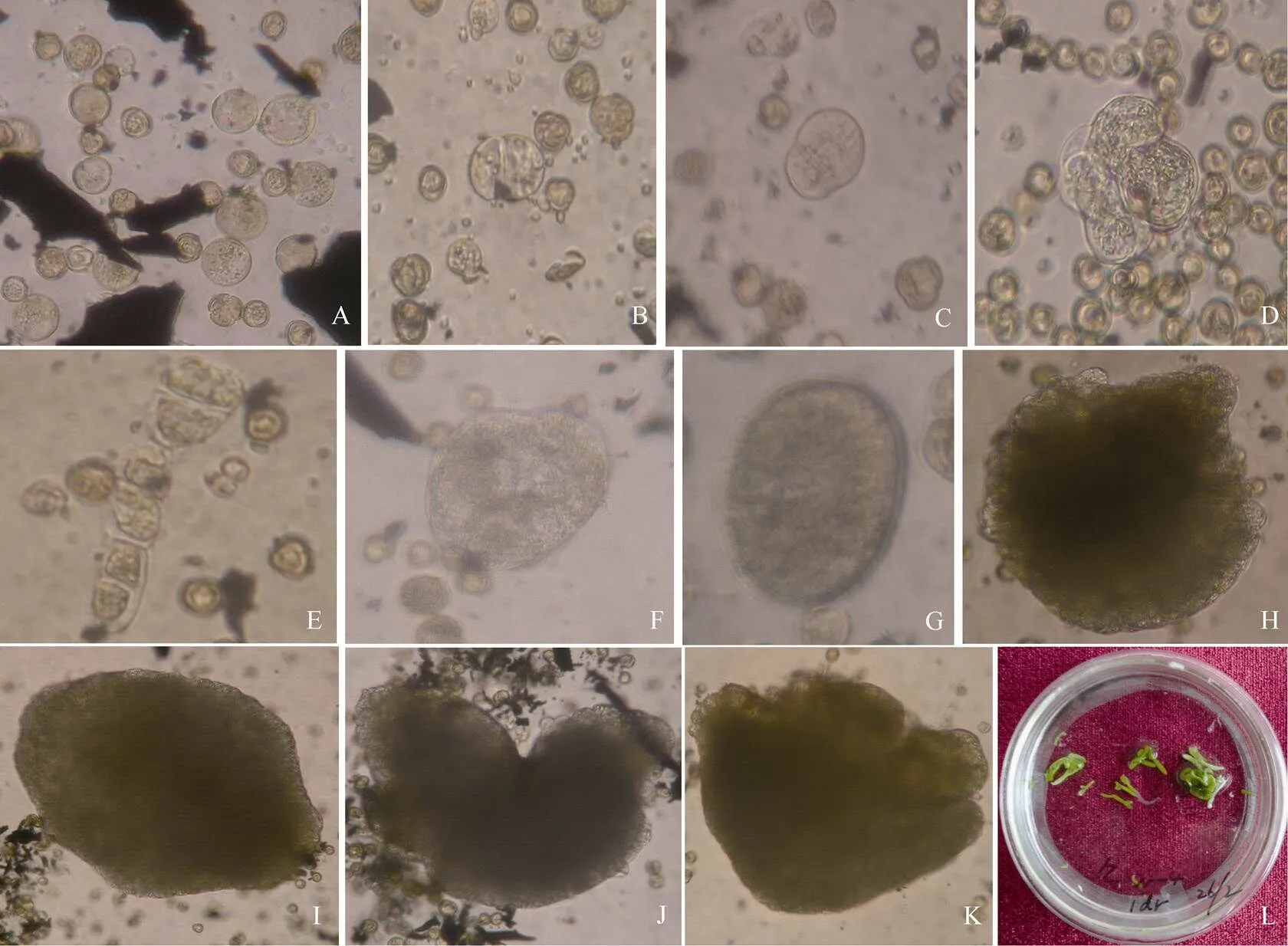
图1 诸葛菜小孢子胚胎发生过程
A: 部分小孢子膨大; B: 小孢子近均等分裂; C: 小孢子不均等分裂; D: 多细胞团; E: 具胚柄状结构的原胚; F: 球形原胚; G: 球形胚; H: 具胚柄状结构的圆球形胚状体; I: 卵球形胚状体; J: 桃心形胚状体; K: 心脏形胚状体; L: 培养28 d后的胚状体。
A: some swelled microspores; B: microsporal equal cell division; C: microsporal unequal cell division; D: multicell cluster; E: proembryo with a suspensor-like structure; F: globular proembryo; G: globular embryo; H: round sphere embryoid with a suspensor-like structure; I: oval sphere embryoid; J: heart embryoid; K: cordate embryoid; L: embryoids after 28 days of culture.
振荡培养14~20 d后在体式显微镜下观察胚状体形态。胚状体可分为子叶形胚状体(图2-A~E)、鱼雷形胚状体(图2-F)、心形胚状体(图2-G)、球形胚状体(图2-H)和不规则形胚状体(图2-I) 5种类型。同一类型的胚状体又有多种多样的形态。如子叶期胚状体就有双子叶胚状体(图2-A)、三子叶胚状体(图2-B~C)、单子叶胚状体(图2-D)和2个双子叶胚状体合生(图2-E)等多样的形态表现; 球形胚状体有橄榄球形、椭球形、卵球形和圆球形胚状体等形态差异(图2-H)。
2.2 热激培养时间对胚状体产量的影响
相对于持续25℃培养, 32℃热激培养对于胚状体诱导和形成是必需的。未经热激培养不能诱导形成任何形态的胚状体, 热激培养1 d便能诱导产生胚状体。试验以热激培养3 d获得的总胚状体产量最高, 子叶形胚状体产量也最高。热激培养时间再延长, 总胚状体产量和子叶形胚状体产量都有降低的趋势(表1)。
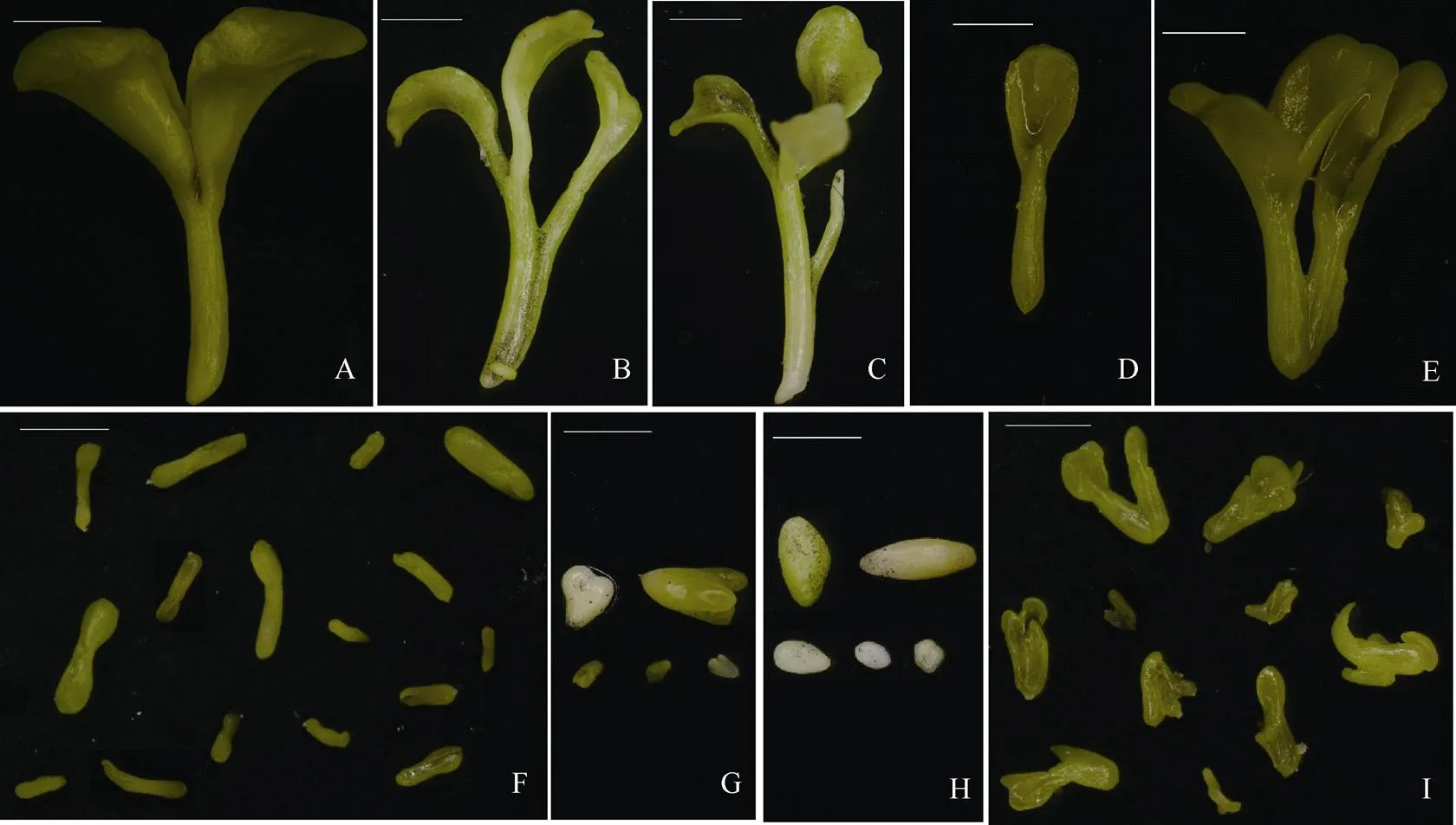
图2 诸葛菜小孢子胚状体形态
A: 双子叶胚状体; B: 三子叶胚状体; C: 具1胚根状结构三子叶胚状体; D: 单子叶胚状体; E: 合生双胚; F: 鱼雷形胚状体; G: 心形胚状体; H: 球形胚状体; I: 不规则形胚状体; 标尺= 2 mm。
A: dicotyledonous embryoid; B: tricotyledonous embryoid; C: tricotyledonous embryoid with an additional radicle; D: monocotyledonous embryoid; E: twin dicotyledonous embryoids; F: torpedo-shaped embryoids; G: heart-shaped embryoids; H: globular embryoids; I: anomalous embryoids; Bar = 2 mm.
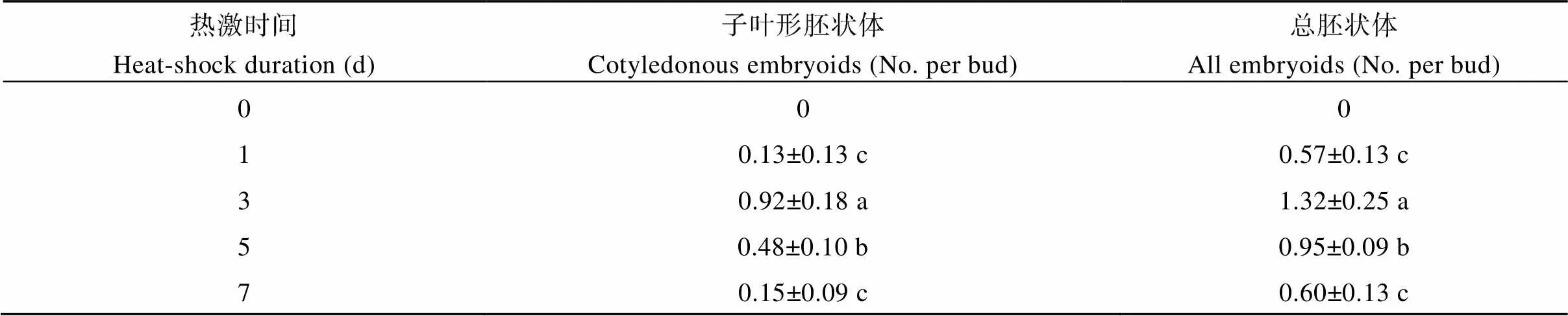
表1 不同热激时间下诸葛菜小孢子胚状体产量
同一列数字后字母不同表示在0.05水平上差异显著。
Data followed by a different letter in the same column are significantly different at the 0.05 probability level.
2.3 活性炭浓度对胚状体产量的影响
添加活性炭对于胚状体的形成是必需的, 不添加活性炭的处理未获得任何形态的胚状体。每皿添加1 mg活性炭时, 总胚状体产量和子叶形胚状体产量最高, 但与每皿添加活性炭2 mg时的总胚状体产量和子叶形胚状体产量相比, 没有统计学意义上的显著差异。添加活性炭过多不利于胚状体的形成, 对子叶形胚状体的形成影响更大(表2)。
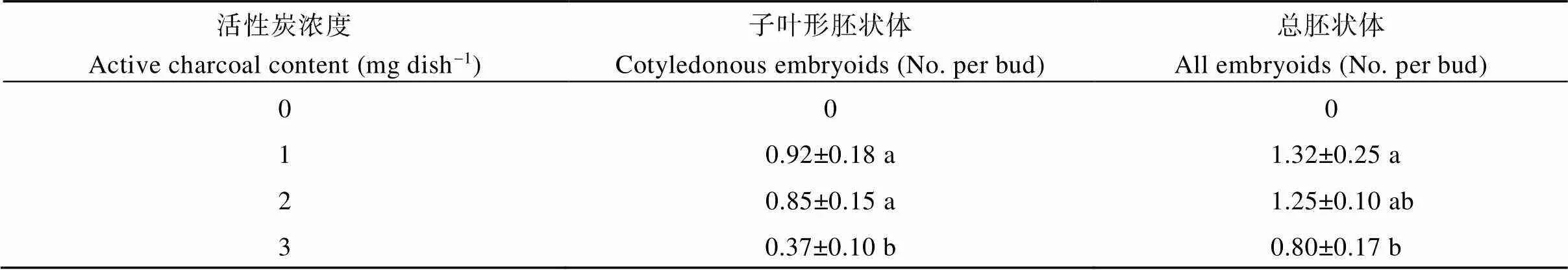
表2 不同活性炭浓度下诸葛菜小孢子胚状体产量
同一列数字后字母不同表示在0.05水平上差异显著。
Data followed by a different letter in the same column are significantly different at the 0.05 probability level.
2.4 植株再生、形态、育性和倍性
将子叶形胚状体转移到1/2MS固体培养基上, 有的胚状体逐渐褐化死亡; 有的胚状体胚轴伸长但不出芽; 也有的胚状体很快便开始萌发并出芽, 其下胚轴伸长, 长出白色的根, 在子叶节处长出幼芽(图3-A)。共培养子叶胚119个, 经过30 d培养, 有33个胚状体萌发出芽, 萌发率为27.73%。胚状体萌发产生的根纤弱且数量少, 将芽切下转移到1/2MS固体培养基继代保存和扩大繁殖到每个无性系有3~5芽。移栽前1个月, 将继代保存的无性系32个转移到1/2MS+IBA 0.5 mg L-1固体培养基上生根, 有22个无性系生根, 生根率为68.75%。生根后的试管苗经炼苗1周后移栽到试验地, 共移栽22个无性系, 到开花期有12个存活, 移栽存活率为54.55%。
开花期观察, 根据植株形态特别是花器官大小, 植株可分为2种类型, 即加倍的植株(图3-B)和单倍体植株(图3-C)。加倍植株生长健壮, 花蕾较多, 花朵和花蕾较大; 而单倍体植株较纤弱, 花蕾较少, 花朵和花蕾较小(图3-B~D)。在存活的12个花粉植株无性系中, 有3个为自然加倍植株, 自然加倍率为25%。加倍植株花药饱满, 内含大量可育花粉(图3-E)。不同加倍植株间花粉育性有差异, 3个加倍花粉植株可育花粉率分别为58.35%、62.68%和76.03%。单倍体植株花药干瘪, 内含花粉粒少, 在显微镜下观察全为小而不可染色的败育花粉(图3-F)。染色体数量观察表明, 加倍植株染色体为24条(图3-G), 单倍体植株染色体为12条(图3-H)。加倍植株自交能结少量种子, 表现自交高度不亲和, 3个加倍花粉植株平均每角果结籽数分别为0、0.25和0.65。对3株加倍植株辅助授以天然诸葛菜混合花粉则能结较多种子, 平均每角果结籽数分别为10.20、12.65和16.40。单倍体植株开放式授粉和人工辅助授以天然诸葛菜混合花粉均不能结籽。

图3 诸葛菜小孢子植株的再生、形态、育性和倍性
A: 胚状体萌发; B: 加倍的小孢子植株; C: 单倍体植株; D: 加倍和单倍体植株的花和花蕾; E: 加倍植株花粉; F: 单倍体植株花粉; G: 加倍植株花粉母细胞染色体(2= 24); H: 单倍体植株花粉母细胞染色体(2= 12); 标尺= 10 μm。
A: germination of embryoids; B: doubled microspore-derived plantlet; C: haploid plantlet; D: flowers and buds of double haploid and haploid plantlets; E: pollens of double haploid plantlet; F: pollens of haploid plantlet; G: chromosomes in the pollen mother cell of doubled plantlet (2= 24); H: chromosomes in the pollen mother cell of haploid plantlet(2= 12); bar = 10 μm.
2.5 单倍体减数分裂染色体配对构型
在125个花粉母细胞中, 共观察到24种染色体配对构型(表3和图4)。染色体可联会形成单价体、二价体、三价体和四价体, 单价体数变化在0~12个, 二价体数变化在0~6个, 三价体数变化在0~2个, 四价体数变化在0~3个, 平均配对构型为= 12 = 6.352I+2.008II+0.384III+0.12IV。染色体联会形成二价体及三价体和四价体的细胞比例达到96%, 只有4%的细胞形成12个单价体(表3)。值得注意的是, 有少量细胞(0.8%)的12条染色体联会形成3个四价体(表3, 图4-H)。这说明诸葛菜具有多倍体的性质, 很可能起源于染色体基数= 3的同源八倍体。
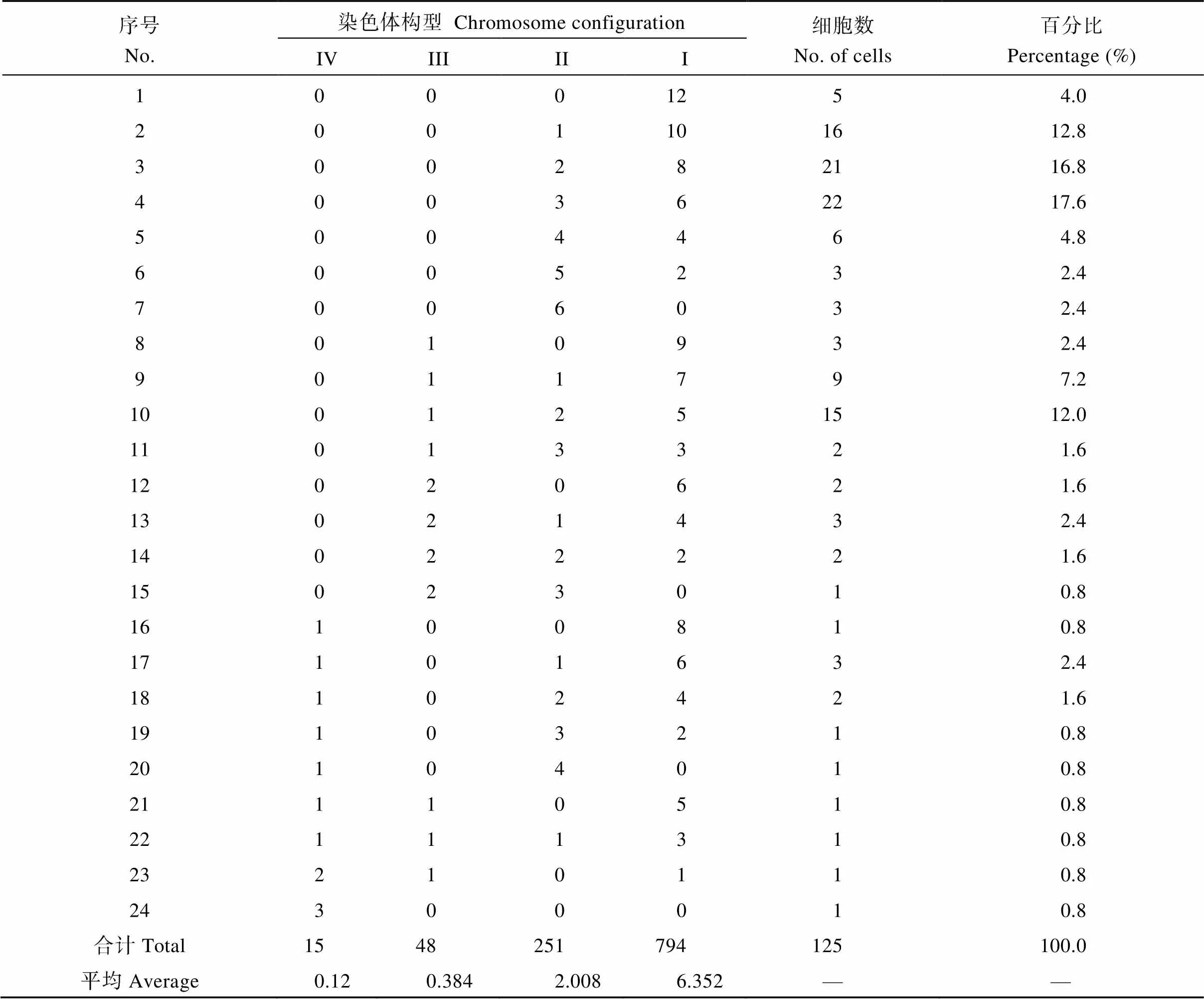
表3 诸葛菜单倍体减数分裂染色体配对构型
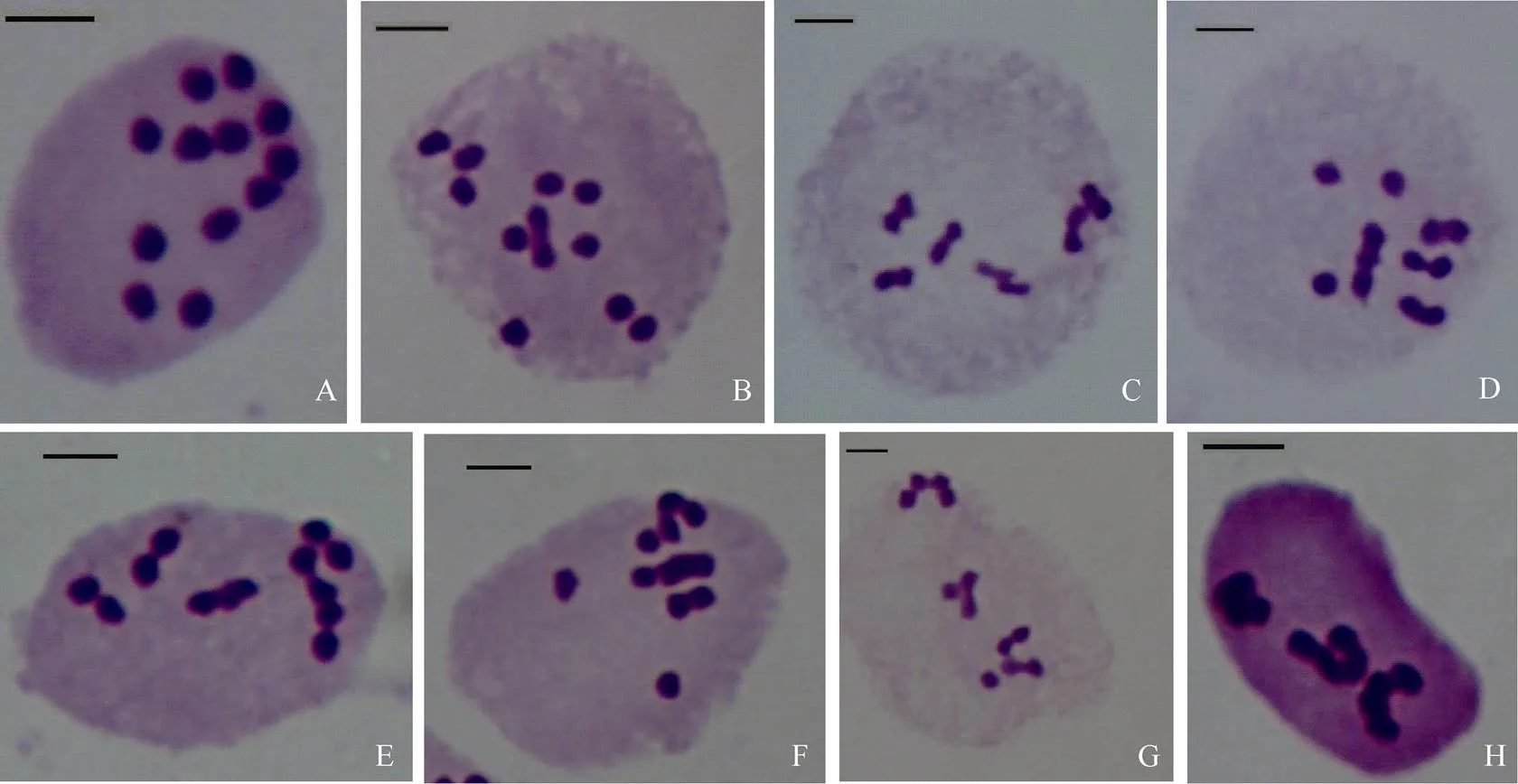
图4 部分诸葛菜单倍体(2n = 12)花粉母细胞减数分裂染色体配对构型(标尺= 10 μm)
A: 12I; B: 1II+10I; C: 6II; D: 1III+3II+3I; E: 1IV+4II; F: 1IV+1III+1II+3I; G: 2IV+1III+1I; H: 3IV.
3 讨论
小孢子胚胎发生和胚状体形态观察表明, 诸葛菜小孢子胚胎发生经历了均等或非均等细胞分裂、多细胞团、球形原胚、球形胚、心形胚、鱼雷形胚和子叶胚等时期, 这与同为十字花科的芸薹属植物的情形相似[29-32]。本试验观察到具有胚柄状结构的胚。由于具胚柄小孢子胚与合子胚更相似, 因此具胚柄小孢子胚发育途径诱导体系在研究胚胎发育机制方面有重要价值而受到重视[32-33]。形成胚柄状结构的现象在甘蓝型油菜和芥菜型油菜小孢子胚胎发生中都有报道。在甘蓝型油菜中, 小孢子培养温度和时间是影响胚柄样结构形成的关键因素。Ilic-Grubor等[34]报道在35℃热激1 h、33℃热激14~18 h后转移到24℃培养时, 甘蓝型油菜部分小孢子球形胚、心形胚和鱼雷形胚上存在胚柄状结构。Joosen等[32]和Supena等[35]研究表明, 短暂温和的32℃热激处理促进甘蓝型油菜具胚柄小孢子胚发育途径, 随着热激处理时间缩短该途径比例越高, 小孢子胚胎发育与合子胚胎发生极其相似, 胚柄结构从第1次分裂发生持续到心形胚阶段。而Prem等[33]则建立了一种新的与合子胚发生相似的小孢子胚胎发生体系, 即在持续18℃下进行甘蓝型油菜“Topas” 的小孢子培养, 小孢子的发育有3条途径, 为配子体样发育途径、不具胚柄状结构的胚胎发育途径和具有胚柄状结构的胚胎发育途径, 其中具有胚柄状结构的胚胎发育途径为主要途径, 占50%以上, 与合子胚胎发生相似, 胚柄结构从第1次分裂发生持续到心形胚阶段。在芥菜型油菜中, 基因型和供体植株生长条件影响具胚柄状结构小孢子胚的形成。Chanana等[36]对3种生长条件的6个芥菜型油菜品种进行小孢子培养, 在32℃热激3 d后转移到25℃下培养, 结果只有在昼/夜温度为10℃/5℃的生长条件下1个品种“PR-45”形成了具胚柄状结构的胚状体, 胚柄结构可持续到子叶胚。本试验观察到胚柄状结构可持续到鱼雷形胚状体(图2-F), 而子叶形胚状体上未观察到胚柄状结构。这是因为具胚柄状结构胚胎发育较缓慢还是在鱼雷期后降解消失需要进一步考察。
在十字花科植物小孢子培养中, 温度胁迫是诱导小孢子胚胎发生的重要因素, 常用的处理方式是32~35℃热激处理1至数天后转移到常温(25℃)培养。本试验结果表明, 热激对诸葛菜小孢子胚的发生具有重要作用, 相对于持续25℃培养来说, 32℃热激培养对于胚状体诱导和形成是必需的。Prem等[33]在持续18℃低温胁迫下进行甘蓝型油菜“Topas”的小孢子培养获得成功, 建立了一种新的小孢子胚胎发生体系。低温胁迫和传统的高温胁迫下成熟胚状体形态相似, 胚状体萌发成苗率和花粉植株染色体自发加倍率都没有显著差异, 而低温胁迫较高温胁迫下胚状体产量要低得多, 所需培养时间也较长[33]。另外, 高温胁迫处理在十字花科植物小孢子培养中得到广泛应用, 而小孢子低温胁迫培养体系在包括诸葛菜在内的其他基因型材料上的适用性还需进一步研究。
活性炭具有吸附和减少培养基中的抑制成分和有毒代谢产物的能力, 经常用于植物组织培养中, 来改善细胞的生长和发育[37]。活性炭在十字花科植物甘蓝[38-40]、白菜[41-44]、黑芥[45-46]、甘蓝型油菜[47-51]、芥菜型油菜[52]和芝麻菜[53]的小孢子培养中都得到广泛而成功应用, 对小孢子胚胎发生和植株再生表现出促进作用。本试验也说明了活性炭在小孢子培养中的重要性, 表明添加活性炭对诸葛菜小孢子胚胎发生是必需的。
诸葛菜单倍体花粉母细胞减数分裂染色体配对观察表明, 诸葛菜很可能是一个起源于染色体基数= 3的同源八倍体, 这与吴建国等[25]和李再云等[26]的观点一致, 而与Lysak等[27]和Franzke等[28]的观点不同。在试验中, 还观察到一定比例的花粉母细胞染色体联会形成6个二价体(表3, 图4-C), 但花粉育性和结实性观察结果都表明, 诸葛菜单倍体雌雄都不育。这说明, 即使这6个染色体构成的一组染色体, 其遗传结构和功能是不平衡的。尽管观察到形成3个四价体的细胞, 但其比例极低, 加上形成6个二价体的细胞, 总的比例也仅为3.2%; 形成12个单价体的细胞比例也仅占4%; 绝大多数细胞都是不规则的配对构型(表3)。因此, 本研究推测诸葛菜起源于= 3的同源八倍体, 但在进化过程中染色体和染色体组的结构已发生了较大变化, 正处于向二倍化转变的过程中。Lysak等[27]的研究支持诸葛菜是四倍体, 这是否就是该多倍体二倍化过程中间环节的体现, 还需进一步研究。值得注意的是, Lysak等[27]在研究中还发现, 诸葛菜粗线期染色体中, 十字花科祖先核型F区段的1个拷贝与祖先核型的排列相似, 另1个拷贝只保留了祖先核型F区段的顶端部分, 这也说明诸葛菜染色体和染色体组结构发生了重排。
4 结论
初步建立了诸葛菜小孢子培养技术, 通过游离小孢子胚胎发生途径获得了单倍体和染色体加倍的植株。活性炭和热激培养对诸葛菜游离小孢子胚状体诱导是必需的, 在直径6 cm培养皿中培养4 mL 1花蕾花粉 mL-1的小孢子NLN悬液时, 每皿添加1 mg活性炭和32℃热激3 d的培养处理, 子叶形胚状体和总胚状体产量最高。诸葛菜单倍体减数分裂染色体配对行为的观察结果支持诸葛菜为起源于染色体基数= 3的同源八倍体的观点。
[1] 周太炎, 关克俭, 郭荣鳞. 中国植物志(第33卷). 北京: 科学出版社, 1987. pp 40–43. Zhou T Y, Guan K J, Guo R L. Flora of China (Vol 33). Beijing: Science Press, 1987. pp 40–43 (in Chinese).
[2] 殷家明, 罗鹏, 蓝泽蘧, 黄邦全. 芥蓝×诸葛菜属间杂种的获得. 园艺学报, 1998, 25: 297–299. Yin J M, Luo P, Lan Z Q, Huang B Q. Production of intergeneric hybrids from×., 1998, 25: 297–299 (in Chinese with English abstract).
[3] Fu W Q, Chen D Z, Pan Q, Li F F, Zhao Z G, Ge X H, Li Z Y. Production of red-flowered oilseed rape via the ectopic expression ofOvPAP2., 2018, 16: 367–380.
[4] Yang Y, Shen Y S, Li S D, Ge X H, Li Z Y. High density linkage map construction and QTL detection for three silique-related traits inderivedpopulation., 2017, 8: 1–13.
[5] Luo P, Huang B Q. A study on exploitation of new vegetable germplasmO. E. Schulz, a member of Brassicaceae., 1996, 407: 75–79.
[6] Luo P, Huang B Q, Yin J M, Chen Z L, Chen Y H, Lan Z Q. A new forage genetic resource(L.) O. E. Schulz., 1998, 45: 491–494.
[7] Huo X W, Liu C Q, Gao L, Xu X D, Zhu N L, Cao L. Hepatoprotective effect of aqueous extract from the seeds ofagainst liver injury in mice and HepG2 cells., 2017, 18: 1197–1212.
[8] Zhu N L, Wu H F, Xu Z Q, Liu C Q, Tian Y, Hu M G, Sun Z H, Li P F, Ma G X, Xu X D. New alkaloids with unusual spermidine moieties from the seeds ofand their cytoprotective properties., 2017, 7: 41495–41498.
[9] Bai J S, Cao W D, Xiong J, Zeng N H, Gao S J, Katsuyoshi S. Integrated application of February Orchid () as green manure with chemical fertilizer for improving grain yield and reducing nitrogen losses in spring maize system in northern China., 2017, 14: 2490–2499.
[10] Sun G D, Xu Y, Liu Y, Liu Z P. Microbial community dynamics of soil mesocosms usingcombined withEm1 for bioremediation of highly PAH-contaminated soil., 2014, 98: 10243–10253.
[11] Wang R, Wu Y Y, Hang H T, Liu Y, Xie T X, Zhang K Y, Li H T.L., a marginal land-based plant for biodiesel feedstock: Heterogeneous catalysis, fuel properties, and potential., 2014, 84: 497–502.
[12] Li X J, Alicen M T, Asghar S, Ling J, Lucas B, Rebecca E C, Zhang W, Li Z Y, Kent D C, Diana B, Zhang C Y, Robert E M, Edgar B C. Discontinuous fatty acid elongation yields hydroxylated seed oil with improved function., 2018, 4: 711–720.
[13] 李子先, 曹熙德, 刘东旭, 刘俊, 张作仕, 贾勇炯. 中国种诸葛菜变种群的核型研究. 作物学报, 1994, 20: 595–600. Li Z X, Cao X D, Liu D X, Liu J, Zhang Z S, Jia Y J. A study on the karyotype of some Chinese variants of Zhuge Cai,., 1994, 20: 595–600 (in Chinese with English abstract).
[14] Al-Shehbaz I A, Yang G. A revision of the Chinese endemic(Brassicaceae)., 2000, 10: 349–353.
[15] Zhou L R, Liu Z B, Wu J, Wang J M, Yang Y, Li X F. Karyotype variation and evolution in populations of the Chinese endemiccomplex (Brassicaceae)., 2008, 26: 375–383.
[16] Zhang L J, Dai S L. Genetic variation within and among populations of(Cruciferae) in China as detected by ISSR analysis., 2010, 57: 55–64.
[17] Li M M, Wu L Y, Guo J L, Sun X Q, Hang Y Y. Analyses on allozyme variation and genetic diversity of four morphological types of(Brassicaceae)., 2012, 21: 44–49.
[18] Wang L, Ma X J, Yang C P. Two new infraspecific taxa of(Brassicaceae) in Northeast China., 2012, 22: 109–113.
[19] 吴沿友, 罗鹏. 诸葛菜的花药培养. 园艺学报, 1996, 23: 404–406. Wu Y Y, Luo P. Anther culture of., 1996, 23: 404–406 (in Chinese).
[20] 贾勇炯, 唐琳, 林宏辉, 陈放, 王幼平. 诸葛菜离体花粉粒诱导形成花粉植株的研究. 四川大学学报(自然科学版), 1999, 36: 1106–1110. Jia Y J, Tang L, Lin H H, Chen F, Wang Y P. Studies on the plant regeneration froms pollen.(Nat Sci Edn), 1999, 36: 1106–1110 (in Chinese with English abstract).
[21] Couvreur L P, Franzke A, Al-Shehbaz I A, Bakker F T, Koch M A, Mummenhoff K. Molecular phylogenetics, temporal diversification, and principles of evolution in the Mustard Family (Brassicaceae)., 2010, 27: 55–71.
[22] 李再云, 刘后利. 诸葛菜染色体的减数分裂配对研究. 华中农业大学学报, 1995, 14: 435–439. Li Z Y, Liu H L. A study on meiotic pairing of., 1995, 14: 435–439 (in Chinese with English abstract).
[23] Li Z Y, Liu H L, Luo P. Production and cytogenetics of intergeneric hybrids betweenand., 1995, 91: 131–136.
[24] Li Z Y, Liu H L, Heneen W K. Meiotic behaviour in intergeneric hybrids betweenand., 1996, 125: 69–75.
[25] Wu J G, Li Z Y, Liu Y, Liu H L, Fu T D. Cytogenetics and morphology of the pentaploid hybrid betweenandand its progeny., 1997, 116: 251–257.
[26] Li Z Y, Cartagena J, Fukui K. Simultaneous detection of 5S and 45S rRNA genes inby double fluorescence in situ hybridization., 2005, 70: 1–8.
[27] Lysak M A, Cheung K, Kitschke M, Bureš P. Ancestral chromosomal blocks are triplicated in Brassiceae species with varying chromosome number and genome size., 2007, 145: 402–410.
[28] Franzke A, Lysak M A, Al-Shehbaz I A, Koch M A, Mummenhoff K. Cabbage family affairs: the evolutionary history of Brassicaceae., 2011, 16: 108–116.
[29] Lichter R. Induction of haploid plants from isolated pollen of., 1982, 105: 427–434.
[30] Nitta T, Takahata Y, Kaizuma N. Scanning electron microscopy of microspore embryogenesis inspp., 1997, 16: 406–410.
[31] Yeung E C. The canola microspore-derived embryo as a model system to study developmental processes in plants., 2002, 45: 119–133.
[32] Joosen R, Cordewener J, Supena E D J, Vorst O, Lammers M, Maliepaard C, Zeilmaker T, Miki B, America T, Custers J, Boutilier K. Combined transcriptome and proteome analysis identifies pathways and markers associated with the establishment of rapeseed microspore-derived embryo development., 2007, 144: 155–172.
[33] Prem D, Solís M T, Bárány I, Rodríguez-Sanz H, Risueño M C, Testillano P S. A new microspore embryogenesis system under low temperature which mimics zygotic embryogenesis initials, expresses auxin and efficiently regenerates doubled- haploid plants in., 2012, 12: 127–145.
[34] Ilic-Grubor K, Attree S M, Fowke L C. Comparative morphological study of zygotic and microspore-derived embryos ofL. as revealed by scanning electron microscopy., 1998, 82: 157–165.
[35] Supena E D J, Winarto B, Riksen T, Dubas E, Van Lammeren A, Offringa R, Boutilier K, Custers J. Regeneration of zygotic-like microspore-derived embryos suggests an important role for the suspensor in early embryo patterning., 2008, 59: 803–814.
[36] Chanana N P, Dhawan V, Bhojwani S S. Morphogenesis in isolated microspore cultures of,, 2005, 83: 169–177.
[37] Thomas T D. The role of activated charcoal in plant tissue culture., 2008, 26: 618–631.
[38] Da Silva Dias J C. Effect of activated charcoal onmicrospore culture embryogenesis., 1999, 108: 65–69.
[39] 姜风英, 冯辉, 王超楠. 羽衣甘蓝的小孢子胚诱导和植株再生. 植物生理学通讯, 2005, 41: 725–727. Jiang F Y, Feng H, Wang C N. Embryogenesis and plant regeneration from isolated microspore culture of kale (L. var.DC.)., 2005, 41: 725–727 (in Chinese).
[40] 方淑桂, 陈文辉, 曾小玲, 朱朝辉, 廖晓珍, 郑学立. 结球甘蓝游离小孢子培养及植株再生. 园艺学报, 2006, 33: 158–160. Fang S G, Chen W H, Zeng X L, Zhu C H, Liao X Z, Zheng X L. Isolated-microspore culture and plantlet regeneration in cabbage (L. var.L.)., 2006, 33: 158–160 (in Chinese with English abstract).
[41] 申书兴, 赵前程, 刘世雄, 张成合, 李振秋. 四倍体大白菜小孢子植株的获得与倍性鉴定. 园艺学报, 1999, 26: 232–237. Shen S X, Zhao Q C, Liu S X, Zhang C H, Li Z Q. Plant regeneration from isolated microspore culture of autotetraploid Chinese cabbage [L. ssp.(Lour.) Olsson]., 1999, 26: 232–237 (in Chinese with English abstract).
[42] Gu H H, Zhou W J, Hagberg P. High frequency spontaneous production of doubled haploid plants in microspore cultures ofssp.., 2003, 134: 239–245.
[43] 李菲, 张淑江, 章时蕃, 钮心恪, 孙日飞. 大白菜游离小孢子培养胚胎发生中的加倍机制. 园艺学报, 2006, 33: 974–978. Li F, Zhang S J, Zhang S F, Niu X K, Sun R F. Embryogenesis and doubling mechanism of isolated microspore culture in Chinese cabbage (ssp.)., 2006, 33: 974–978 (in Chinese with English abstract).
[44] 耿建峰, 侯喜林, 张晓伟, 蒋武生, 原玉香, 韩永平, 姚秋菊, 成妍, 李英. 影响白菜游离小孢子培养关键因素分析. 园艺学报, 2007, 34: 111–116. Geng J F, Hou X L, Zhang X W, Jiang W S, Yuan Y X, Han Y P, Yao Q J, Cheng Y, Li Y. Isolated microspore culture inssp.., 2007, 34: 111–116 (in Chinese with English abstract).
[45] Leelavathi S, Reddy V S, Sen S K. Somatic-cell genetic studies inspecies: 2. Production of androgenetic haploid plants in(L.) Koch., 1987, 36: 215–219.
[46] Margale E, Chevre A M. Factors effecting embryo production from microspore culture of(Koch)., 1991, 14: 100–101.
[47] Gland A, Lichter R, Schweiger H G. Genetic and exogenous factors affecting embryogenesis in isolated microspore culture ofL., 1988, 132: 613–617.
[48] Zhou W J, Hagberg P, Tang G X. Increasing embryogenesis and doubling efficiency by immediate colchicines treatment of isolated microspores in spring., 2002, 128: 27–34.
[49] Gu H H, Hagberg P, Zhou W J. Cold pretreatment enhances microspore embryogenesis in oil seed rape (L.)., 2004, 42: 137–143.
[50] Zhang G Q, Zhang D Q, Tang G X, He Y, Zhou W J. Plant development from microspore derived embryos in oilseed rape as affected by chilling, desiccation and cotyledon excision., 2006, 50: 180–186.
[51] Shi Y, Xu G, Warrington T B, Murdoch G K, Kazala E C, Snyder C L. Microspore-derived cell suspension cultures of oilseed rape as a system for studying gene expression., 2008, 92: 131–139.
[52] Prem D, Gupta K, Sarkar G, Agnihotri A. Activated charcoal induced high frequency microspore embryogenesis and efficient doubled haploid production in., 2008, 93: 269–282.
[53] Leskovšek L, Jakše M, Bohanec B. Doubled haploid production in rocket (Mill.) through isolated microspore culture., 2008, 93: 181–189.
Microspore culture and observations on meiotic chromosome pairing of the haploid in
YIN Jia-Ming1,2,**, ZHONG Rong-Qi1,2,**, LIN Na1,2, TANG Zhang-Lin1,2, and LI Jia-Na1,2
1College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China;2Chongqing Rapeseed Eengineering and Technology Research Center, Chongqing 400715, China
is extremely valuable as the ornamental, vegetable, forage and oil germplasm resource. In order to develop the technique of microspore-derived embryoid induction and plant regeneration, and provide dada for the origin and evolution of the genome, the effects of the heat-shock incubation duration and the content of additional activated charcoal on embryoid yield were studied through microspore culture, and the meiotic chromosome pairing behavior of the haploid was observed by conventional squashing method in. The activated charcoal addition and heat shock culture were required for embryoid induction. When 4 mL microspore suspension with 1 bud per mL was incubated in aF6 cm petri dish at 32℃ of heat shock for three days and supplemented with 1 mg activated charcoal in each dish, the cotyledon-shaped embryoid yield and total embryoid yield were highest, which were 0.92 ± 0.18 and 1.32 ± 0.25 embryoids per bud, respectively. The germination rate of the cotyledon-shaped embryoids in 1/2MS medium was 27.73%. The natural chromosome doubling rate was 25% among the survival microspore-derived plantlets. The chromosome number of the double haploid plants and the haploid plants was 24 and 12, respectively. The meiotic chromosome pairing configuration of the haploid inwas averaged as= 12 = 6.352I + 2.008II + 0.384III + 0.12IV. The percentage of the pollen mother cells with bivalent, trivalent and tetravalent was up to 96%. The 12 chromosomes in 0.8% of pollen mother cells synapsed into three tetravalents. The chromosome pairing behavior strongly suggested thatoriginated from a homologous octoploid with the basic chromosome number of= 3. The above results provide a reference for breeding new materials and cultivars and for basic research in.
; microspore culture; embryoid; haploid; meiosis; chromosome pairing
10.3724/SP.J.1006.2020.94065
本研究由国家重点研发计划项目(2018YFD0100503), 国家现代农业产业技术体系建设专项(CARS-12)和重庆市社会事业与民生保障科技创新专项(cstc2016shms-ztzx80010, cstc2017shms-xdny80009)资助。
This study was supported by the National Key Research and Development Plan (2018YFD0100503), the China Agriculture Research System (CARS-12), and the Chongqing Science and Technology Innovation Special Project for Social Affairs and People’s Livelihood Insurance (cstc2016shms-ztzx80010, cstc2017shms-xdny80009).
殷家明, E-mail: 1661096534@qq.com; 钟荣棋, 1457139712@qq.com
**同等贡献(Contributed equally to this work)
2019-04-24;
2019-08-09;
2019-10-12.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20191011.1719.011.html
