丁香有效成分对高脂小鼠脾脏抗氧化和细胞免疫功能影响的研究
2019-12-27廖启超张弦郝澍
廖启超 张弦 郝澍
摘 要:将丁香干粉提取成石油醚相、乙酸乙酯相、正丁醇相和水相,通过对实验小鼠进行高脂饮食饲养建立模型,再利用原代脾细胞培养对高脂模型中各种丁香有效成分对免疫细胞的保护效果进行筛选,选择出对抗高脂类的主要活性成分,观察丁香有效成分对高脂小鼠脾细胞活性、MDA和T-SOD水平及血清中细胞因子IL-2的影响。结果表明,丁香中提取出的石油醚相和乙酸乙酯相均可以提高高脂小鼠总胆固醇值,而且还可以增强高脂小鼠脾细胞的抗氧化能力和IL-2的水平。
关键词:丁香;高脂;抗氧化;脾细胞;免疫
中图分类号 R285.5文献标识码 A文章编号 1007-7731(2019)23-0018-04
1 引言
丁香(别名公丁香),为桃金娘科植物丁香(Eugenia caryophyllata Thunb)的干燥花蕾,是国家公布的药食两用植物。自20世纪60年代以来,丁香的药理作用和化学成分已被广泛研究证实,它具有保肝、止泻、解毒、抑菌杀虫等作用[1],有巨大的开发潜力和研究价值。本实验室先前对国家公布的87种药食两用植物进行了筛选,证实了丁香的抗氧化活性最强[2]。
丁香有效成分分为挥发性和非挥发性2种成分。相关研究显示[3,4],挥发油性成分含有萜烯类、酸、醇、醛、酯、酚等物质,经GS-MC分析,主要包括23种化学成分,其中含量最高的是丁香酚(62.21%)[5],其功能活性已被充分研究开发。丁香的非挥发性成分的研究相对较少,但春[6]用乙醇提取丁香,从提取液中分离纯化出34个化合物,并运用质谱、红外光谱、紫外光谱以及核磁共振等现代光谱学技术阐明了其结构,其中有11个黄酮及其苷、7个三萜、3个鞣质、2个酚苷、2个色酮苷、2个神经酰胺,另外还有β-谷甾醇、胡萝卜苷、对羟基-反式肉桂酸、香草酸、阿魏醛、对羟基苯乙酮以及5-羟甲基糠醛。最新研究结果发现丁香非挥发性成分同样具有较强的抗氧化活性,国外的研究者则发现丁香中的水相和乙醇相均可以降低小鼠巨噬细胞中NO的产量,同时抑制LPS刺激后IL-1β、IL-6、IL-10的分泌[7,8]。Hemalatha等[9]采用丙酮、氯仿或甲醇等不同溶剂提取丁香非油类成分,发现甲醇提取物抑制DPPH自由基清除活性最强。张小霞[10]发现在丁香非油类成分中乙酸乙酯相对LDL氧化抑制作用最强,且抑制作用与浓度成正相关。但是,丁香不同极性部位在抑制肝损伤所致氧化应激的差异还尚不清楚,且鲜有将挥发性与非挥发性物质的活性进行比较的研究。
2 材料与方法
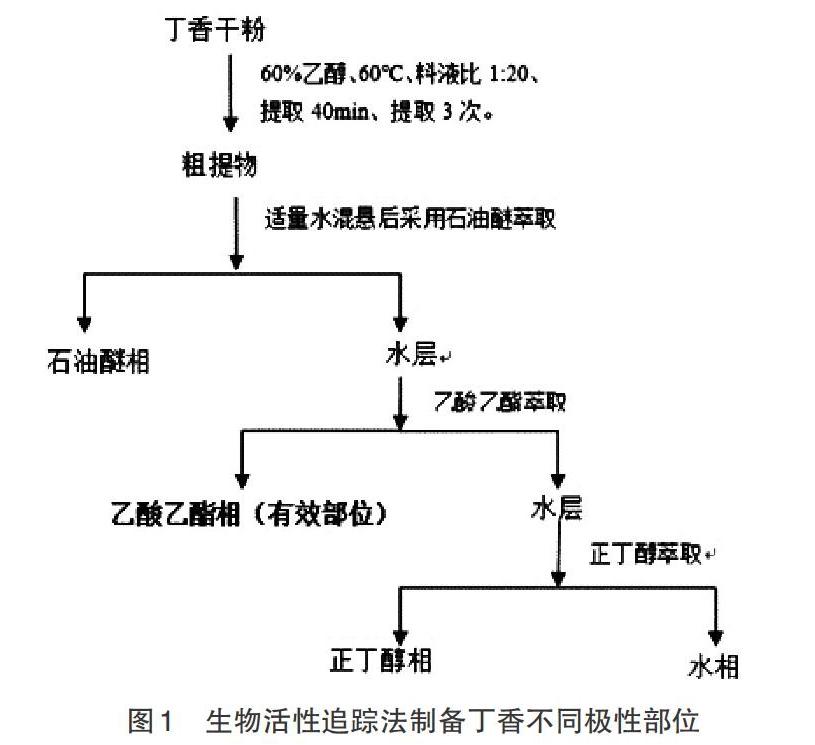
2.1 丁香有效成分的提取 公丁香,购于江西黄庆仁栈九江华氏大药房,由江西樟樹天齐堂中药饮片有限公司分装,产自广西。产品批号1509006,生产日期2015年9月30日。材料先进行机械粉碎,再过40目筛后放置于冰箱。采用图1所示方法提取丁香有效成分。量取1/10提取液制备丁香粗提物。剩余9/10提取液浓缩后加入适量蒸馏水混悬后,分别利用溶剂极性逐渐增大的溶剂石油醚、乙酸乙酯和正丁醇依次萃取,和剩水相共4个极性分别浓缩,与上述粗提物浓缩液一起冻干后获得干粉,置真空干燥器中保存备用。
2.2 建立高脂模型小鼠 清洁级小鼠(18.5±0.54g,6周龄,雌雄各半),购于南昌大学实验动物中心,饲养于标准塑料鼠笼(30×20×13cm3),放置于12h明暗交替、温度(22±2℃)、湿度50%的普通无特定病原菌动物房。小鼠适应1周后随机分成5组,每组10只。整个实验期间小鼠自由饮水和摄取日粮,每周称重1次。基础日粮和高脂日粮购自北京华阜康生物科技股份有限公司[生产许可证号:SCXK(京)2009-0008]。高脂日粮配方:基础日粮中添加 20.0%蔗糖、15%猪油、1.2%胆固醇和 0.2%胆酸钠。每日观察小鼠的健康状况,包括精神、食欲和垫料更换情况等。第60天,眼球采血,一部分血液保存于离心管中,37℃,2h后,3000rpm离心10min,获得血清。将血清保存于-20℃。采完血后,颈椎脱臼处死小鼠。
2.3 培养原代小鼠脾细胞 脾脏从小鼠体内分离并无菌收集放置在磷酸盐缓冲液中(PBS,0.1M磷酸盐缓冲液,0.85% NaCl,pH7.2)。通过轻轻的压脾脏通过不锈钢丝网空隙大小为100μM来悬浮单细胞。用5mL无菌的PBS洗和重悬细胞,然后用5mL的淋巴分离液分层。通过离心(2,000×g)15min在18℃来得到脾淋巴细胞。收集接触面的细胞,重悬和用8mL的细胞培养液洗2次。细胞悬浮在含10%胎牛血清(FBS)的RPMI1640完全培养基中,均加入刺激剂植物血凝素(PHA)调整刺激剂的终浓度为80ng/mL。脾脏淋巴细胞的密度为1.5×106cells/mL。测定新分离细胞的活力在95%以上。最后将培养板置于40.5℃、5%CO2的培养箱中培养60h。
2.4 ELISA法测定高脂小鼠总胆固醇 收集血液待凝固后,取血清,用ELISA法测定小鼠总胆固醇(TC)值。相关试剂盒购自上海碧云天生物技术有限公司。
2.5 MTT测定细胞活力 在96孔细胞培养板中,加入细胞培养液200μL,待细胞贴壁后,更换成5%FBS的RPMI培养基继续培养,56h后于各管中加入20μL5mg/mL MTT溶液,继续培养4h,弃去上清,加入200μL的DMSO后,置于酶标仪上测定OD490nm。每个处理组4个重复。
2.6 脾细胞抗氧化能力的测定
2.6.1 总超氧化物歧化酶(T-SOD)的测定 细胞培养结束后,移至1.5mL离心管中,于低温离心机4000rpm离心10min,弃去上清液,PBS重复洗涤2次,加入细胞裂解液,轻轻吹打后4000rpm离心15min。吸取上清液转移至EP管中,得到细胞提取液,应用南京建成生物科技有限公司总超氧化物歧化酶(T-SOD)测试盒(羟胺法)测定。
2.6.2 还原性谷胱甘肽(GSH)的测定 细胞培养结束后,移至1.5mL离心管中,于低温离心机4000rpm离心10min,弃去上清液,PBS重复洗涤2次,加入细胞裂解液,轻轻吹打后4000rpm离心15min。吸取上清液转移至新的EP管中,得到细胞提取液,应用南京建成生物科技有限公司还原型谷胱甘肽(GSH)测定试剂盒(分光光度法)测定。
2.7 血清中细胞因子的表达检测 收集血液待凝固后,取上层血清吸出,用ELISA法测定IL-2,相关试剂盒购自R&D Systems。具體操作步骤详见试剂盒。
3 结果与分析
3.1 丁香有效成分的提取优化 丁香有效成分的提取结果如下,得率从大到小依次分别是:丁香正己烷相(17.41%)>丁香乙酸乙酯相(5.9%)>丁香正丁醇相(4.76%)>丁香水相(4.58%)。
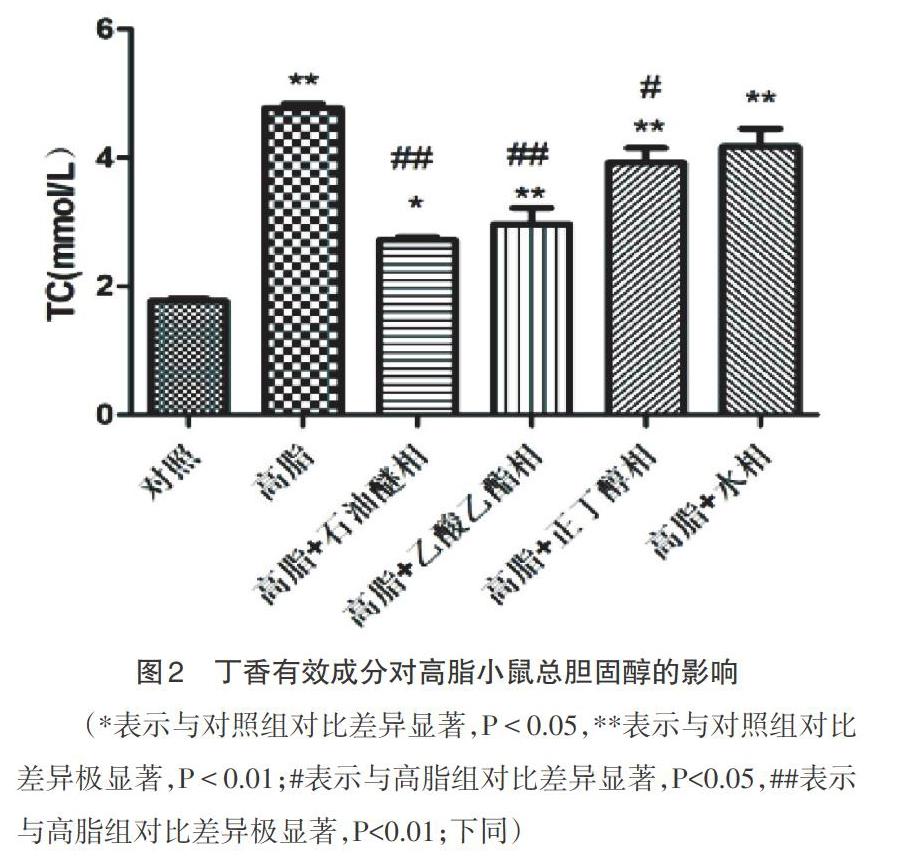
3.2 对高脂小鼠总胆固醇的影响 由图2可得,高脂组的TC值与对照组相比极为显著(P<0.01),而加入石油醚相或乙酸乙酯相后,TC值显著降低且与高脂组对比差异极显著(P<0.01),而在加入正丁醇相后,TC值有所降低且与高脂组对比差异显著(P<0.05),在入水相后,TC值略有降低但不具有统计学意义。因此,高脂小鼠模型建立成功。
(*表示与对照组对比差异显著,P<0.05,**表示与对照组对比差异极显著,P<0.01;#表示与高脂组对比差异显著,P<0.05,##表示与高脂组对比差异极显著,P<0.01;下同)
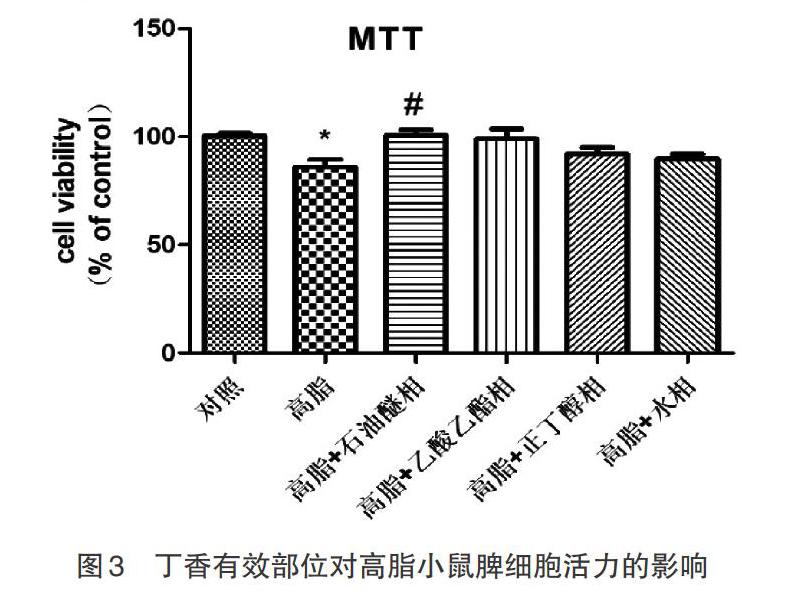
3.3 对高脂小鼠脾细胞活力的影响 由图3可得,与正常对照组相比,高脂饮食组小鼠的脾细胞活力显著降低(P<0.05),在加入丁香中提取出的石油醚相后小鼠脾细胞活力则有显著差异(P<0.05),加入乙酸乙酯相后小鼠脾细胞活力也有显著升高,而加入正丁醇相或水相后小鼠脾细胞活力均有提升但无统计学意义。
3.4 对高脂小鼠脾细胞抗氧化能力的影响 由图4可得,与正常对照组相比,高脂饮食组小鼠的脾细胞抗氧化能力显著降低(P<0.05)。GSH的测定,在加入公丁香中提取出的水相成分后,测试效果依旧与对照组对比差异显著(P<0.05),而在加入石油醚相或乙酸乙酯相后则与高脂饮食组测试结果对比差异显著(P<0.05),加入正丁醇相则有提升但无统计学意义。T-SOD的测定,在加入公丁香中提取出的水相或正丁醇相后测试效果仍与对照组具有显著差异(P<0.05),而在加入乙酸乙酯相后对比差异显著(P<0.05),加入石油醚相则有提升但无统计学意义。
3.5 对高脂小鼠血清中细胞因子IL-2的影响 由图5可得,与正常对照组相比,高脂饮食组血清中细胞因子IL-2的含量对比差异显著(P<0.05),且在加入公丁香中提取出的正丁醇相或水相依旧与对照组对比差异显著(P<0.05),而在加入石油醚相或乙酸乙酯相后可发现测试结果与高脂饮食组对比差异显著(P<0.05)。
4 讨论
研究表明,无论是体液的还是细胞介导的免疫反应都依赖于辅助性细胞的激活,这个过程严格的依赖于细胞所处的氧化还原微环境[12]。还原性的微环境可能是为了防止细胞在激活的过程中遭受氧化应激损伤。不同亚型的细胞具有不同的氧化还原水平,对于外界应激的敏感性也不同,因此能够调节多种状态下免疫反应。细胞外部的氧化还原环境可以通过多种方式与细胞内部的氧化还原分子相互作用。如果长时间暴露于大量的环境中,则会超越细胞自身抗氧化系统的耐受能力进而造成氧化应激,影响细胞功能,甚至导致细胞的凋亡[13]。氧化还原环境同样也会影响细胞的分化作用。总之,氧化还原调节作为一种重要的免疫调节的手段可以应用到多种疾病的治疗过程中,长期高脂膳食可诱发大量的产生并累积,进而导致氧化应激,而补充具有清除自由基的功能因子可以显著改善长期高脂膳食诱导的免疫功能损伤。用天然的抗氧化剂干预则可以通过清除自由基来防止细胞损伤的形成。因此本课题组在前期实验基础上,选择使用丁香作为实验原料。根据试验结果可以得知,高脂膳食可以减低小鼠脾细胞的细胞活力,降低T细胞分泌白介素-2(IL-2)的能力。IL-2的产量常常被认为是体外试验中测定T细胞功能的评判标准。而丁香的石油醚相和乙酸乙酯相均可以拮抗高脂降低的细胞活力和分泌IL-2的能力,同时也可以提高脾细胞的抗氧化能力(反映在T-SOD和GSH的指标上)。丁香的石油醚相主要成分为丁香酚,是目前丁香作为药材的主要功能分子,而丁香的乙酸乙酯相含有最多的总黄酮,而黄酮类成分具有良好的抗氧剂活性,因此丁香的石油醚相和乙酸乙酯相均具有拮抗高脂降低脾细胞功能的作用。因此我们推测,石油醚相和乙酸乙酯相可能是通过提高细胞的抗氧化能力,从而增强脾细胞的免疫功能。
参考文献
[1]赵锦.丁香抗氧化活性物质提取及其抗LDL氧化修饰[D].天津:天津科技大学,2014.
[2]江慎华,王书源,马海乐,等.丁香活性物质提取工艺优化与抗氧化活性研究[J].农业机械学报,2010,41(01):132-138.
[3]Cui H,Bai M,Rashed M,et al. The antibacterial activity of clove oil/chitosan nanoparticles embedded gelatin nanofibers against Escherichia coli O157:H7 biofilms on cucumber[J]. Int J Food Microbiol,2018,266:69-78.
[4]Nisar T,Wang ZC,Yang X,et al. Characterization of citrus pectin films integrated with clove bud essential oil:Physical,thermal,barrier,antioxidant and antibacterial properties[J]. Int J Biol Macromol,2018,106:670-680.
[5]刘万臣.丁香精油抗菌性、抗氧化活性及其对果蔬贮藏效果的研究[D].杨凌:西北农林科技大学,2008.
[6]但春.丁香和升麻的化学成分研究[D].成都:中国科学院研究生院(成都生物研究所),2006.
[7]Dibazar SP,Fateh S,Daneshmandi S. Immunomodulatory effects of clove (Syzygium aromaticum) constituents on macrophages: in vitro evaluations of aqueous and ethanolic components[J]. J Immunotoxicol,2015,12(2):124-31.
[8]Bachiega TF,Orsatti CL,Pagliarone AC,et al. Th1/Th2 cytokine production by clove-treated mice[J]. Nat Prod Res,2009,23(16):1552-8.
[9]Hemalatha R,Nivetha P,Mohanapriya C,et al. Phytochemical composition,GC-MS analysis,in vitro antioxidant and antibacterial potential of clove flower bud (Eugenia caryophyllus) methanolic extract[J]. J Food Sci Technol,2016,53(2):1189-98.
[10]張小霞,刘龙秀,江慎华,等.丁香非油类成分对LDL的氧化修饰抑制作用[J].食品工业科技,2018,(22):75-81+106.
[11]Khatib R,McKee M,Shannon H,et al. Availability and affordability of cardiovascular disease medicines and their effect on use in high-income,middle-income,and low-income countries: an analysis of the PURE study data[J]. Lancet,2016,387(10013):61-9.
[12]Norton RL,Hoffmann PR. Selenium and asthma[J]. Mol Aspects Med,2012,33(1):98-106.
[13]Chao T,Wang H,Ho PC. Mitochondrial Control and Guidance of Cellular Activities of T Cells[J]. Front Immunol,2017,8:473.
(责编:王慧晴)
