NLRC4炎症小体研究进展①
2019-12-27陈丽嫦于化鹏吴玲玲曾冠盛
陈丽嫦 于化鹏 吴玲玲 曾冠盛
(南方医科大学珠江医院,广州 510280)
NLRC4炎症小体(NLR family,CARD domain containing4,NLRC4)是一种多蛋白复合体,由N-端的含有胱天蛋白酶募集结构域(Caspase recruitment domain,CARD),中间的核苷酸结合结构域(Nucleotide binding oligomerization domain,NOD)和富含亮氨酸的C-端蛋白相互作用结构域(Leucine rich repeats,LRR)构成。在过去的10余年里,研究发现炎症小体的活化能够激活半胱氨酸的天冬氨酸蛋白水解酶1(caspase-1,CASP1),使无活性CASP1前体(pro-CASP1)切割为有活性CASP1,从而促进无活性的IL-1β前体(pro-IL-1β)和IL-18前体(pro-IL-18)切割为成熟的IL-1β和IL-18,释放到胞外参与机体炎症及损伤等过程[1-3]。目前已发现的炎症小体包括NLRP1、NLRP3、NLRP6、NLRP7、NLRP12、NLRC4以及NAIP[4]。本文就NLRC4炎症小体的构成、活化机制以及其在感染和自身炎症性疾病中的作用作一概述。
1 NLRC4炎症小体的结构特征
NLRC4的LRR结构域由15个重复结构单元,共440个氨基酸组成。因每个结构单元之间与一个含有8~15个氨基酸的螺旋结构连接,故而被称为富含亮氨酸的重复序列,该结构域用于识别病原相关分子模式(Pathogen associated molecular pattern,PAMP)等配体;NOD结构域属于AAA+ATP酶的超家族,可介导NLRC4自身寡聚反应;CARD结构域通常为由NLRC4的前94个氨基酸组成,其折叠成六个反向平行的α-螺旋包裹在疏水核心周围,可连接衔接蛋白ASC及效应分子CASP1,介导下游信号转导。
Hu等[5]对在鼠巨噬细胞数量足够、活性良好的情况下所分离出缺乏CARD结构域的NLRC4进行晶体分析,结果发现LRR、NOD结构域及占据NOD结构域的二磷酸腺苷(Adenosine diphosphate,ADP)通过广泛的分子内相互作用以稳定该单体结构,进一步研究证实ADP近端关键残基H443的突变可导致NLRC4寡聚化,从而促进炎症小体的活化。研究者们发现人类的NLRC4功能突变大多集中在ADP结合位点附近,这表明核苷酸结合或ATP水解是寡聚化和炎症小体活化所必需。同样的,ATP磷酸结合环(P-Loop)突变导致NLRC4不能诱导CASP1激活[6]。
NLRC4寡聚化结构中存在单个Naip基因表达的结构,该基因表达产物可以将数个NLRC4分子组装成盘状炎症小体,进而激活CASP1,产生一系列的免疫应答反应[7]。该盘状炎症小体较单一NLRC4结构活性更高,该活性主要通过在LRR与中央核苷酸结合结构域之间的联合区域来体现。
2 NLRC4炎症小体的活化机制
NLRC4的表达可通过肿瘤坏死因子(TNF-α)的刺激及p53活化而上调[8,9]。然而许多研究表明NLRC4表达的基础水平已经足以支持NLRC4炎症小体在上皮细胞和免疫细胞中的活化。
Mariathasan等[10]发现NLRC4缺失的鼠类巨噬细胞在接触沙门氏菌后,CASP1不能被激活。随后有多项研究表明来自沙门氏菌及军团菌的鞭毛蛋白能够诱导NLRC4介导的CASP1活化[11-13]。因此,研究者们认为鞭毛蛋白在NLRC4介导的CASP1活化过程中不可或缺。然而进一步的研究发现,虽然鞭毛蛋白缺失的沙门氏菌在感染早期不能激活CASP1,但在感染后期仍可监测到CASP1的活化和IL-1β的分泌。Miao等[14]发现此时CASP1的激活依赖于沙门氏菌Ⅲ型分泌系统(T3SS)的表达。因此,NLRC4的激活剂主要为鞭毛蛋白及T3SS蛋白(包括针状蛋白分子和杆状蛋白分子)。小鼠Naip基因家族分子中的Naip5、Naip6通过识别鞭毛蛋白介导NLRC4炎症小体的激活,而Naip1及Naip2分别通过T3SS针状蛋白分子和杆状蛋白分子介导NLRC4炎症小体的激活[15]。人类虽没有与小鼠相同的Naip基因,但其表达的Naip同源物可通过识别T3SS针状蛋白分子、杆状蛋白分子和鞭毛蛋白激活NLRC4炎症小体[16-18](图1)。然而,细菌配体是如何结合Naip从而激活炎症小体的机制尚不清楚。
为了研究NLRC4炎症小体活化的具体机制,Qu等[19]采用人工遗传学改造的小鼠进行实验,研究发现沙门氏菌感染小鼠后可以诱导NLRC4第533位丝氨酸发生磷酸化修饰反应,即使抑制CASP1的活性也不能阻止这种磷酸化反应的发生,这说明NLRC4的磷酸化修饰反应位于CASP1切割的上游。此外,研究还发现蛋白激酶Cδ(Protein kinase Cδ,PKCδ)和p21活化激酶2(P21-activated kinase2,PAK2)都是参与NLRC4磷酸化修饰反应的磷酸激酶。Liu等[20]发现与帕金森症和克罗恩病相关的富含亮氨酸重复序列激酶2(Leucine-rich repeat kinase 2 gene,LRRK2)表达减少可导致NLRC4炎症小体活化程度下降。然而在幽门螺旋杆菌中鞭毛蛋白能够诱导NLRC4磷酸化,但不能激活NLRC4炎症小体[21]。因此,单纯的磷酸化不足以诱导NLRC4的活化。NLRC4磷酸化相关激酶的特性及其在NLRC4活化过程中是否发挥着主导作用尚未清楚,但大量研究表明确保NLRC4的活化是抵御感染的关键部分。
3 NLRC4炎症小体的效应机制
最初研究者们认为NLRC4通过激活CASP1,从而促进pro-IL-1β及pro-IL-18转变为活性IL-1β及IL-18,引起炎症反应。随着研究的深入,我们发现NLRC4下游存在几种不同的信号传导途径。CASP1还可以激活一种被称为Gasdermin-D的胞质蛋白,该蛋白经切割后的N-末端结构域作用在宿主细胞膜上,导致细胞膜完整性丧失,并最终诱导细胞焦亡(Pyroptosis)[22]。与细胞凋亡不同,细胞焦亡的发生速度更快,IL-1β及IL-18等炎症因子可通过Gasdermin-D形成的膜孔释放到细胞外,促进机体抵御病原体(图1)。除此之外,Moltke等[23]研究发现一种人造鞭毛蛋白衍生的NAIP5-NLRC4激活剂通过激活钙依赖性磷脂酶A2(Phospholipase A2,PLA2)释放花生四烯酸。通过CASP1活化动员的花生四烯酸促进前列腺素和白三烯的快速合成。CASP1动员花生四烯酸释放的机制及该机制是否和NLRC4活化相关尚不清楚。目前,蛋白质组学研究已经确定了多达1 000个CASP1蛋白的潜在靶点,这表明除了上述信号传导途径外,可能还有其他的下游信号对NLRC4炎症小体介导的CASP1激活产生应答。
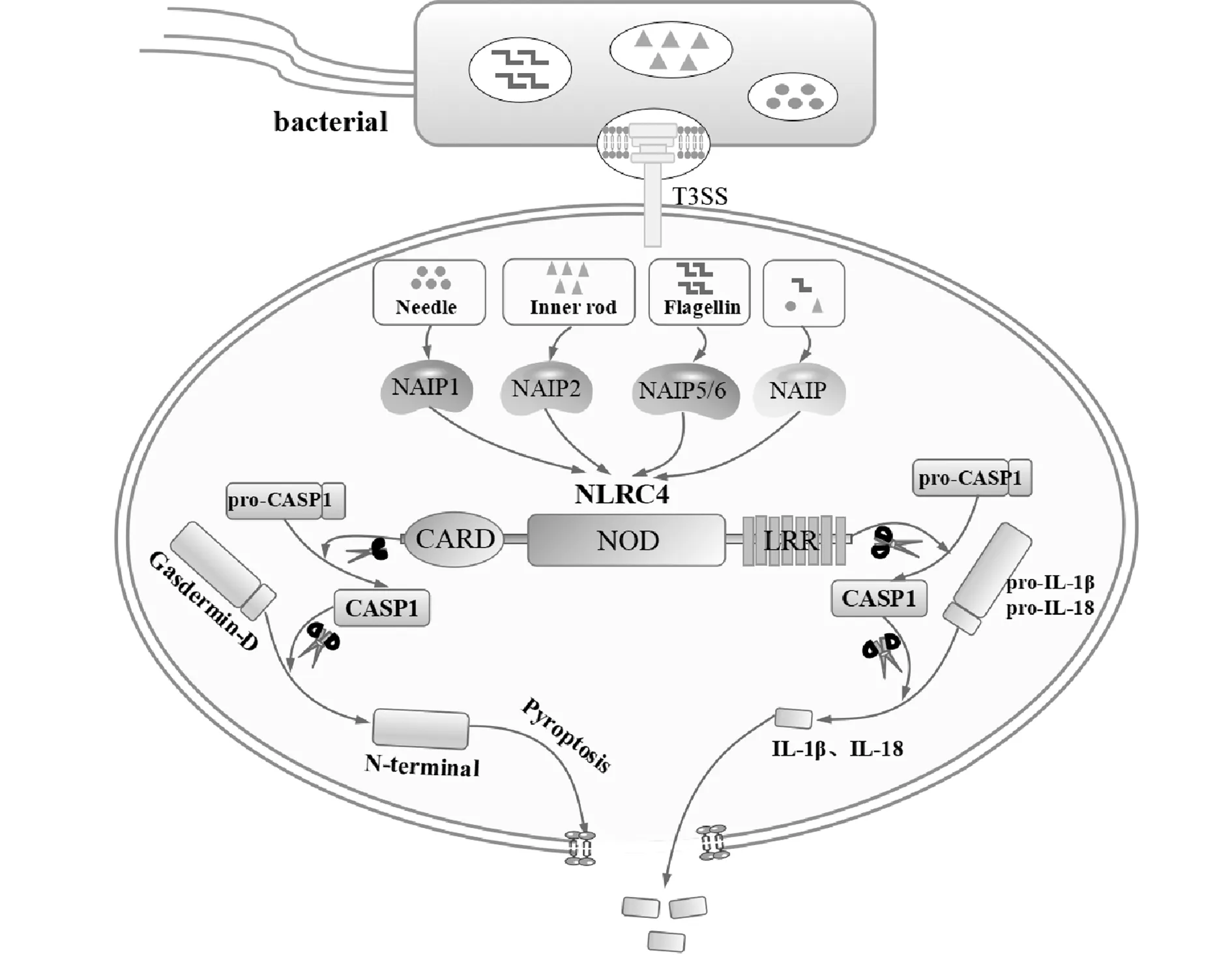
图1 NLRC4激活与效应机制图Fig.1 Triggering and effect mechanism of NLRC4Note:Four major groups of bacterial components trigger activation of the inflammasome.Flagellin and components of the type Ⅲ secretion system (T3SS) can be injected into the cytoplasm of the host cell via the T3SS.The T3SS needle and inner rod proteins are sensed by mouse NAIP1 and NAIP2,respectively,whereas flagellin is sensed by mouse NAIP5 or NAIP6.The needle and inner rod proteins and flagellin are all sensed by human NAIP.Ligand-bound NAIPs recruit NLRC4 to the same complex to drive activation of the NLRC4 inflammasome.NLRC4 acts as an adapter for caspase-1 activation.Caspase-1 cleaves the poreforming factor gasdermin D,whereby the N-terminal domain of gasdermin D forms pores in the host cell membrane.Caspase-1 also cleaves the proinflammatory cytokines pro-IL-1β and pro-IL-18,generating biologically active versions of these cytokines for release through the membrane pores generated by gasdermin D.The pores formed by gasdermin D also lead to lytic cell death via pyroptosis.
NLRC4的CARD结构域可直接与pro-CASP1相互作用从而催化CASP1激活,凋亡相关斑点样蛋白(Apoptosis-associated speck-like protein,ASC)在这一激活过程中起正性作用。其他构成炎症小体的蛋白(包括NLRP3,PYRIN和AIM2)亦可通过与ASC相互作用,进而募集并诱导pro-CASP1裂解成为有活性的P10/P20四聚体,促使pro-IL-1β及pro-IL-18切割成活性形式并释放到细胞外参与免疫应答[24]。研究发现CASP8与CASP1类似,可促进pro-IL-1β转变为活性IL-1β[25]。与CASP1不同的是,CASP8能在CASP1或Gasdermin-D被耗尽时引发CASP8依赖性细胞凋亡[26]。
4 NLRC4炎症小体与鼠类宿主防御
Norlander等[27]发现感染柠檬酸杆菌后,Nlrc4-/-小鼠比野生型小鼠体重更轻,肠道炎症的病理学特征(包括增生、白细胞浸润和水肿)更明显。另外,有实验通过给予仅在肠道上皮细胞中特定表达NLRC4蛋白的实验小鼠注射纯化后的细菌鞭毛毒素(Fla Tox),结果发现相对于不表达NLRC4蛋白的老鼠,表达NLRC4蛋白的小鼠炎症反应更重,细菌数要更少[28]。Sellin等[29]证实小鼠肠上皮细胞Naip1-6组织特异性缺失可使感染早期沙门氏菌细菌负荷增加,这表明将沙门氏菌感染的肠上皮细胞排出到肠腔中取决于肠上皮细胞NAIP蛋白的表达。以上研究表明NAIP-NLRC4炎症小体在控制肠道感染的细菌病原体中发挥了重要的作用。
尽管对于NLRC4的研究主要集中在肠道感染及肠道病原体上,近年研究发现NLRC4也与非肠道感染相关。产单核细胞李斯特菌的鞭毛蛋白可激活NLRC4,从而诱导细胞死亡[30]。Balakrishnan等[31]发现机体在感染铜绿假单胞菌后,可通过T3SS组分激活NLRC4炎症小体,引发肺部炎症反应。而且NLRC4可以抵御非鞭毛杆菌如肺炎克雷伯菌[32]。这些非肠道病原体通过类似于沙门氏菌和志贺氏菌等肠道病原体激活NLRC4的典型机制(通过鞭毛蛋白或细菌T3SS的组分)激活NLRC4。此外,一些病原体(如立克次体)可通过环氧合酶2(Cyclooxyg-enase-2,COX2)介导的前列腺素合成的机制诱导巨噬细胞NLRC4活化[33]。
5 NLRC4炎症小体与人类自身炎症性疾病
NLRC4在鼠类宿主防御机制中发挥着重要的作用,前文提及人Naip可通过识别T3SS针状蛋白分子激活NLRC4炎症小体,我们推测NLRC4在人类细胞内的细菌感染及清除中也扮演着不可或缺的角色。然而,关于NLRC4在现代人类机体中清除病原体的相关研究仍待进一步完善,且目前尚无人类NLRC4功能丧失的相关研究。
研究者们发现NLRC4在驱动人类自身炎症性疾病(Autoinflammatory disease,AID)中也发挥着重要作用。自身炎症是指不归因于感染、恶性肿瘤或抗原特异性自身免疫的全身或器官特异性炎症[34],其最初范畴是围绕自发性或增强的炎症小体活化相关的可以阻断IL-1β的单基因疾病,自1999年McDermott等[35]提出后,这个概念现已扩展为包括数量惊人的疾病,其中许多是因为不适当的炎症小体激活所致。
经过10余年对PYRIN和NLRP3炎症小体以及相关自身炎症性疾病如家族性地中海热(Familial mediterranean fever,FMF)和冷炎素相关周期热综合征(Cryopyrin-associated periodic syndromes,CAPS)的深入研究,NLRC4相关自身炎症性疾病于2014年被首次提及。研究表明NLRC4基因功能获得性突变所导致自发/增强炎症小体的异常活化是引起小儿小肠结肠炎和复发性巨噬细胞活化综合征(Macrophage activation syndrome,MAS)的原因[36,37]。
MAS是一种以急性发热、全血细胞减少、肝胆功能障碍、凝血功能障碍及血清铁蛋白持续升高为特征的综合征[38],临床上类似于致命的嗜血细胞性淋巴组织细胞增多症,通常被归类于免疫缺陷。其是儿童慢性风湿性疾病的严重并发症,通常使风湿性疾病特别是全身型幼年特发性关节炎(systemic juvenile idiopathic arthritis,sJIA)和成人斯蒂尔病(Adult onset still′s disease,AOSD)复杂化。尽管IL-1β和IL-18在骨髓细胞中表达并在活化的炎症小体参与下成熟并释放到胞外,但在发现NLRC4-MAS之前,感染性疾病患者的血清中并未检测到大量的IL-1β和IL-18。相反在sJIA和AOSD,尤其是MAS患者中可检测到极高水平的IL-18[39,40]。因此,尽管NLRC4与感染性疾病及MAS均相关,但IL-18的高水平似乎只与后者相关。且患有难治性重症MAS的患者在使用IL-18阻断剂及γ干扰素阻断剂(一种与IL-18诱导产生的细胞因子)后疗效较好[41]。这表明IL-18可能是炎症性疾病的潜在靶标。
不同于其他炎症肠病,NLRC4相关小肠结肠炎病例均发生在婴儿早期,其炎症可波及从胃到结肠的整个肠道,病变发生在十二指肠的患者症状较轻。NLRC4相关小肠结肠炎患者的肠道活组织检查和尸检结果均表现为混合的炎症浸润,伴有组织水肿、上皮糜烂和组织自溶[42,43]。目前研究发现该病的发生与NLRC4基因突变相关,常见的突变位点为:V341A、T337S、T337N和S171F[33,42,44,45]。第337和341位氨基酸均位于炎症小体NOD结构域中,NLRC4晶体分析表明第341位氨基酸在ADP转化为ATP的过程中发挥着重要的作用,其突变可影响炎症小体的活化过程[42]。337位氨基酸可通过与170位和173位相互作用以稳定炎症小体的ADP结合位点结构[33]。据推测,用苯丙氨酸代替171位丝氨酸可改变上述相互作用,从而影响炎症小体活化,导致NLRC4相关小肠结肠炎发生。令人震惊的是尽管结肠炎婴儿伴发MAS、血清IL-18水平维持在较高水平,但能从婴儿期存活下来的患者的胃肠疾病可以痊愈[36,37]。因此,早期肠道定植可能会促进NLRC4相关小肠结肠炎患者细胞因子产生,该疾病的自然消退可能与肠道成熟、肠道黏膜免疫及肠道菌群相关。NLRC4在肠道防御中的作用提示NLRC4和IL-18与肠道微生态及免疫稳态之间存在复杂的相互作用。
除了MAS和小肠结肠炎,研究发现在患有FACS4(一种自身炎症性疾病)的儿童体内存在NLRC4突变体H443P[46]。Volker-Touw等[47]发现另一多种自身炎症表型的家系(包括荨麻疹和结节性皮疹、结膜炎、关节炎等)也与NLRC4的错义突变相关。血清IL-18在该家系成员中显著升高。Kawasaki等[48]记录了一位具有严重冷炎素相关周期热综合征临床症状的患者,该患者具有新型NLRC4突变的体细胞嵌合体。因此,NLRC4与自身炎症性疾病具有明确的联系。NLRC4激活对类花生酸生成的特异性尚未在这些患者中进行评估,但抑制环氧合酶在除轻度患者以外的所有治疗中都疗效不佳。
大量研究表明NLRC4突变的氨基酸位置与自身炎症性疾病表型之间存在一定的相关性。Unal等[49]发现在1例患有sJIA和复发MAS的患儿中,其发生了W374X突变。H443P突变可增加NLRC4与SUG1和泛素化蛋白质的相互作用,并最终在人肺上皮细胞系中驱动CASP8依赖性细胞凋亡[50]。发生在核苷酸结合域(Nucleotide binding domain,NBD)内的第171位及第177位突变分别导致子宫复发性巨噬细胞活化综合征,胎盘血栓形成及严重冷炎素相关周期热综合征,迄今为止公布的所有突变都发生在ADP/ATP结合位点附近[5]。目前,对于NLRC4参与免疫调控的机制研究主要集中在利用小鼠基因敲除模型证明NLRC4在各种细菌中激活CASP1的作用。NLRC4及相关信号通路在sJIA和AOSD等常见疾病及宿主防御方面的机制仍待进一步研究及验证。
6 小结
尽管NLRC4炎症小体相关的研究开始较晚,但目前研究已为炎症小体和自身炎症疾病的关系提供了较为确切的依据。关于鼠NLRC4活性的微生物学和细胞免疫学的研究已经证实NLRC4在固有免疫宿主防御机制中的重要作用,并确定了其作用位点的调节途径、调节机制(如磷酸化)、相互作用的对象(例如其他NLRs、CASP8)和效应机制。为指导人类炎症性疾病的预防和治疗,NLRC4与人类炎症性疾病的关联,尤其是其与IL-18、MAS和婴儿小肠结肠炎的独特关联需要更进一步的研究。
