葛根素对oxLDL诱导的THP-1巨噬细胞TLR4-NF-κB信号转导通路的影响①
2019-12-27张程美王高频
张程美 王高频
(锦州医科大学附属第一医院,锦州 121000)
动脉粥样硬化(Atherosclerosis,AS)以不平衡的脂质代谢激活固有免疫系统,诱发免疫细胞积聚于动脉壁为特征,固有免疫细胞释放的蛋白水解酶、炎症细胞因子及趋化因子之间的相互作用是导致粥样斑块形成与发展的主要原因,AS属于慢性炎症性免疫疾病[1,2]。巨噬细胞作为AS发生发展的关键细胞,出现于AS各阶段[3],其高表达的模式识别受体Toll样受体4 (Toll-like receptor 4,TLR4),通过介导炎症反应在AS过程中发挥重要作用[4]。研究发现,TLR4基因缺陷小鼠巨噬细胞诱导的TNF-α分泌减少,小鼠在主动脉中形成更少的动脉粥样硬化病变,提示TLR4能促进动脉粥样硬化斑块的形成[5]。
目前,临床多采用他汀类西药治疗AS,能有效减少胞内胆固醇和脂蛋白的合成和分泌,抑制血管炎症反应,改善血管内皮功能,稳定粥样斑块,延缓AS程度等作用,但会引发肝功能受损、肌肉疼痛等毒副作用,使其在临床应用中受到限制[6]。我国药理学研究发现,葛根素具有调脂降压、抗炎、抗氧化、抗血栓、改善血管内皮功能、扩张冠状动脉等心血管系统保护功效[7,8]。最近研究表明,葛根素具有抗动脉粥样硬化功效,但机制尚不明确[9]。内皮下巨噬细胞通过摄取大量氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL)形成泡沫细胞,并与坏死细胞碎片共同构成AS斑块的脂质核心[10,11]。因此,本实验通过葛根素低、高剂量干预oxLDL诱导的THP-1巨噬细胞,以TLR4-NF-κB通路为切入点,探讨葛根素抗AS的潜在机制,以期为优化临床AS治疗方案提供新思路。
1 材料与方法
1.1材料 THP-1细胞购自中国科学院上海细胞库;葛根素(C21H20O9,分子量416.378)购自浙江康恩贝制药股份有限公司(规格2 ml:0.1 g,国药准字H33020186);RPMI1640培养基、胎牛血清、青霉素、链霉素购自美国Gibco公司;佛波酯(Phorbol 12-myristate 13-acetate,PMA)、氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL)购自美国Sigma公司;MTS试剂盒购自美国Biolegend公司;Rneasy®Mini Kit购自德国Qiagen公司;One step SYBR®Prime ScriptTMRT-PCR Kit购自日本TaKaRa公司;TLR4、MyD88、NF-κB、β-actin抗体、HRP IgG二抗购自美国Invitrogen公司;含DAPI的抗荧光淬灭封片剂、Triton X-100、SDS-PAGE凝胶制备试剂盒购自北京索莱宝公司。
1.2方法
1.2.1细胞培养 THP-1细胞用RPMI1640培养液(含10%胎牛血清+100 U/ml 青霉素+ 100 μg/ml链霉素),于37℃、5%CO2培养箱中培养。当细胞呈对数生长时用100 nmol/L PMA刺激24 h,诱导THP-1细胞分化成巨噬细胞用于后续实验。实验分为4组:对照组、oxLDL组、葛根素低剂量组和葛根素高剂量组。对照组:仅加入RPMI1640培养液,oxLDL组:RPMI1640培养液+oxLDL(50 μg/ml),葛根素低/高剂量组:RPMI1640培养液+oxLDL(50 μg/ml)+葛根素(低/高剂量的确定依据MTS结果)。培养24 h后进行后续实验(qPCR、Western blot、细胞免疫荧光)。
1.2.2MTS法检测细胞增殖能力 细胞以1×104个/孔接种于96孔板中,37℃ 5%CO2培养24 h。加入oxLDL(50 μg/ml)及不同浓度(10、50、100、500、1 000、2 000 μg/ml)的葛根素处理细胞,每个浓度做4个复孔。设置对照孔(仅加oxLDL),培养箱中继续培养24 h。加MTS 20 μl/孔,轻振均匀,用锡纸避光,继续培养4 h,酶标仪上轻振混匀(10 s/次×3次),波长490 nm测OD值。
1.2.3流式细胞术检测细胞凋亡 单细胞悬液制备:用无菌吸管将孔内的液体吸至15 ml离心管中,取2 ml预冷的PBS反复轻吹孔内细胞,将孔内细胞全部转至15 ml离心管中,1 500 r/min离心5 min,弃上清。加入500 μl Binding Buffer重悬细胞。细胞染色:加入Annexin V-FITC 5 μl和7-AAD 3 μl,Votex。室温避光孵育5~15 min。流式细胞仪检测。
1.2.4qPCR检测IL-6、TNF-α、IL-1β及TLR4、MyD88、NF-κB mRNA 取200 μl细胞沉淀用Rneasy®Mini Kit提取细胞总RNA,步骤按Qiagen说明书进行。PCR反应条件:42℃ 5 min,94℃ 10 s;94℃ 5 s,60℃ 30 s,40 cycles;绘制溶解曲线:95℃ 15 s,60℃ 1 min,95℃ 15 s。采用公式2-ΔΔCT计算待检指标mRNA的相对表达。引物见表1。
1.2.5Western blot检测TLR4、MyD88、NF-κB表达 在各组细胞中加入适量的Lysis buffer与PMSF混合液,裂解细胞,12 000 r/min离心10 min,取少量上清进行BCA定量。用Protein loading buffer将各组细胞定等浓度后,100℃变性10 min,分装,-80℃保存。10%SDS-PAGE电泳分离蛋白。120 mA 100 min转PVDF膜,BSA室温封闭1 h。加1∶500 TLR4/1∶1 000 MyD88/1∶1 000 NF-κB/1∶5 000 β-actin一抗稀释液,4℃摇床过夜。TBST洗涤3遍,1∶5 000 HRP IgG二抗室温孵育1 h,TBST洗涤3遍,加入ECL显色剂A,B。ECL化学发光成像,用Image J软件分析条带灰度值。
表1 引物序列
Tab.1 Primer sequence
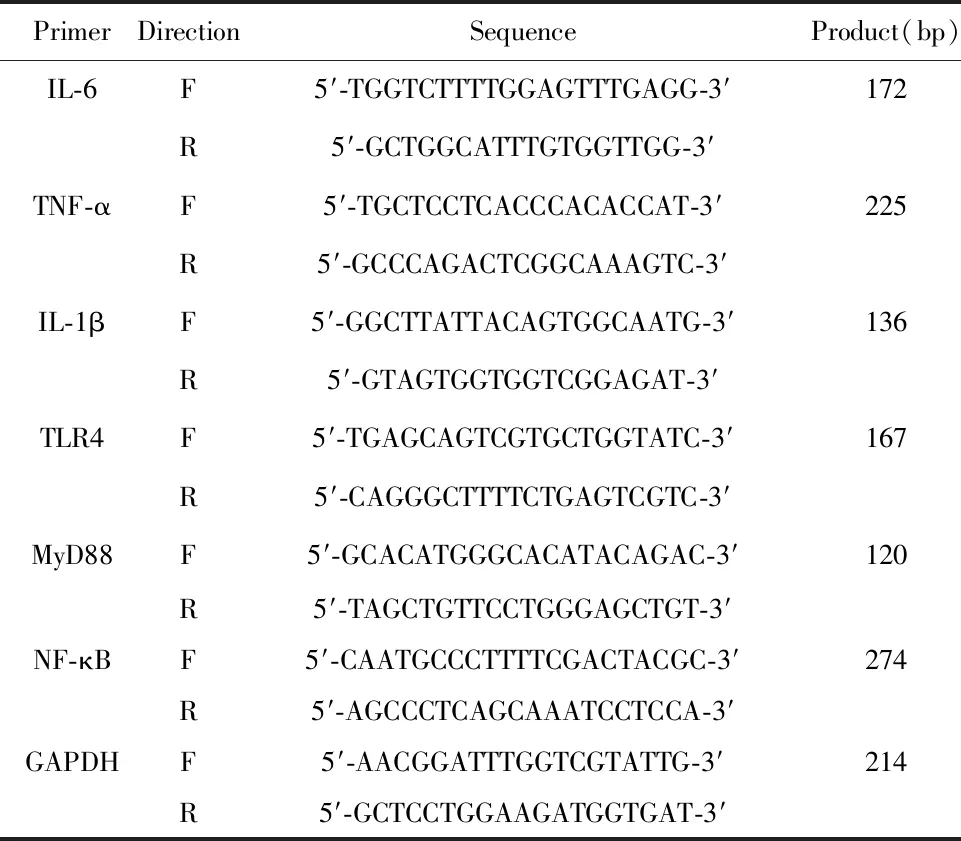
PrimerDirectionSequenceProduct(bp)IL-6F5′-TGGTCTTTTGGAGTTTGAGG-3′172R5′-GCTGGCATTTGTGGTTGG-3′TNF-αF5′-TGCTCCTCACCCACACCAT-3′225R5′-GCCCAGACTCGGCAAAGTC-3′IL-1βF5′-GGCTTATTACAGTGGCAATG-3′136R5′-GTAGTGGTGGTCGGAGAT-3′TLR4F5′-TGAGCAGTCGTGCTGGTATC-3′167R5′-CAGGGCTTTTCTGAGTCGTC-3′MyD88F5′-GCACATGGGCACATACAGAC-3′120R5′-TAGCTGTTCCTGGGAGCTGT-3′NF-κB F5′-CAATGCCCTTTTCGACTACGC-3′274R5′-AGCCCTCAGCAAATCCTCCA-3′GAPDHF5′-AACGGATTTGGTCGTATTG-3′214R5′-GCTCCTGGAAGATGGTGAT-3′
1.2.6细胞免疫荧光对TLR4定位 步骤:①各组细胞爬片。②4%多聚甲醛1 ml/孔,固定15 min,预冷PBS清洗,5 min/次×3次。③透膜:0.5% Triton X-100 1 ml/孔,20 min,预冷PBS清洗,5 min/次×3次。④2%BSA封闭30 min,加入TLR4稀释液(1∶200)200 μl/孔,4℃过夜。⑤预冷PBS清洗,5 min/次×3次,加入1∶1 000稀释的DyLight488标记的二抗,200 μl/孔,室温避光1 h。⑥预冷PBS清洗,5 min/次×3次,用镊子将爬片从培养板孔中取出,在爬片细胞面滴加25 μl含DAPI的抗荧光淬灭封片剂,盖在洁净的封片上,荧光显微镜下观察。
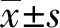
2 结果
2.1PMA诱导分化的THP-1巨噬细胞 倒置显微镜下观察未分化THP-1单核细胞多呈圆形、类圆形,透亮状。经PMA诱导24 h后向THP-1巨噬细胞分化,细胞形态不规则,多呈梭形,伪足状。见图1。
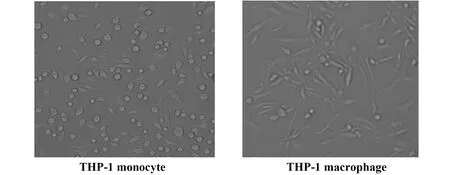
图1 THP-1单核/巨噬细胞光镜形态(×100)Fig.1 Light microscopic morphology of THP-1 monocyte macrophages (×100)
2.2不同浓度葛根素对oxLDL诱导的THP-1细胞增殖的影响 与对照组(oxLDL)比较,葛根素浓度为10、50、100 μg/ml时对THP-1细胞增殖水平无明显作用(P>0.05)。当葛根素浓度增至500、1 000、2 000 μg/ml时,明显抑制THP-1细胞增殖能力(P<0.01), 且呈剂量依赖性,即药物浓度越高对细胞增殖的抑制性就越强。因此,本实验选取的葛根素低、高剂量分别为10 μg/ml和100 μg/ml。见图2。
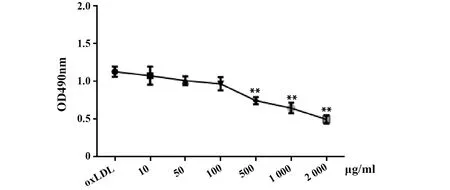
图2 葛根素对oxLDL诱导的THP-1细胞增殖作用Fig.2 Puerarin on oxLDL-induced proliferation of THP-1 macrophagesNote:Compared to LDL group,**.P<0.01.
2.3葛根素对oxLDL诱导的THP-1细胞凋亡的影响 oxLDL诱导的THP-1细胞主要发生细胞的早期凋亡,与对照组比较差异具有统计学意义(P<0.01);低、高剂量葛根素组在葛根素干预24 h时能明显降低细胞凋亡比例,与oxLDL组比较差异具有显著统计学意义(P<0.01);而高剂量组凋亡比例低于低剂量组(P<0.05)。见图3、4。
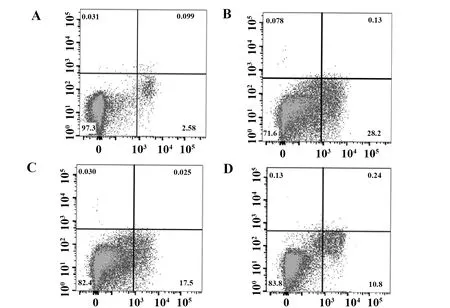
图3 葛根素降低oxLDL诱导的THP-1细胞凋亡比例Fig.3 Puerarin reduced proportion of oxLDL-induced apoptosis in THP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerain group;D.High-dose of puerain group.
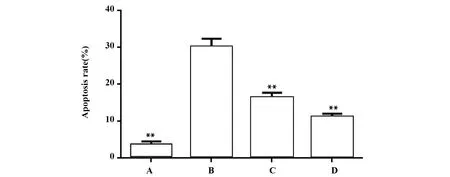
图4 葛根素降低oxLDL诱导的THP-1细胞凋亡比例Fig.4 Puerarin reduced proportion of oxLDL-induced apoptosis in THP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerarin group;D.High-dose of puerarin group;Group A,C,D compared with group B,**.P<0.01.
2.4IL-6、TNF-α、IL-1β及TLR4、MyD88、NF-κB mRNA表达 oxLDL诱导的THP-1巨噬细胞能显著提高细胞IL-6、TNF-α、IL-1β及TLR4、MyD88、NF-κB mRNA表达量(P<0.01);与oxLDL组比较,葛根素低、高剂量组IL-6、TNF-α、IL-1β及TLR4、MyD88、NF-κB mRNA表达有不同程度的减少(P<0.01),而高剂量组IL-6、TNF-α、IL-1β下降的幅度高于低剂量组(P<0.05)。见图5。
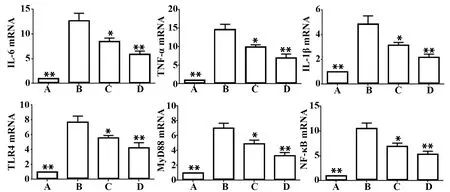
图5 THP-1巨噬细胞IL-6、TNF-α、IL-1β及TLR4、MyD88、NF-κB表达Fig.5 Expression of IL-6,TNF-α,IL-1β and TLR4,MyD88 and NF-κB in THP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerarin group;D.High-dose of puerarin group;Group A,C,D compared with group B,*.P<0.05,**.P<0.01.
2.5TLR4、 MyD88、 NF-κB蛋白表达 oxLDL诱导的THP-1巨噬细胞能上调TLR4、MyD88、NF-κB蛋白表达(P<0.01);与oxLDL组比较,葛根素低、高剂量不同程度下调TLR4、MyD88、NF-κB表达(P<0.05),而高剂量组下调幅度高于低剂量组(P<0.05)。见图6、7。
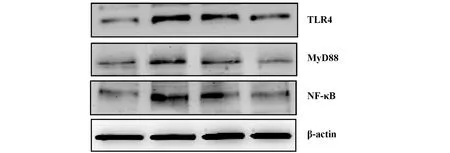
图6 THP-1巨噬细胞TLR4、MyD88、NF-κB表达Fig.6 Expression of TLR4,MyD88 and NF-κB in THP-1 macrophages
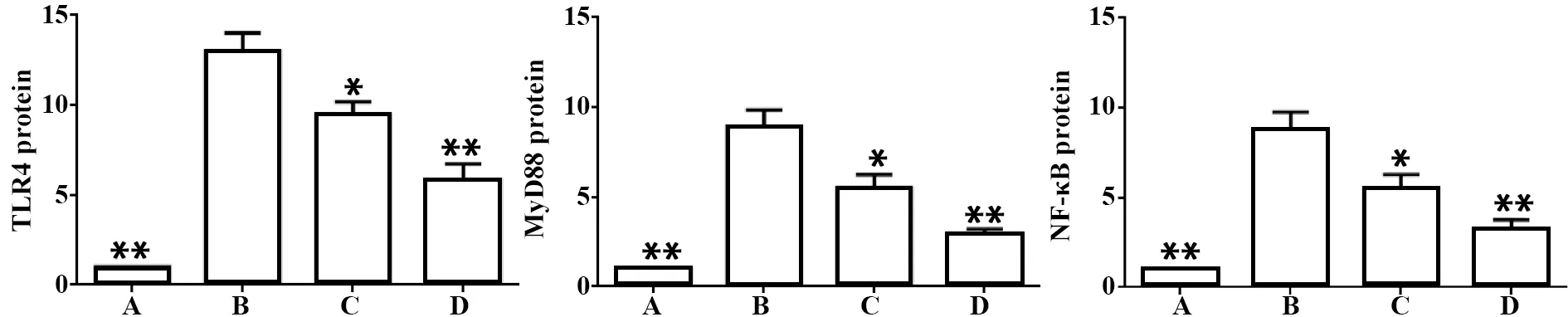
图7 THP-1巨噬细胞TLR4、MyD88、NF-κB相对表达Fig.7 Relative expression of TLR4,MyD88 and NF-κB in THP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerarin group;D.High-dose of puerarin group;Group A,C,D compared with group B,*.P<0.05,**.P<0.01.
2.6细胞免疫荧光对TLR4、MyD88、NF-κB定位 以荧光染色对细胞定位可见,TLR4表达于细胞膜,MyD88表达于胞质,NF-κB表达于胞核。oxLDL刺激后THP-1巨噬细胞TLR4、MyD88和NF-κB荧光强度明显增强,而葛根素低、高剂量组TLR4、MyD88和NF-κB荧光强度有不同程度减弱,且葛根素高剂量组降低的幅度更大。见图8~10。
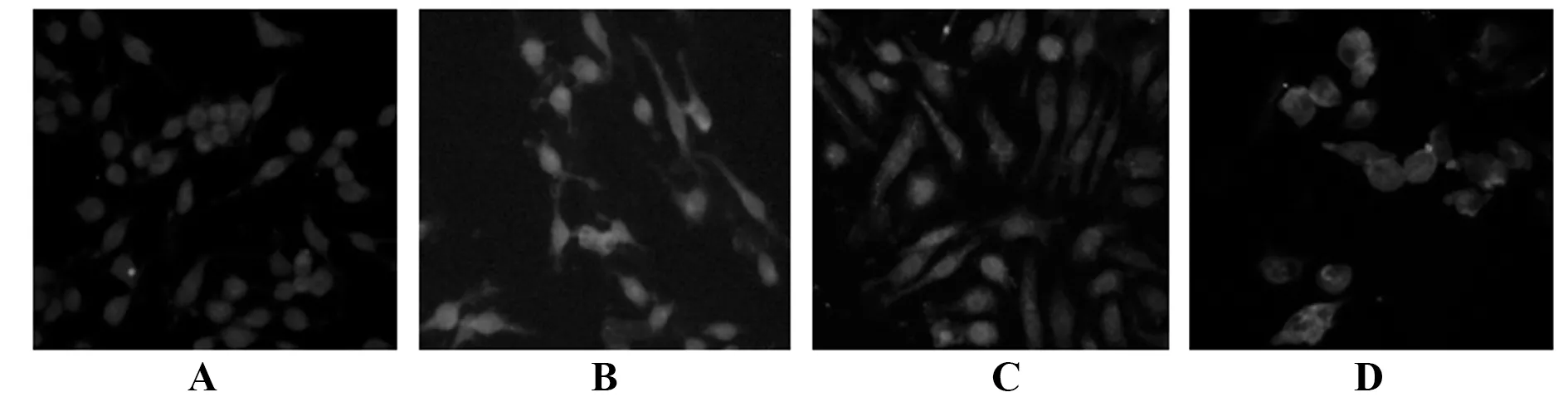
图8 THP-1巨噬细胞TLR4表达定位Fig.8 Expression of TLR4 in THP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerarin group;D.High-dose of puerarin group.
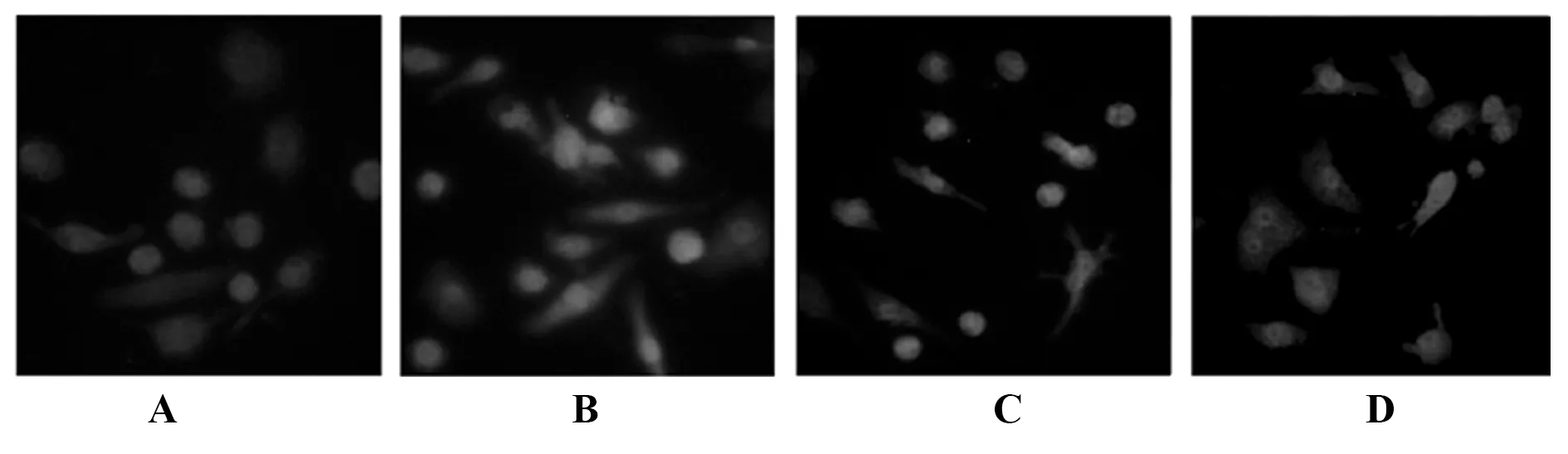
图9 THP-1巨噬细胞MyD88表达定位Fig.9 Expression of MyD88 in THP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerarin group;D.High-dose of puerarin group.
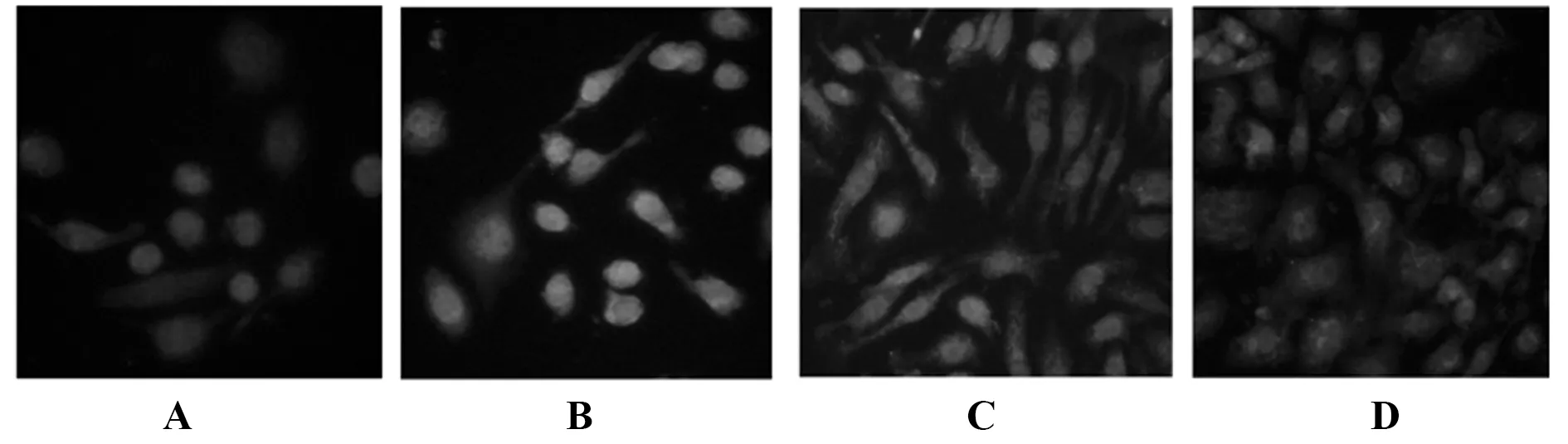
图10 THP-1巨噬细胞NF-κB表达定位Fig.10 Expression of NF-κB inTHP-1 macrophagesNote:A.Control group;B.oxLDL group;C.Low-dose of puerarin group;D.High-dose of puerarin group.
3 讨论
动脉粥样硬化是以炎症浸润、氧化应激反应及激活免疫应答为特征的慢性炎症性血管病。在AS早期,血液中的单核细胞在P-选择素、单核细胞趋化蛋白(MCP-1)等趋化因子作用下向病变位置内膜迁移并通过内皮间隙到达皮下组织,分化为巨噬细胞。巨噬细胞表达的清道夫受体摄取oxLDL,活化的巨噬细胞分泌细胞因子、活性氧和基质蛋白酶等。但是由于oxLDL大量产生超过机体清除范围,持续沉积导致巨噬细胞转化为泡沫细胞并形成脂池,最终形成AS斑块[12,13]。中药葛根素被证实在心绞痛、心力衰竭、心肌缺血等心血管疾病治疗方面具有保护效应。本实验旨在研究葛根素通过调节巨噬细胞功能抑制炎症反应,进而发挥抗动脉粥样硬化的作用。
巨噬细胞是兼有促炎与抗炎功能的异质性细胞群,在不同的刺激下向M1型或M2型转化。M1型(经典激活型)具有促炎功能,分泌炎性因子介导炎症反应,M2型(替代激活型)具有抗炎功能,释放多种抗炎介质,参与组织修复,与心血管疾病的发生呈负相关。研究发现,AS形成的部位存在大量M1型巨噬细胞浸润,并在oxLDL的慢性刺激下转化为泡沫细胞(AS标志性细胞),促进脂质颗粒沉积形成斑块,导致血管狭窄[14]。本研究结果显示oxLDL作用下的THP-1巨噬细胞能提高M1型巨噬细胞重要标志因子IL-6、TNF-α、IL-1β mRNA水平。而低、高剂量葛根素的干预能抑制oxLDL介导的炎症因子产生,提示葛根素或通过抑制M1型巨噬细胞促炎作用,或促进M1型向M2型巨噬细胞转变,进而发挥抗炎功能,减缓AS慢性炎症反应过程及斑块形成进展。魏群[15]、周凤华[16]等体内实验表明葛根素能抑制AS斑块形成,明显延缓AS病变进展,此作用可能与葛根素下调AS进程中的炎症反应有关。
Katsargyris等[17,18]报道AS斑块中TLR4强表达,用TLR4激活剂可诱导AS斑块形成及血管重构。本实验结果显示,oxLDL作用下的THP-1巨噬细胞上调TLR4、MyD88、NF-κB mRNA和蛋白表达水平。研究表明CD36和oxLDL共同作用能促进巨噬细胞辅助受体TLR4和TLR6复合物形成,进而诱导下游氧化还原分子活化,激活转录因子NF-κB,活化巨噬细胞并释放炎性细胞因子。刁文晶[19]研究证实葛根素通过TLR4/NF-κB信号通路发挥抗炎功效,诱导结肠癌sw480细胞发生细胞凋亡,抑制癌症的进展。本研究显示葛根素可降低oxLDL诱导的THP-1巨噬细胞TLR4、MyD88、NF-κB表达上调,通过下调TLR4-NF-κB信号转导通路进而抑制oxLDL诱导的THP-1巨噬细胞活化,对AS形成发挥抑制作用。结合炎性细胞因子的实验结果,可见葛根素作为具有抗氧化效应的异黄酮类化合物能够有效降低oxLDL诱导的TLR4-NF-κB通路的活化状态,进而下调IL-6、TNF-α、IL-1β等炎性细胞因子的表达,发挥抗炎和抗AS功效。由于在脂质的形成、斑块的形成及破裂等AS发展进程中炎性细胞因子发挥主导性作用。因此,葛根素靶向作用于抗炎通路TLR4-NF-κB,直接抑制炎性因子的产生,发挥的抗AS作用针对慢性炎症本身,作用更直接有效。本文为动脉粥样硬化患者提供潜在的治疗方法,为葛根素的临床应用提供实验依据。葛根素心血管保护的细胞及分子机制,尤其是药物作用的靶位点,仍有待进一步深入研究。
