人5型腺病毒结合抗体检测方法的建立和应用
2019-12-25王玉东赵拯浩宋小红陈旖王步森吴诗坡侯利华
王玉东,赵拯浩,宋小红,陈旖,王步森,吴诗坡,侯利华
军事科学院军事医学研究院生物工程研究所,北京100071
腺病毒是一种无包膜的双链DNA 病毒,基因长度为34~43 kb,直径70~90 nm,相对分子质量约2×108[1]。迄今已记录了90 多种人腺病毒血清型,并根据其血清学和分子特征分为7 个亚属(A~G)[2-3]。腺病毒主要引起人呼吸道、胃肠道、眼睛、膀胱等部位感染[4-5]。近年来,随着免疫学、微生物学、分子生物学等学科的快速发展和相互交叉渗透,腺病毒在基因和分子治疗上的应用越来越广泛。由于可实现高水平的外源基因表达、安全性高、可快速激发高效的特异性免疫反应、易于改构、便于大规模制备等优点,重组腺病毒载体己被广泛用于疫苗研制[6]。目前重组腺病毒载体已用于研发多种传染病疫苗,如埃博拉病毒、马尔堡病毒、人类乳头瘤病毒、乙肝病毒、丙肝病毒、狂犬病毒、流感病毒和疟原虫疫苗等[7]。与其他重组载体相比,人5 型腺病毒(human adenovirus type 5,HAdv5)载体的优势在于高重组病毒产量、安全性好,以及在广泛的真核细胞中均能实现较高的外源基因表达水平[8-9],并且可以诱导强烈的细胞免疫反应[10-11]。
目前,血清中腺病毒抗体的检测方法大多是检测中和抗体,主要有2 种方法。一种是细胞病变法,检测步骤是将灭活血清与腺病毒孵育后感染细胞,用显微镜观察和计数腺病毒介导的细胞病变效应(cytopathic effect,CPE)[12]。这种方法用时较长,一般需要4~8 d,对病变情况的观察具有一定的主观性,且灵敏度较低。另一种方法是报告基因法,血清中的中和抗体能够抑制病毒感染从而降低报告基因在感染细胞中的表达水平,通过检测报告基因表达被抑制的程度来确定中和抗体水平。常用的报告基因有LacZ、GFP 和萤光素酶基因等[13]。相比于细胞病变法,报告基因法有用时短、操作简单、评判指标客观、灵敏度高的优点。然而,无论是细胞病变法还是报告基因法,腺病毒中和抗体检测方法存在耗时较长、血清用量较大、对实验设备要求较高、实验成本高等问题。因此,建立一种灵敏、快速、稳定的HAdv5 抗体检测方法具有重要的应用价值。本研究在制备HAdv5-Hexon 蛋白的基础上,建立了HAdv5 结合抗体检测的ELISA 法,可用于SPF 级动物模型HAdv5 载体结合抗体滴度检测,为HAdv5 载体疫苗的小动物模型评价提供了一种简单快捷的针对载体的抗体检测方法。
1 材料与方法
1.1 材料
293 F 细胞由本室保存;重组腺病毒以及用于检测方法建立和验证的小鼠血清为研究室自备;293F 培养基、BCA 法检测试剂盒和蛋白marker 购自Thermo Scientific 公司;核酸酶和牛血清白蛋白购自Sigma 公司;HAdv5-Hexon 蛋白和HRP 标记的山羊抗小鼠IgG 抗体购自Abcam 公司;DMEM培养基、胎牛血清和青链霉素双抗购自Gibco 公司;萤光素酶检测底物和细胞裂解液购自Promega公司;SDS-PAGE 蛋白胶购自金斯瑞生物科技有限公司;脱脂奶粉购自BD 公司;化学发光液购自Millipore 公司;ELISA 显色液购自Solarbio 公司;Source 30Q 和Sepharose 4FF 层析柱购自GE 公司;TSK-GEL G3000SWXL 柱购自Tosoh 公司;96孔酶标板和96 孔细胞培养板购自Corning 公司。
1.2 HAdv5 抗原的表达与纯化
将复制缺陷型HAdv5 以5~10 MOI 感染293F细胞,于36.5℃、5% CO2摇床120 r/min 摇动培养3~5 d,从感染后第2 d 起每天检测细胞活率,当细胞活率下降至40%以下时收获细胞培养液。将细胞培养液于-70℃反复冻融3 次,8000 r/min离心30 min,取上清,加入核酸酶至终浓度10 U/mL,37℃孵育1 h,0.45 μm 滤膜抽滤去除杂质。用AKTA Purifier 纯化仪对HAdv5 抗原蛋白进行Source 30Q 和Sepharose 4FF 两步层析纯化。对于Source 30Q 层析,层析柱用平衡缓冲液(20 mmol/L Tris,150 mmol/L NaCl,2 mmol/L MgCl2,pH7.5)平衡后A 泵上样,上样结束后再次平衡至UV 基线,5 mL/min,60 min,0~20% B 梯度洗脱,分管收集洗脱峰,最后100% B 直接洗脱(B 液为20 mmol/L Tris、2 mol/L NaCl、2 mmol/L MgCl2,pH7.5)。用Sepharose 4FF 对HAdv5 抗原蛋白进一步纯化,流动相为0.1 mol/L PBS,流速5 mL/min,限压0.3 MPa,收集外水体积峰。将收集到的样品进行SDS-PAGE,合并蛋白条带一致的样品,用30 kDa 超滤管浓缩,BCA 法检测样品浓度。
1.3 HAdv5 抗原的鉴定
分别采用HPLC、SDS-PAGE 和Western 印迹鉴定纯化的HAdv5 抗原,检测对象为HAdv5 抗原蛋白、复制缺陷型HAdv5 病毒和市售的HAdv5-Hexon。HPLC 色谱柱为TSK-GEL G3000SWXL,流动相为250 mmol/L PBS(Na2HPO454.65 g、NaH2PO415.25 g、NaCl 8.5 g 溶于1 L 去离子水,pH6.8,0.22 μm 滤膜抽滤),室温,流速0.8 mL/min,进样体积20 μL,检测波长214 nm。SDSPAGE 使用12% PAGE 胶,每孔上样20 μL,170 V 恒压电泳约1 h,用金斯瑞eBLOT L1 蛋白染色仪对凝胶进行染色和脱色。Western 印迹检测一抗为HAdv5 免疫小鼠血清。用12% PAGE 胶完成SDS-PAGE 之后,将凝胶上的蛋白质电转至PVDF膜上,5%脱脂奶粉封闭1 h,一抗(1∶5000 稀释)室温孵育2 h,洗膜4 次,二抗(HRP 标记山羊抗小鼠IgG 抗体,1∶20 000 稀释)温室孵育1 h,洗膜4 次,用化学发光液显色3~5 min,于化学发光成像系统上成像。
1.4 ELISA 检测方法的建立
实验前1 d,将HAdv5-Hexon 蛋白以适当的浓度包被于96 孔酶标板中,4℃过夜(12~24 h)。实验当天,将酶标板从冰箱取出,用洗液(PBS+0.2%吐温20)洗板3 次,2% BSA 于37℃封闭1 h;洗板3 次,待测血清以适当的初始稀释度于酶标板内进行1∶3 梯度稀释,根据具体情况设定8~12个稀释度,酶标板于37℃孵育1 h;洗板5 次,每孔加入1∶10 000 稀释的HRP 标记山羊抗小鼠IgG 抗体100 μL,37℃孵育1 h;洗板5 次,每孔加入TMB 单组分显色液100 μL,室温避光显色8~10 min,每孔加入50 μL 终止液终止反应;于酶标仪上读取D450nm值。每板设定4~8 个不加血清样品的空白对照孔,以空白对照孔D450nm平均值的2.1 倍作为Cut-off 值,用GraphPad Prism 软件计算血清样品的抗体滴度。在ELISA 检测方法建立过程中,分别对包被缓冲液、封闭液、HAdv5-Hexon蛋白包被浓度和二抗工作浓度进行最优化筛选。
1.5 ELISA 检测方法的验证
开展了特异性和重复性验证,并分析结合抗体滴度与中和抗体滴度的相关性。重复性验证包括板内重复、板间重复和日间重复,用以验证检测方法的稳定性。特异性验证检测了不同血清样品在本检测方法中的反应情况,包括HAdv5阳性样品、HAdv5 阴性样品、其他型别腺病毒阳性样品和其他病毒阳性样品,用以验证检测方法的特异性反应情况。相关性验证采用萤光素酶法检测HAdv5 阳性血清的中和抗体滴度[14],将ELISA 法检测的结合抗体滴度与对应样品的中和抗体滴度进行相关性分析。
1.6 HAdv5 结合抗体检测方法的应用
用本研究建立的HAdv5 结合抗体检测ELISA法检测了重组埃博拉病毒病疫苗(Ad5-EBOV)免疫小鼠血清中HAdv5 的IgG 水平。Ad5-EBOV 免疫剂量分别为每只小鼠106和107IFU,血清样品为首次免疫后0、2、4、6、8、10、12、16 周和加强免疫后2、4、10 周。计算HAdv5 结合抗体滴度并对抗体滴度随时间变化进行分析。
1.7 统计分析
用GraphPad Prism 软件进行制图和数据分析,数据以x±s表示。用Spearman 相关系数分析相关性,相关系数为0.5~1 时具有强相关性。组间比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 HAdv5-Hexon 的表达、纯化与鉴定
将293F 细胞稀释至1×106/mL,调整体积至每瓶1 L。HAdv5 以5 MOI 感染293F 细胞,于5%CO2、36.5℃摇床120 r/min 摇动培养约72 h,至细胞活率低于40%,收获细胞培养液,经Source 30Q和Sepharose 4FF 两步柱层析,获得HAdv5 抗原蛋白。Source 30Q 纯化峰图如图1A,用高盐进行梯度洗脱,出现2 个洗脱峰。第1 个峰的出峰电导值为31.9 mS/cm,第2 个峰的出峰电导值为40.2 mS/cm。根据以往经验,第2 个峰为HAdv5 病毒。SDS-PAGE 结果显示第1 个峰中含有大量蛋白,相对分子质量约为120×103(结果未示),推测其主要成分为腺病毒Hexon 蛋白。用Sepharose 4FF 对第1 个峰的蛋白进行进一步纯化,峰图如图1B,经纯化除去了该峰中存在的少量HAdv5 病毒,获得更纯的HAdv5 抗原蛋白样品。
鉴于纯化获得的HAdv5 抗原蛋白与腺病毒Hexon 蛋白相对分子质量相当,我们将其与市售的HAdv5-Hexon 进行比较分析,同时以HAdv5 病毒作为对照。HPLC 结果显示,纯化的HAdv5 抗原蛋白与市售的HAdv5-Hexon 具有完全一致的保留时间,两者保留时间与HAdv5 病毒不同(图1C)。HAdv5 抗原蛋白对应峰图主峰面积占96.7%,市售HAdv5-Hexon 对应峰图主峰面积占98.5%。SDS-PAGE 结果显示,纯化的HAdv5 抗原蛋白、市售的HAdv5-Hexon 和HAdv5 病毒具有相对分子质量大小相同的主带,为100×103~130×103,不同之处是HAdv5 病毒在相对分子质量约25×103处有一条明显的条带(图1D)。Western 印迹结果显示纯化的HAdv5 抗原蛋白、市售的HAdv5-Hexon 和HAdv5 病毒在相对分子质量为100×103~130×103处均具有特异性条带(图1E)。这些结果表明,纯化获得的HAdv5 抗原蛋白其主要成分是HAdv5 的Hexon 蛋白。
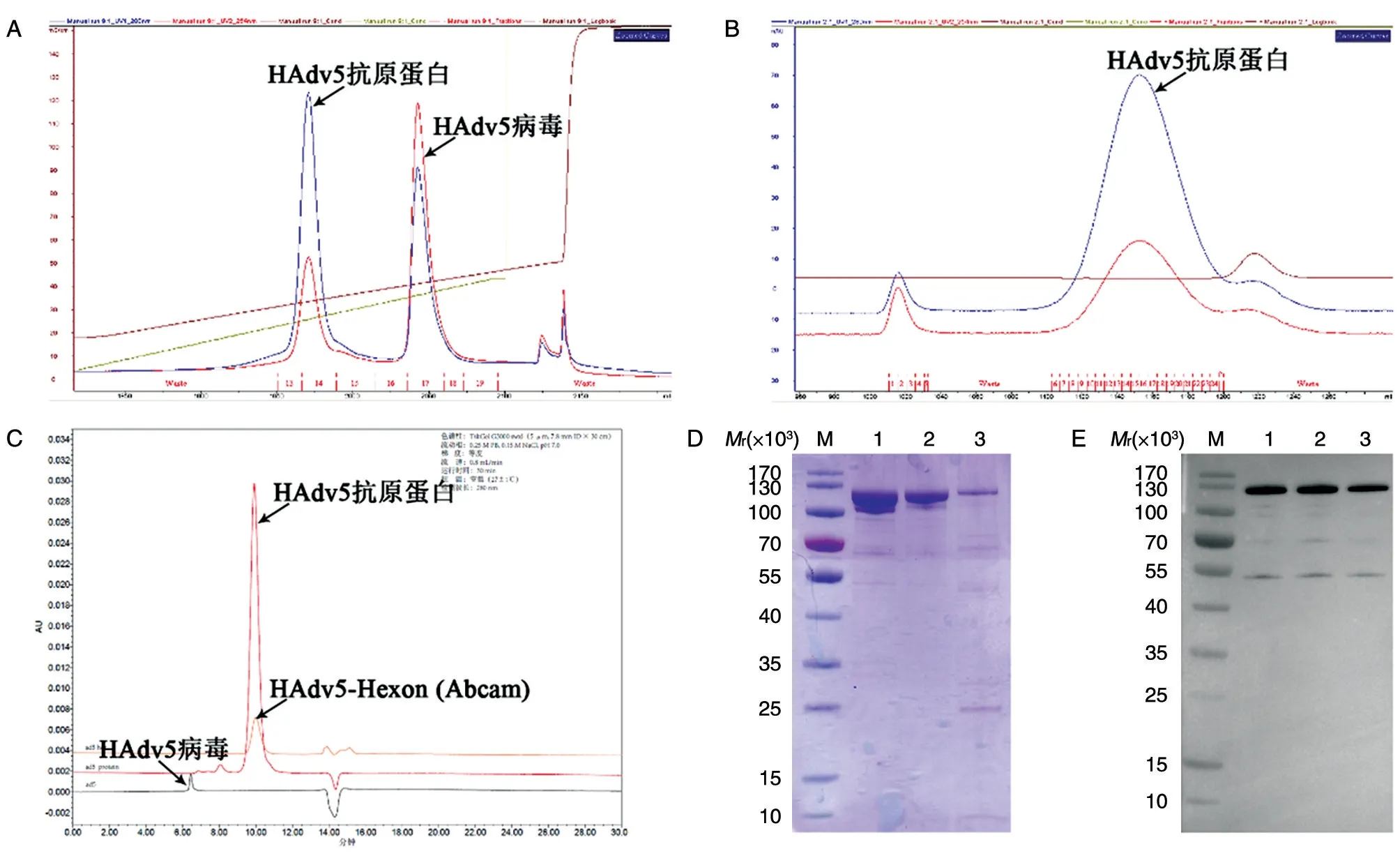
图1 HAdv5 抗原蛋白的纯化和鉴定
2.2 HAdv5 结合抗体检测方法的建立和优化
以纯化的HAdv5-Hexon 蛋白为抗原,建立HAdv5 结合抗体检测ELISA 法,并对包被缓冲液和封闭液进行筛选,对抗原包被浓度和二抗工作浓度进行验证。
分别检测了碳酸盐缓冲液(Na2CO31.59 g,NaHCO32.93 g,去离子水定容至1 L,pH9.6)、磷酸盐缓冲液和Tris-盐酸缓冲液(Tris Base 24.2 g,NaCl 80 g,浓盐酸调节pH 值为7.6,去离子水定容至1 L)作为包被液的检测效果。结果如表1,以碳酸盐缓冲液作为包被液时阳性血清样品与阴性血清样品的D450nm比值(P/N 值)最大。确定以碳酸盐缓冲液作为本检测方法的包被缓冲液。
分别检测了以1%、2%、5% BSA 和5%脱脂奶粉作为封闭液时的检测效果,结果如表2,以2%BSA 封闭,其检测结果的P/N 值最大。确定2%BSA 作为本检测方法的封闭液。
检测不同抗原包被浓度(8、4、2、1、0.5、0.25、0.12、0.06 和0.03 μg/mL)对检测结果的影响,结果如图2。在不同血清稀释率情况下,抗原包被浓度<2 μg/mL 时,D450nm值随抗原包被浓度的降低而下降;当抗原包被浓度≥2 μg/mL 时,D450nm值达到饱和。确定抗原包被浓度为2 μg/mL。
根据说明书推荐的HRP 标记的山羊抗小鼠IgG 二抗工作浓度范围,分别验证了1∶10 000、1∶20 000 和1∶50 000 等3 个工作浓度对检测结果的影响。结果如表3,在1∶10 000 的工作浓度条件下,检测结果P/N 值最大,确定1∶10 000 为本检测HRP 标记山羊抗小鼠IgG 二抗工作浓度。
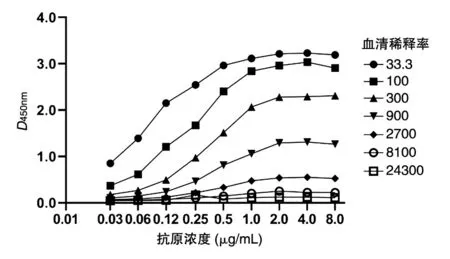
图2 抗原包被浓度对检测结果的影响
2.3 HAdv5 结合抗体检测方法的验证
分别对该检测方法的特异性和重复性进行验证,并分析由该检测方法获得的结合抗体滴度与HAdv5 中和抗体之间的相关性。
重复性验证结果见表4~6。板内重复性变异系数(CV)为1.6%~9.3%,板间重复性CV 为4.0%~13.2%,日间重复性CV 为2.8%~13.4%。这些结果表明该检测方法具有良好的重复性。
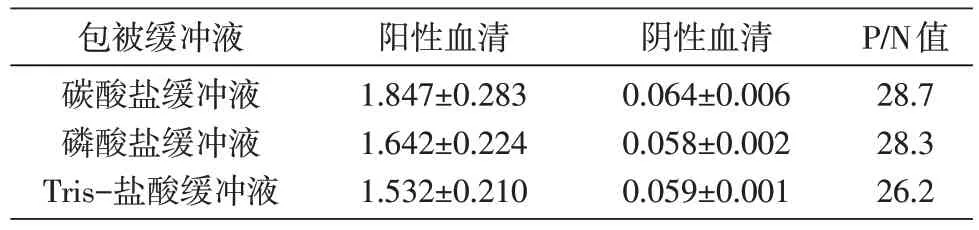
表1 不同包被缓冲液条件下阳性血清和阴性血清的D450nm值(x±s)
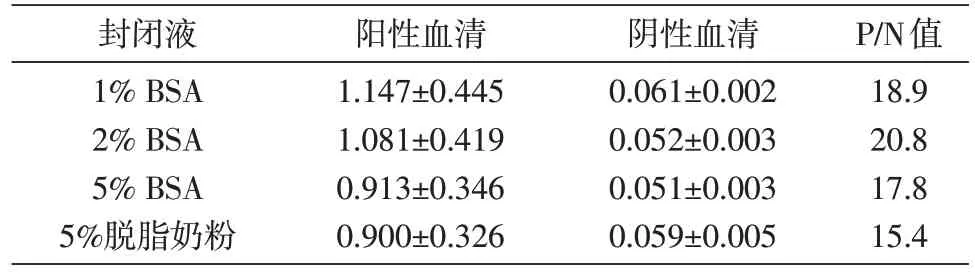
表2 不同封闭液条件下阳性血清和阴性血清的D450nm值(x±s)
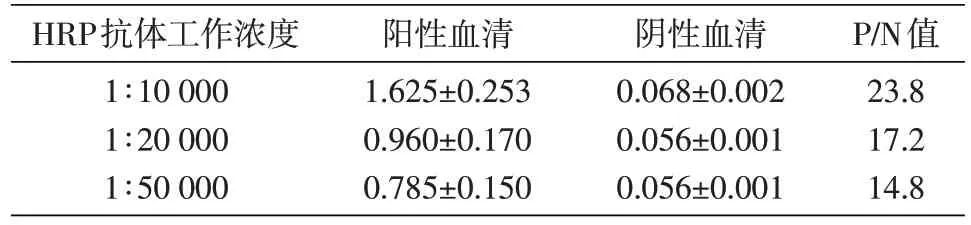
表3 不同二抗工作浓度条件下阳性血清和阴性血清的D450nm值(x±s)
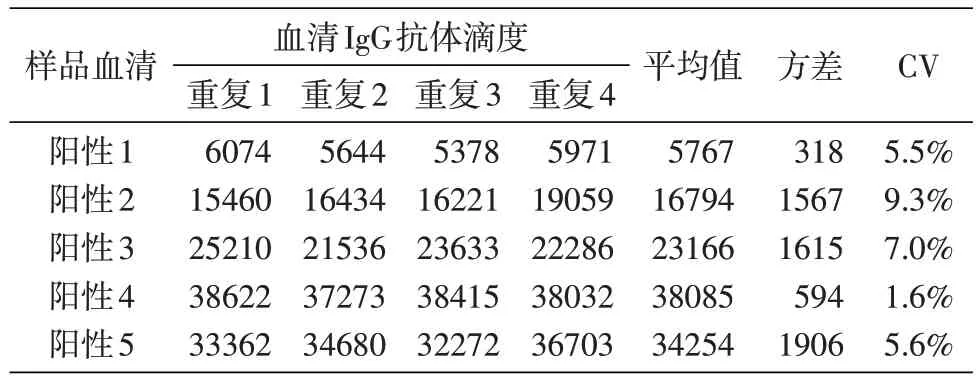
表4 板内重复性验证结果
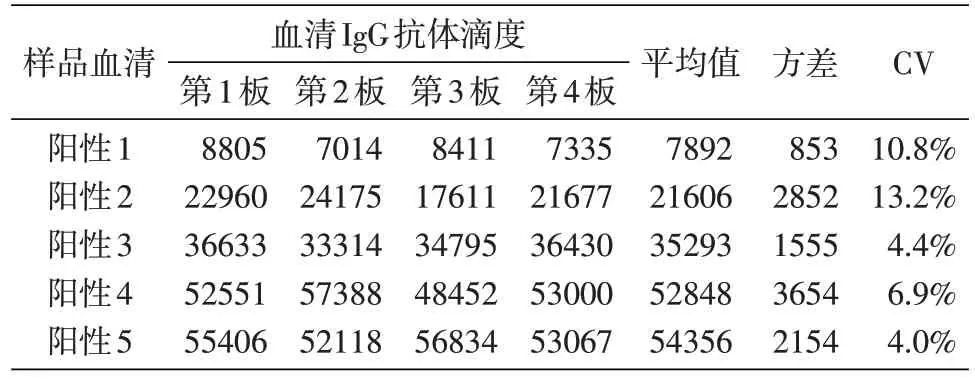
表5 板间重复性验证结果
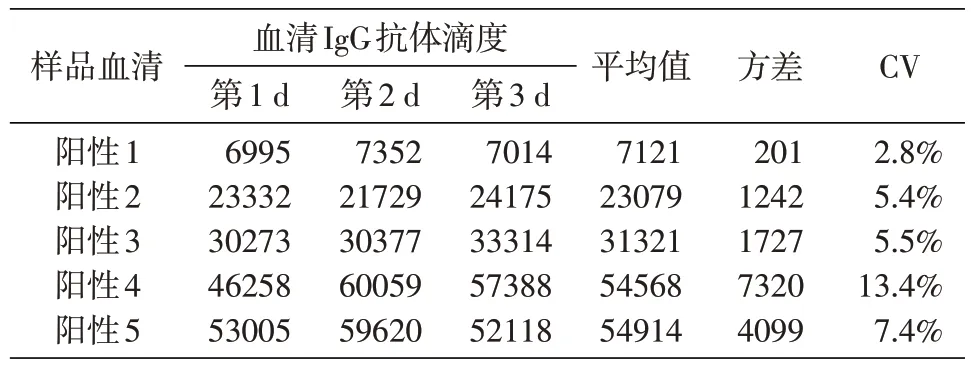
表6 日间重复性验证结果
特异性验证分别检测了HAdv5 阳性小鼠血清样品、HAdv5 阴性小鼠血清样品(NC)、人4 型腺病毒(HAdv4)阳性小鼠血清样品、人7 型腺病毒(HAdv7)阳性小鼠血清样品和水疱性口炎病毒(VSV)阳性小鼠血清样品在该检测方法中的反应情况。检测结果如图3A,HAdv5 阳性小鼠血清样品具有很高的反应水平,而HAdv5 阴性小鼠血清样品和VSV 阳性小鼠血清样品则无反应。值得注意的是,HAdv4 阳性小鼠血清样品和HAdv7 阳性小鼠血清样品在本检测中也具有一定的反应水平。结果说明该检测方法对非腺病毒病原体感染血清样品具有良好的特异性,而对其他亚型的腺病毒阳性样品具有一定水平的交叉反应性。
用相同的小鼠血清样品分别检测了HAdv5结合抗体滴度和中和抗体滴度,并对两者进行相关性分析。结果如图3B,用Spearman 相关性分析,P=0.0056,r=0.7363。结果表明HAdv5 结合抗体与HAdv5 中和抗体检测结果之间具有良好的相关性。
2.4 HAdv5 结合抗体检测方法的应用
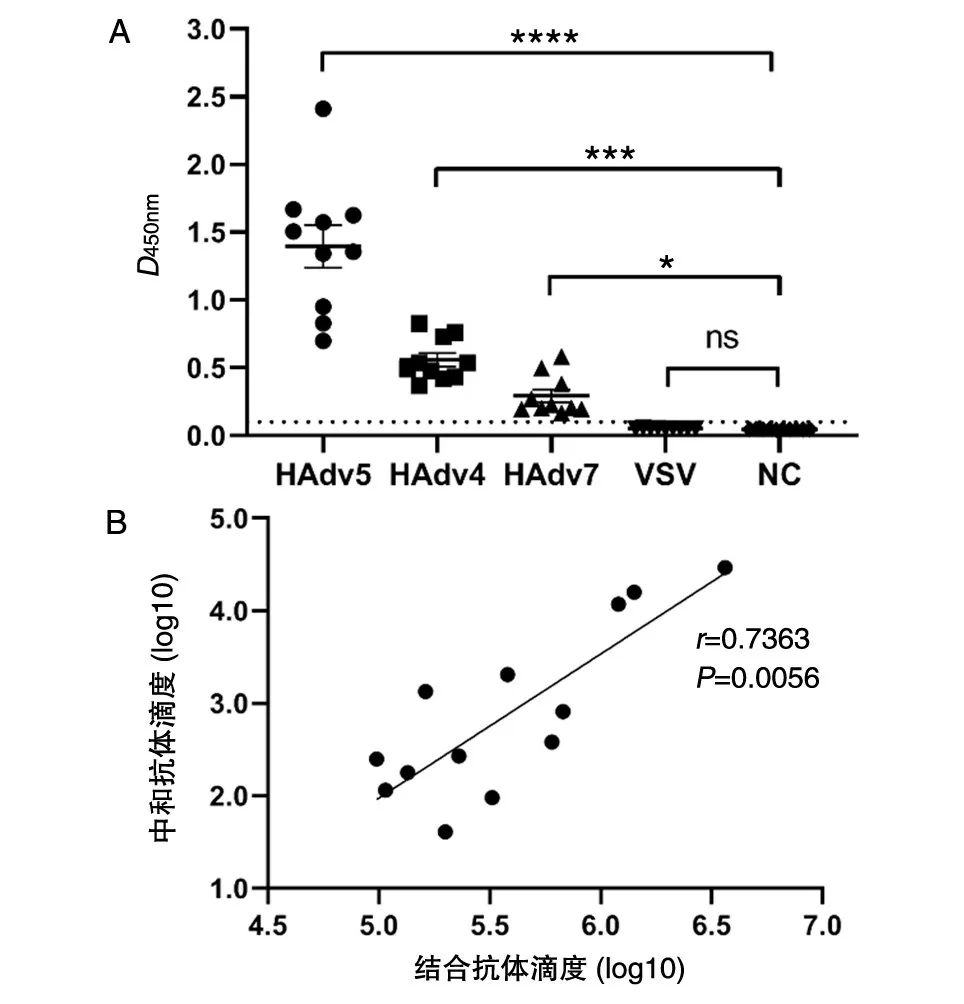
图3 HAdv5 结合抗体检测方法验证
将本检测方法应用于Ad5-EBOV 免疫小鼠血清的HAdv5 IgG 抗体水平检测。Ad5-EBOV 分别以106或107IFU 的免疫剂量肌肉注射免疫BALB/c 小鼠(n=6),16 周后进行等剂量加强免疫。不同时间点小鼠血清HAdv5 IgG 抗体水平如图4。免疫前所有小鼠血清呈HAdv5 IgG 抗体阴性。初次免疫后107IFU 剂量组血清HAdv5 IgG 抗体水平呈逐渐升高的趋势,至免疫后10 周达到高峰;106IFU 剂量组血清HAdv5 IgG 抗体水平很低,平均抗体滴度在100 左右。加强免疫后高低剂量组小鼠血清HAdv5 IgG 抗体水平均迅速升高,于加强免疫后2~4 周达到峰值。同时也可以看到,小鼠血清HAdv5 IgG 抗体水平呈现明显的剂量依赖关系。
3 讨论
特异性抗体检测在临床诊断、预防接种效果观察以及传染病流行病调查中具有重要意义。腺病毒有多种不同血清型,亚型之间病毒表面抗原同源性较高,结合抗体检测在型别之间的交叉反应性较强,一般情况下采用中和抗体方法检测针对某亚型腺病毒的血清抗体水平。通常小动物模型上的疫苗免疫学评价所涉及的实验动物均为SPF 级,腺病毒感染阴性。因此,在SPF 级动物模型上的腺病毒抗体检测不涉及自然感染腺病毒而导致的交叉反应的问题,可以使用结合抗体检测方法来检测某亚型腺病毒的抗体水平,达到快速、高效的要求。在本研究中,我们表达纯化获得了纯度大于95%的HAdv5-Hexon 蛋白,并以此为包被抗原建立了操作简单、快捷、灵敏度高、稳定性好的HAdv5 结合抗体检测ELISA 法。
虽然中和抗体检测是腺病毒抗体检测的金标准,但也存在着一些不方便的操作因素。中和抗体检测需要进行细胞培养,检测时间长,操作复杂,检测成本高,对试验环境要求高。相比之下,ELISA 检测结合抗体的检测时间短,方法简单,成本较低,可在普通实验环境中开展。此外,ELISA 法具有更高的灵敏性。我们在进行结合抗体滴度和中和抗体滴度相关性分析时,所检测的13 份小鼠血清样品中,其结合抗体滴度的几何平均值约为中和抗体滴度几何平均值的500 倍(结果未示)。这一结果说明结合抗体检测的灵敏度更高,一些中和抗体检测结果为阴性的样品很有可能具有较高的结合抗体水平。
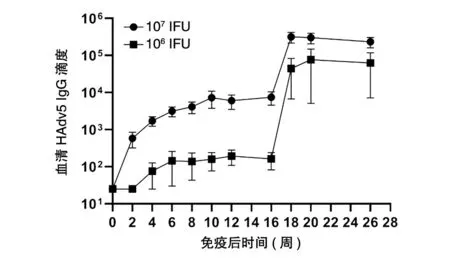
图4 Ad5-EBOV 免疫后不同时间小鼠血清HAdv5 IgG 抗体水平
关于腺病毒结合抗体检测,罗思思等利用大肠杆菌表达4 型禽腺病毒Hexon 蛋白,并以此建立了检测4 型禽腺病毒抗体的ELISA 方法[15],但HAdv5 结合抗体检测的相关方法还未见报道。我们表达纯化获得了高纯度的HAdv5-Hexon,建立了适用于SPF 级动物血清样品的HAdv5 抗体检测ELISA 法。该方法检测成本较低、操作简单、快捷、灵敏度高、稳定性好,可用于以HAdv5 为载体的病原体疫苗小动物模型免疫学评价,同时也可为其他型别腺病毒结合抗体检测方法的建立提供思路。
