布鲁菌外膜蛋白Omp19突变体的构建及免疫原性研究
2019-12-25郭凤羽殷瑛宰晓东李汭桦王美荣李耀辉胡凯李玉杰徐俊杰陈薇
郭凤羽,殷瑛,宰晓东,李汭桦,王美荣,李耀辉,胡凯,李玉杰,徐俊杰,陈薇
军事科学院军事医学研究院生物工程研究所,北京100071
布鲁菌(Brucella)是一种胞内寄生的革兰阴性细菌,是布鲁菌病的病原体。布鲁菌病是一种人畜共患的慢性传染病[1],世界卫生组织(WHO)将该病归为7 种被忽视的人畜共患病之一,是一种导致贫困持续存在的疾病[2]。人类主要通过食用被布鲁菌污染的肉类及制品,或者接触到被布鲁菌感染的动物组织等方式罹患布鲁菌病[3]。人布鲁菌病的症状主要包括波浪热、盗汗和体虚等,此外还常伴有全身乏力、头痛、关节痛、阳痿等,孕妇感染布鲁菌后容易引发自然流产[4]。由布鲁菌病所引起的这些慢性感染往往难以根治,给患者的生理及心理健康带来较大危害。布鲁菌主要分布于发展中国家,全世界有170 多个国家和地区存在人、畜布鲁菌病的流行,布鲁菌病患者约600 万人,每年新发病例约50 万人次[5-6]。布鲁菌病在我国主要集中在北方农牧业地区,现已扩展至全国31 个省市地区[7]。目前对布鲁菌病的防治主要依靠疫苗,减毒活疫苗104M 是目前我国惟一获批的人用布鲁菌病疫苗,其安全性和有效性得到一定验证,但仍存在接种方式复杂、免疫机制不明确、残余毒力等问题[8]。因此,新型人用布鲁菌疫苗的研制对于布鲁菌病的预防和控制具有重要意义。
外膜蛋白19(outer membrane protein 19,Omp19)是存在于布鲁菌表面的一种蛋白,在种型复杂的布鲁菌中的同源性达90%以上[9]。Omp19蛋白全长有177 个氨基酸残基,前端含有的信号肽使蛋白在胞内合成后被跨膜转运,信号肽切割后蛋白被锚定于细菌外膜[10]。Omp19 对布鲁菌黏附、侵袭、定殖及胞内存活等多个生理功能起关键作用[11]。此外,Omp19 还被报道能够诱导Th1型免疫应答,是对抗布鲁菌感染的重要靶标[12],也被认为有希望成为抗布鲁菌病亚单位疫苗的重要候选组分[13]。Fiorentino 等通过敲除布鲁菌疫苗株S19 的Omp19 基因发现Omp19 的缺失会使该疫苗失去保护能力[14]。另一项研究表明,给BALB/c小鼠口服重组表达的Omp19 蛋白,可以保护免疫小鼠对抗布鲁菌的攻击[15]。
本研究中,我们以前期构建的含有Omp19 核酸序列的质粒,对序列中编码Cys 的碱基进行缺失或替换突变,构建一系列蛋白突变体,从中筛选到不形成2 条带及多聚体的蛋白,比较突变体蛋白与Omp19 在理化性质及免疫保护性上的异同,为以Omp19 为组分的布鲁菌重组蛋白疫苗的研究提供依据。
1 材料与方法
1.1 材料
6~8 周雌性BALB/c 小鼠购自北京维通利华实验动物技术有限公司;大肠杆菌感受态DH5α、BL21(DE3)购自天根生化有限公司;布鲁菌株104M、A19,质粒pET-32a 为实验室保存;2×EasyTaqPCR supermix 购自北京全式金生物技术有限公司;限制性内切酶XhoⅠ、NdeⅠ,T4DNA 连接酶及T4多聚核苷酸激酶购自NEB 公司;核酸凝胶回收试剂盒及小量质粒提取试剂盒购自天根生化有限公司;HRP 标记的羊抗鼠IgG、IgG1、IgG2a购自Abcam 公司;SPXL 阳离子纯化柱购自通用电气公司;TMB 单组分显色液及终止液、云克隆细胞因子检测试剂盒购自北京蒂诺奥科技有限公司;引物由生工生物工程有限公司合成。
1.2 突变体质粒的构建
以前期构建的含有Omp19 核酸序列的质粒pET32a-Omp19 为模板,用引物M1u/M1d 扩增编码Omp19 第1 位Cys 缺失突变体M1 的DNA 序列(94℃ 5 min;94℃ 30 s、60℃ 1 min、72℃ 1 min,30 个循环;72℃10 min)。用NdeⅠ和XhoⅠ酶切位点和T4DNA 连接酶将Omp19-M1 连接到pET32a 中,得到质粒pET32a-Omp19-M1。以测序正确的pET32a-Omp19-M1 为模板,分别用突变引物M2u/M2d、M3u/M3d、M4u/M4d 扩增Omp19-M1的86 位和106 位Cys 单点突变体和双点突变体基因序列。以pET32a-Omp19 为模板,用突变引物M5u/M5d 扩增Omp19 的86 位和106 位双点突变体(94℃5 min;94℃30 s、60℃30 s、72℃6 min,25 个循环;72℃ 7 min)。引物见表1,所有突变体结构示意图见图1。用T4多聚核苷酸激酶和T4DNA 连接酶将质粒进行磷酸化和连接,得到质粒pET32a-Omp19-M2~M5。
1.3 突变体蛋白的表达、鉴定和纯化
将序列正确的突变体质粒转化大肠杆菌BL21(DE)感受态,挑取工程菌单克隆接种到5 mL LB 培养基(含100 μg/mL 氨苄青霉素)中,37℃、220 r/min 过夜振荡培养。次日以1∶100 的比例将培养物转接至5 mL LB 液体培养基,37℃、220 r/min 振摇至菌液D600nm为0.6~0.8 时,加入终浓度为1 mmol/L 的IPTG 于28℃诱导表达5 h。离心收集菌体,进行SDS-PAGE 分析。
将过夜培养的重组菌以1∶100 的接种量接种至1 L LB 培养基(含100 μg/mL 氨苄青霉素),37℃振荡培养至菌液D600nm为0.6~0.8,加入终浓度为1 mmol/L 的IPTG 于28℃诱导培养5 h,8000 r/min 离心5 min 收集菌体,菌体沉淀用40 mL 缓冲液(20 mmol/L NaAc,pH4.0)重悬,冰上超声20 min,4℃、12 000 r/min 离心10 min,上清用0.45μm 滤器过滤作为纯化样品。用SPXL 阳离子柱,以梯度洗脱(洗脱液为20 mmol/L NaAc,1 mol/L NaCl,pH4.0)的方式纯化目的蛋白。用15%的SDS-PAGE 鉴定蛋白,Lowrry 法检测蛋白浓度。

图1 突变体结构示意图

表1 Omp19 突变体构建引物
1.4 突变体蛋白的理化性质分析
将纯化得到的Omp19、M1、M4 委托北京百泰派克生物科技有限公司用液相色谱串联质谱开展相对分子质量、N 端序列、二硫键的检测。委托中国科学院过程工程研究所采用圆二色(circular dichroism,CD)光谱开展蛋白二级结构的检测分析。
1.5 突变体蛋白的免疫评价
40 只6~8 周龄的BALB/c 雌性小鼠随机分成5组,分别经皮下注射免疫Omp19、M1、M4 蛋白及104M 菌株,免疫佐剂为Al(OH)3。免疫104M 组为阳性对照组,PBS 组为阴性对照组(表2),除104M 免疫组只于0 d 免疫外,其余各组于0、14、28 d 免疫。
1.5.1 血清抗体滴度检测 免疫35 d 时采血,分离血清,ELISA 法检测抗Omp19 特异性抗体。Omp19 用包被缓冲液稀释至2 μg/mL,按100 μL/孔加入96 孔酶标板,4℃过夜包被;次日用PBST(PBS,2%吐温,pH7.2)洗板4 次,加入封闭液(PBS,2% BSA),37℃封闭1 h;洗板,待测小鼠血清梯度稀释,37℃孵育1 h;洗板,按1∶10 000 的比例加入HRP 标记的羊抗鼠抗体IgG(检测总抗体水平)或IgG1、IgG2a(检测抗体亚类水平),37℃孵育45 min;洗板,加入TMB 单组分显色液避光显色6 min,加入终止液终止显色。用Bio-Rad 酶标仪检测D450nm和D630nm值,以D=D450nm-D630nm作为最终吸光度值,大于2.1 倍D(阴性)的最大稀释度为该样品的抗体滴度。
二是加强“职业化”建设,在技能培训上强力度。近年来,马鞍山市人社局充分发挥下岗再就业培训基地的职能,联合马鞍山市妇联开办家政服务员职业资格认证培训和专题讲座,共开办培训班16期,培训人员3871人次,2465人获初、中级职业资格证书。马鞍山市工人文化宫职教中心围绕“家政服务工程”举办培训班6期,300多名农民工、失业人员参加培训。
1.5.2 细胞因子检测 免疫后42 d,断颈法随机处死3 只小鼠,将无菌取出的脾脏置于筛网上,于RPMI1640 培养基中研磨;将研磨液转移至15 mL离心管中,室温500 r/min 离心5 min,弃上清;向沉淀中加入3 mL 红细胞裂解液(ACK),室温裂解5 min,再加入RPMI1640 培养基至终体积为10 mL,室温500 r/min 离心5 min,弃上清;加入2 mL RPMI1640 培养基重悬细胞沉淀,得到脾脏单细胞悬液(1×106/mL)。在96 孔细胞培养板的各孔中加入100 μL 各组细胞悬液,再加入Omp19(5 μg/孔)用于刺激培养细胞,分别设置ConA(0.5 μg/孔)和RPMI1640 培养基作为阳性对照和阴性对照,37℃、5% CO2培养箱中孵育72 h 后离心收集细胞上清,用细胞因子检测试剂盒检测IFN-γ、TNF-α、IL-2、IL-6、IL-17A 的分泌水平。
表2 蛋白免疫评价方式
1.6 攻毒评价
免疫后第35 d,各组随机选取5 只小鼠,腹腔注射布鲁菌株A19(1×106CFU/只)进行攻毒评价,104M 疫苗株免疫组(1×105CFU/只)作为阳性对照,PBS 免疫组作为阴性对照。14 d 后将小鼠处死,无菌条件下摘取小鼠脾脏,将脏器在PBS 溶液中研磨制成匀浆,取组织匀浆100 μL 做适度浓度梯度稀释后涂布无抗性的TSA 平板,37℃孵箱培养3 d 后进行脏器菌载量计数。结果以菌载量对数的平均值的形式(mean LgCFU)表示,同时将免疫组小鼠脾脏中布鲁菌菌载量相对于对照组小鼠菌载量下降的数值定义为保护指数,即对照组与实验组的平均LgCFU 的差值。
1.7 统计学方法
显著性分析采用单因素方差分析或t检验,以P<0.05 为有统计学差异。数据统计分析及制图均由GraphPad Prism 7.0 完成。
2 结果
2.1 突变体表达载体的构建
以pET32a-Omp19 质粒为模板扩增M1 的基因片段,通过2 条携带缺失突变的引物,分别将编码Omp19 第1 位Cys 的碱基缺失,得到长度为468 bp 的M1 的序列片段,与理论值相符(图2A)。同理,分别以pET32a-Omp19 和pET32a-M1质粒为模板,利用反向PCR 分别扩增得到大小约6000 bp,含有86、106 位单位点及双位点突变的pET32a-M2~M5 质粒的线性片段(图2B)。经测序鉴定,得到的核酸序列与预期一致。
2.2 突变体蛋白的表达与纯化
对序列正确的突变体质粒进行诱导表达,阳离子柱SPXL 纯化蛋白,用SDS-PAGE 对Omp19、突变体蛋白M1~M5 进行还原及非还原电泳(图3)。突变体M1 相对理论分子质量为15 810,M2和M3 为15 780,M4 为15 820,M5 为15 870,电泳结果显示条带大小约为23 000,与预期稍有差异。此外,电泳结果显示,Omp19 在非还原电泳条件下存在多聚体和多余条带,第2 位Cys 的缺失(M1)消除了多余条带的影响,第86 和106 位Cys 的替换(M4)不仅去除了多余条带还能去除多聚体。

图2 突变体片段扩增及质粒构建
2.3 突变体蛋白理化性质分析
为了研究Cys 的缺失或替换对Omp19 原有理化性质和免疫原性的影响,利用液相色谱串联质谱分别比较了Omp19、M1 及M4 在相对分子质量、N 端序列组成及二硫键组成上的异同。利用圆二色光谱分别比较了3 种蛋白二级结构的异同。
2.3.1 相对分子质量测定 采用液相色谱串联质谱(LC-MS/MS)检测Omp19、M1、M4 蛋白的相对分子质量(图4)。测得Omp19 的相对分子质量为31 550(理论值15 909),约为理论值的2 倍;M1的相对分子质量为15 804(理论值15 805),M4的相对分子质量为15 757(理论值15 757),均与其理论值相差不大。
2.3.2 N 端序列测定 蛋白质的N 端与蛋白质的功能和稳定性息息相关。本研究检测了M1 及M4蛋白的N 端6 个氨基酸残基,M1 N 端序列为NH2-Met-Gln-Ser-Ser-Arg-Leu,M4 N 端序列为NH2-Met-Gln-Ser-Ser-Arg-Leu,与预期序列一致。

图3 突变体蛋白表达及纯化

图4 质谱分析测定Omp19、M1 及M4 的相对分子质量
2.3.3 二硫键分析 采用蛋白酶解及LC-MS/MS方法检测Omp19、M1、M4 蛋白分子中二硫键的数量及位置,在Omp19 第1、86、106 位均检测到二硫键存在;M1 第86 及106 位检测到二硫键,M4 未检测到二硫键的存在,与预期结果一致。
2.3.4 二级结构分析 远紫外圆二色光谱可以提供蛋白质的二级结构信息。Omp19、M1 及M4 的远紫外圆二色光谱如图5,3 种蛋白的光谱图几乎完全重合。通过仪器自带软件,拟合了3 种蛋白中4 种二级结构的含量,如表3 所示。可以看到,3 种蛋白的α螺旋、β折叠和自由卷曲3 种二级结构的含量基本一致,只在β转角有稍许差异,这个结果提示2 种突变体蛋白各二级结构的含量与Omp19 稍有不同但差别不大。
2.4 突变体蛋白的免疫评价
2.4.1 抗体水平 小鼠免疫后第35 d 取血,ELISA检测针对Omp19 的特异性总抗体水平及抗体亚类水平(图6)。结果显示Omp19、M1、M4 免疫组激发的针对Omp19 的特异性IgG 抗体滴度分别为3.53×104、2.19×104、2.76×104,3 组间无显著性差异。此外,如图6B 所示,Omp19、M1、M4 免疫组激发的抗体亚类IgG1/IgG2a 的比值分别为1.48、1.45、1.40,IgG1/IgG2a 比值均大于1,3 组间无显著性差异。

图5 Omp19、M1 及M4 的远紫外圆二色谱

表3 Omp19、M1 及M4 的二级结构分析
2.4.2 细胞因子水平 小鼠初次免疫后42 d,用ELISA 检测试剂盒测定Omp19 体外刺激后各组小鼠脾细胞培养上清中细胞因子的含量(图7)。结果表明,Omp19 抗原刺激后,Omp19、M1 及M4 免疫组小鼠脾细胞培养上清中检测到的IFN-γ、IL-2、IL-6 分泌水平没有显著性差异,但M4 免疫组小鼠脾细胞培养上清中检测到的TNF-α和IL-17A 水平显著低于Omp19 和M1 组。
2.5 免疫保护效果
为了评价3 种蛋白的保护效果,小鼠初次免疫后第35 d,用布鲁菌A19(1×106CFU/只)对免疫小鼠进行腹腔攻击,利用保护指数评价Omp19、M1 及M4 的保护效力。结果显示,Omp19及突变体免疫组小鼠攻毒后小鼠脾脏中的菌载量相对于PBS 组均显著降低(P<0.05),3 组之间没有显著差异,保护指数分别为1.42、1.39、1.38,均高于PBS 组。同时也观察到3 组的保护指数与104M 疫苗株存在一定差距,结果见表4。
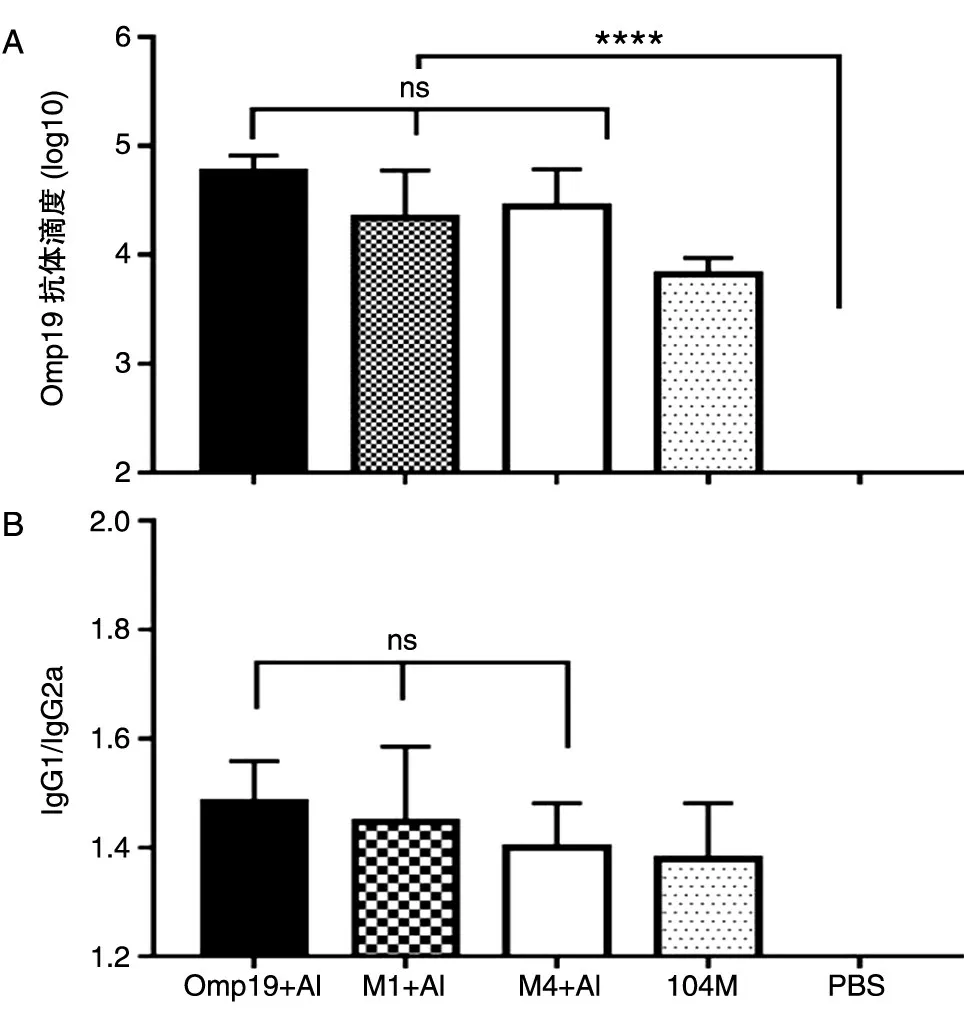
图6 Omp19 抗原特异的抗体水平
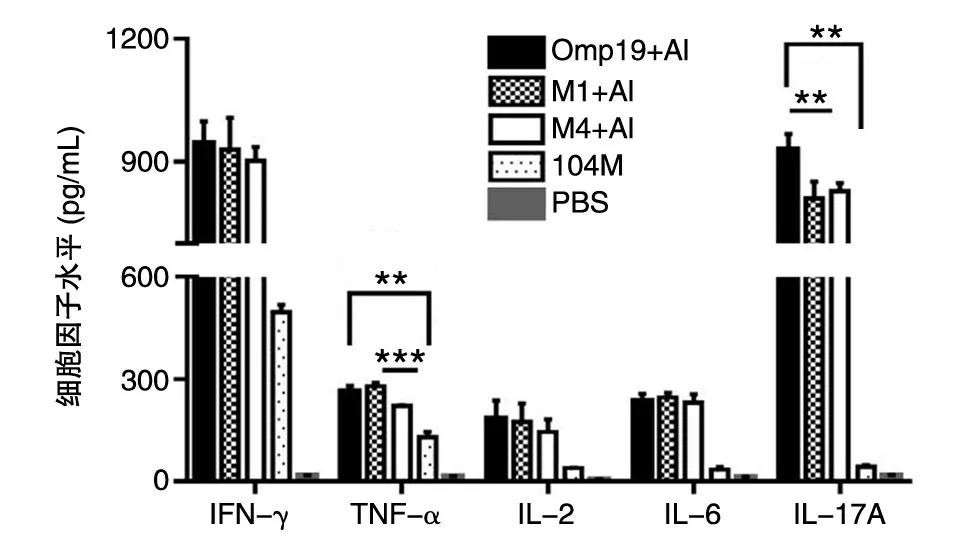
图7 Omp19 特异的细胞因子水平

表4 小鼠攻毒实验保护性效果统计表
3 讨论
我国的布鲁菌病疫情自1993 年出现反弹,随后发病率迅速增长[16]。最新的全国法定传染病疫情概况数据显示,2018 年我国上报布鲁菌病新发病例达到3.8 万人次,发病率为2.73/10 万,仍然处于较高位置[17]。疫苗是预防和控制布鲁菌病的主要手段。目前,兽用布鲁菌病疫苗已获得广泛使用,在控制布鲁菌病疫情方面发挥着重要作用。人用布鲁菌病疫苗研制较为困难,目前国外尚无疫苗上市,我国惟一获批的人用布鲁菌病疫苗为104M 株。104M 是一种皮上划痕接种的减毒活疫苗,存在免疫机制不明确、有残余毒力等问题[8]。随着生物技术的不断发展,以重组蛋白疫苗与核酸疫苗为主的新型疫苗近年来成为布鲁菌病疫苗研究的热点[18],国内外也对包括Omp19 在内的多个布鲁菌抗原进行了初步研究,其中Omp19 被认为对布鲁菌具有一定的保护作用[9],但是相关的研究都不系统。
实验室前期发现在制备Omp19 蛋白时,目的蛋白附近存在另一条与之大小类似,且能与多抗结合的条带,同时该蛋白还易形成多聚体。经过对Omp19 蛋白氨基酸序列的分析,发现Omp19 蛋白序列分别在第1、86、106 位含有Cys,推测这可能是造成上述现象出现的原因。为了探究Cys 在序列中的作用,我们构建了一系列蛋白突变体并比较了相应的理化性质和免疫原性。SDS-PAGE鉴定结果显示Omp19 及突变体蛋白的相对分子质量为25 000,与理论值稍有差异;得到的突变体蛋白M1 去除了目的蛋白附近多余条带并减少了多聚体或二聚体的形成,而突变体M4 不仅可以去除多余条带,还能同时去除多聚体或二聚体。质谱检测结果显示Omp19 的相对分子质量为31 550,约为理论值的2 倍;突变体M1、M4 的相对分子质量分别为15 804、15 757,与理论值基本相符。提示重组表达的Omp19 蛋白主要以二聚体形式存在,缺失第1 位Cys 或同时对86 位Cys 进行Ala 替换,对106 位Cys 进行Ser 替换可以减少或避免二聚体的形成。二硫键检测结果表明,Omp19 蛋白中可以检测到更多数量的二硫键位点,而M4 蛋白中检测不到二硫键位点的存在,结合SDS-PAGE 和的相对分子质量检测结果,推测Omp19 蛋白中多聚体或二聚体的形成可能是由Cys 介导的二硫键引起。此外,圆二色谱结果显示,Cys 的缺失或替换不会对Omp19 的二级结构造成太大影响。免疫学检测结果表明,相较于Omp19,M1 和M4 中Cys 的缺失或替换不会显著影响Omp19 特异的总抗体水平和所激发的免疫反应类型,主要以Th2 型反应为主。Omp19 及突变体蛋白M1、M4 免疫组小鼠脾细胞经抗原体外刺激后分泌的Omp19 特异的IFN-γ、IL-2、IL-6 水平没有显著性差异,但M4 免疫组小鼠脾细胞培养上清中分泌的TNF-α 和IL-17A 水平显著低于Omp19 和M1 组。这个结果提示86 和106 位Cys的替换会影响Omp19 特异的部分细胞因子的产生。攻毒实验结果表明,Omp19 及其突变体对布鲁菌A19 株的攻击均具有一定的保护效果,突变体蛋白激发的免疫保护效力与Omp19 没有显著性差异。
综上所述,Cys 会影响Omp19 重组蛋白的制备和质控,其缺失或替换对Omp19 原有的理化性质和免疫原性影响不大。本工作为Omp19 作为布鲁菌亚单位疫苗有效组分的研究提供了依据。
