白细胞介素-17对脱氧皮质酮/盐诱导的高血压心肌纤维化大鼠巨噬细胞极化的影响*
2019-12-21周俊岭范彬马礼坤
周俊岭,范彬,马礼坤
(1.中国科学技术大学附属第一医院 心血管内科,安徽 合肥 230031;2.安徽医科大学第四附属医院 心血管内科,安徽 合肥 230041)
心肌纤维化(myocardial fibrosis,MF)是心肌组织中类成纤维细胞过度增殖,大量合成细胞外基质的病理过程[1-2]。既往在脱氧皮质酮(Deoxycorticosterone,DOC)/盐诱导的大鼠MF 中观察到显著的炎症反应[2-3]。巨噬细胞是炎症反应的主要载体,有研究显示MF 心肌组织中巨噬细胞浸润明显,但其如何聚集激活和极化较少报道[3-4]。当前探讨白细胞介素-17(Interleukin-17,IL-17)对免疫炎症反应的调控作用已成为研究的热点之一[5]。有研究表明IL-17 在MF中发挥重要作用,但是否对巨噬细胞有调控作用鲜有报道[6-7]。本研究通过复制DOC/盐诱导的高血压MF大鼠模型,观察IL-17 对巨噬细胞极化状态和心肌组织炎症反应的影响,探讨IL-17 对巨噬细胞的极化作用。
1 材料与方法
1.1 动物
30 只雄性SD 大鼠(体重180 ~240 g)由安徽医科大学动物实验中心提供,清洁级环境饲养。
1.2 主要试剂和仪器
DOC 购自美国Sigma 公司,注射用大豆油购自浙江田雨山大豆油开发有限公司,免疫组织化学SP 试剂盒、DAB 显色剂及免疫印迹BCA 定量试剂盒购自北京中杉金桥生物技术有限公司,CD206、CD11c、诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)、精氨酸酶1(Arginase 1,Arg1)及内参照(β-actin)一抗购自美国Millipore 公司,iNOS、Arg1 引物由上海生工生物工程有限公司合成(见表1)[8],mRNA 提取试剂盒购自德国Qiagen 公司,逆转录试剂盒及染料法逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒购自日本TaKaRa 公司,ABI Step One Plus System RT-PCR 仪由安徽医科大学基础医学院寄生虫学教研室提供。

表1 iNOS 和Arg1 的引物序列
1.3 高血压MF 大鼠的模型复制
采用10%水合氯醛(400 mg/kg)对大鼠进行腹腔麻醉后实施右肾切除术,术后用含0.1%氯化钾和1%氯化钠的饮水灌胃2 周,随机分成对照组、DOC组及DOC+IL-17 抗体组,每组10 只。对照组:大豆油皮下注射,1 次/4 d,生理盐水腹腔注射,1 次/周;DOC 组:皮下注射DOC 60 mg/kg,1 次/4 d,生理盐水腹腔注射,1 次/周;DOC+IL-17 抗体组:皮下注射DOC 60 mg/kg,1 次/4 d,同时给予IL-17 特异性抗体(150μg/鼠)腹腔注射,1 次/周。对照组和DOC 组腹腔注射盐水与IL-17 特异性抗体体积相同;各组皮下注射大豆油体积一致。动物模型复制周期为14 d。实验开始前和实验第14 天分别采用尾套法测量各组大鼠收缩压。动物模型复制周期结束后,予10%水合氯醛400 mg/kg 腹腔麻醉后处死各组大鼠,摘取心脏,切下心室。将心室分成3 份,1 份放入4%多聚甲醛溶液中固定,石蜡包埋切片后做HE 染色、苦味酸-天狼猩红胶原染色和免疫组织化学染色。另2 份(心尖部)放入-80℃冰箱冻存,备用于RT-PCR和Westren blotting。
1.4 MF 检测
按照苦味酸-天狼猩红胶原染色法流程对石蜡切片逐步染色,烤片、封片后使用尼康显微镜照相系统拍照,各组随机选取图像。以心肌间质胶原面积/视野总面积比值表示心肌间质纤维化程度,采用Image Pro Plus 6.0 图像分析软件测量。
1.5 心肌组织炎症病理改变
取出部分左心室心肌组织后,直接浸于4%多聚甲醛中固定24 h 充分水洗,脱水,石蜡包埋后将大鼠左室心肌组织切成4μm 厚的薄片,置于防脱载玻片上烤片备用。石蜡切片进行HE 染色,观察心肌组织炎症反应情况。
1.6 免疫组织化学法检测M1 型、M2 型巨噬细胞的表达
石蜡切片采用柠檬酸盐修复液95℃修复10 min,3%双氧化氢37℃封闭8 min,10%山羊血清37℃封闭30 min,分别滴加CD11c(1 ∶400)、CD206(1 ∶400)一抗4℃孵育过夜,先后滴加生物素化二抗工作液和辣根标记链酶卵白素工作液37℃孵育25 min,然后二氨基联苯胺显色。各步骤间用磷酸盐缓冲液充分洗涤5 次,4 min/次,苏木精复染6 min,脱水、透明并封片。磷酸盐缓冲液代替一抗作为阴性对照。使用尼康显微镜照相系统随机选取阳性表达区内10 个视野,在200倍视野下拍摄图像。利用Image Pro Plus 6.0 图像分析软件计算CD11c、CD206 的积分光密度值(integral optical density,IOD),每张切片取平均值。
1.7 RT-PCR 检测iNOS 和Arg1 mRNA 的表达
取适量的左心室心肌组织研磨成匀浆液,按照Qiagen RNA 提取试剂盒说明书步骤提取总RNA,紫外分光光度计检测所提取总RNA 的纯度及浓度。取5μl RNA,逆转录合成cDNA。根据RT-PCR 试剂盒和RT-PCR 仪推荐的反应体系进行实时定量扩增。反应体系为20μl,反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,共40 个循环。采用RT-PCR仪对各个样品得到的反应结果进行分析并得出Ct 值,采用2-ΔΔCt法对iNOS 和Arg1 mRNA 表达水平进行相对定量。
1.8 Western blotting 检测IL-17、iNOS 和Arg1蛋白的表达
用RIPA 组织裂解液提取左心室心肌组织总蛋白,BCA 法测定总蛋白浓度,加入蛋白上样缓冲液,加热变性后电泳,印迹转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜,漂洗、封闭后,将PVDF 膜放入一抗稀释液中4℃缓慢摇晃孵育过夜。将PVDF 膜放入相应的二抗稀释液中,室温反应2 h,采用辣根过氧化物酶HRP-ECL 底物发光试剂对蛋白进行显色,每步骤间充分漂洗,在暗室中曝光后完全定影,通过凝胶成像系统扫描分析定影后的条带光密度(optical density,OD)。利用Image Pro Plus 6.0 图像分析系统计算每个蛋白条带OD 值。同样的方法检测内参照β-actin 蛋白,样本目的蛋白相对含量=目的蛋白条带OD 值/β-actin 条带OD 值。
1.9 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析或重复测量设计的方差分析,进一步的两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠收缩压比较
SD 大鼠右肾切除术后,对照组、DOC 组及DOC+IL-17 组第0 天的收缩压分别为(134±12)、(139±11)和(130±11)mmHg,第14 天 分 别 为(132±5)、(164±5)和(160±10)mmHg,采用重复测量设计的方差分析,结果:①不同时间点的收缩压比较,差异有统计学意义(F=59.063,P=0.000);②各组收缩压比较,差异有统计学意义(F=17.566,P=0.000),DOC 组与DOC+IL-17 组收缩压比较,差异无统计学意义(P>0.05);③各组收缩压的变化趋势比较,差异有统计学意义(F=18.323,P=0.000)。
2.2 各组大鼠MF 程度
大鼠心肌间质胶原纤维呈红色,其余心肌组织呈黄色。苦味酸-天狼猩红胶原染色法结果显示:对照组心肌间质胶原面积/视野总面积比值为(3.136±1.389)%、DOC 组 为(32.139±25.300)%、DOC+IL-17 抗体组为(4.540±1.150)%,经方差分析,差异有统计学意义(F=247.647,P=0.000)。进一步两两比较,经LSD-t检验,DOC 组较对照组增加(P<0.05);使用IL-17 抗体中和干预治疗后,DOC+IL-17 抗体组心肌间质胶原面积/视野总面积比值较DOC 组减少(P<0.05)。见图1、2。
2.3 各组大鼠心肌组织炎症反应

图1 各组大鼠MF 程度

图2 各组大鼠MF 程度比较 (n=10,±s)
对照组大鼠左心室心肌细胞排列有序,而DOC组心肌细胞排列紊乱,大量炎症细胞浸润并伴有纤维化瘢痕组织形成;经IL-17 抗体中和干预后,DOC+IL-17 抗体组心肌细胞排列基本有序,有少量炎症细胞浸润。见图3。
2.4 各组大鼠巨噬细胞浸润情况
以CD11c 阳性表达细胞代表M1 型巨噬细胞浸润情况,以CD206 阳性表达细胞代表M2 型巨噬细胞浸润情况,结果:①各组CD11c 的IOD 值比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验,DOC 组CD11c 的IOD 值较对照组增加(P<0.05);使用IL-17 抗体中和干预治疗后,DOC+IL-17 抗体组CD11c 的IOD 值较DOC 组减少(P<0.05)。②各组CD206 的IOD 值比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验,DOC 组CD206 的IOD 值较对照组增加(P<0.05);使用IL-17 抗体中和干预治疗后,DOC+IL-17 抗体组CD206 的IOD 值较DOC 组减少(P<0.05)。见图4~6 和表2。

图3 各组大鼠心肌组织病理切片 (HE 染色×200)

图4 各组大鼠心肌组织CD11c 阳性表达 (免疫组织化学×200)

图5 各组大鼠心肌细胞CD206 阳性表达 (免疫组织化学×200)

图6 各组大鼠CD11c、CD206 IOD 值比较 (n=10,±s)
表2 各组大鼠CD11c、CD206 的IOD 值比较 (n=10,±s)

表2 各组大鼠CD11c、CD206 的IOD 值比较 (n=10,±s)
组别 CD11c CD206对照组 2 812.173±459.245 1 059.458±305.194 DOC 组 13 876.401±2 046.109 6 586.125±647.570 DOC+IL-17 组 5 963.516±847.240 2 754.287±421.503 F 值 194.514 345.888 P 值 0.000 0.000
2.5 各组大鼠iNOS 和Arg1 mRNA 相对表达量比较
M1 型巨噬细胞分泌iNOS,M2 型巨噬细胞主要分泌Arg1。各组iNOS 和Arg1 mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步的两两比较经LSD-t检验,DOC 组iNOS 和Arg1 mRNA 相对表达量较对照组升高(P<0.05);使用IL-17 抗体中和干预治疗后,DOC+IL-17 抗体组iNOS和Arg1 mRNA 相对表达量较DOC 组降低(P<0.05)。见图7和表3。
2.6 各组大鼠IL-17、iNOS 和Arg1 蛋白相对表达量比较

图7 各组大鼠iNOS 和Arg1 mRNA 的相对表达量比较 (n=10,±s)
表3 各组大鼠iNOS 和Arg1 mRNA 相对表达量比较 (n=10,±s)

表3 各组大鼠iNOS 和Arg1 mRNA 相对表达量比较 (n=10,±s)
组别 iNOS Arg1对照组 1.003±0.051 1.002±0.036 DOC 组 2.302±0.118 1.371±0.041 DOC+IL-17 组 1.351±0.092 1.123±0.062 F 值 556.148 157.140 P 值 0.000 0.000
各组IL-17、iNOS 和Arg1 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)进一步的两两比较经LSD-t检验,DOC 组IL-17、iNOS 和Arg1 蛋白相对表达量较对照组升高(P<0.05);使用IL-17 抗体中和干预治疗后,DOC+IL-17 抗体组iNOS和Arg1 蛋白相对表达量较DOC 组降低(P<0.05)。见表4和图8。
表4 各组大鼠IL-17、iNOS 和Arg1 蛋白相对表达量比较 (n=10,±s)
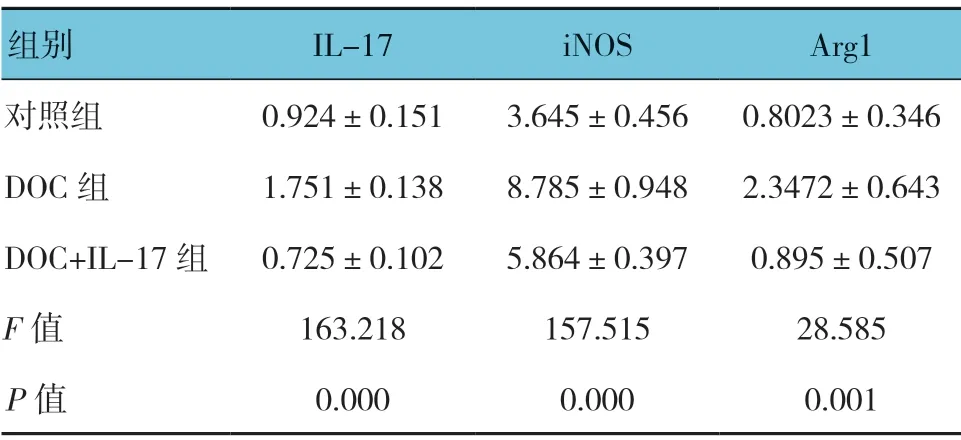
表4 各组大鼠IL-17、iNOS 和Arg1 蛋白相对表达量比较 (n=10,±s)
组别 IL-17 iNOS Arg1对照组 0.924±0.151 3.645±0.456 0.8023±0.346 DOC 组 1.751±0.138 8.785±0.948 2.3472±0.643 DOC+IL-17 组 0.725±0.102 5.864±0.397 0.895±0.507 F 值 163.218 157.515 28.585 P 值 0.000 0.000 0.001

图8 各组大鼠IL-17、iNOS 和Arg1 蛋白相对表达量比较 (n=10)
3 讨论
IL-17 是由Th17 细胞分泌的一种炎症介质,其通过调节促炎细胞因子、趋化因子等表达,促进巨噬细胞等炎症细胞浸润,从而诱导组织炎症反应的发生、放大[9]。MF 过程中存在低度炎症反应,炎症反应通过炎症细胞的聚集、激活,导致心脏成纤维细胞异常增殖,被认为是心室重构的起始因子[10-11]。巨噬细胞是心脏主要炎症细胞,在启动炎症反应中发挥重要作用。健康心脏组织中,巨噬细胞占总细胞数的1%~5%,但心肌损伤后,其数量显著增加[12-13]。巨噬细胞具有高度可塑性和分化潜能,在不同组织微环境中,可以发生表型、功能的极化,呈现出不同功能,这是巨噬细胞在MF 中发挥作用的关键因素[14]。本研究通过复制DOC/盐诱导的高血压性大鼠模型,应用IL-17 抗体干预,发现IL-17 可能通过介导巨噬细胞极化,发挥促炎和促纤维化作用。
巨噬细胞的亚型受其极化状态的调控,而巨噬细胞不同的亚型在组织中的聚集和激活方式不同[15]。巨噬细胞大致分为2 类:M1 型和M2 型,分别发挥不同的作用,且其极化状态受多种因素调节,这对于疾病的治疗具有重要意义[16-17]。M1 型特征性表达CD11c,可分泌iNOS、IL-1 等促炎细胞因子,具有细胞毒性,也会导致机体的炎症损伤,发挥促炎作用。M2 型高表达CD206,主要分泌Arg1、IL-4 等,起到组织修复等作用[18]。在不同微环境下,巨噬细胞可激活极化为M1 型或M2 型,不同的表型之间可相互转换[19]。有研究显示,在心肌缺血早期,以M1 型巨噬细胞募集为主,加速心肌的凋亡,而在心肌缺血中晚期,以M2 型巨噬细胞募集为主,参与MF 的发生,这表明巨噬细胞的极化状态改变是介导巨噬细胞聚集和激活的重要机制[20]。而前期研究均笼统地将各型巨噬细胞混在一起,未充分重视巨噬细胞极化对MF 的重要作用,本研究以CD11c 和CD206 分别标记2 种巨噬细胞,显示在DOC/盐诱导的MF 大鼠中,M1 型巨噬细胞和M2 型巨噬细胞均增加,M1 型巨噬细胞增加更加明显,提示M1 型巨噬细胞在MF 炎症反应阶段发挥重要作用。
近年来新发现一类CD4+T 细胞亚群,其功能特征与之前发现的Th 细胞亚群Th1、Th2 不同,主要分泌IL-17,诱导机体局部组织炎症反应的发生、放大和级联反应[5,21]。当前探讨IL-17 阳性的细胞对免疫炎症反应的调控作用已成为研究热点之一[22-23]。有研究表明,IL-17 参与病毒性心肌炎、肝脏纤维化等多种疾病的病理过程[24]。有报道表明,IL-17 在MF 中发挥重要作用[25]。其作用机制不明确,是否对影响巨噬细胞的极化尚无报道。有研究提示IL-17 在DOC/盐诱导的MF 进程中表达水平升高,抑制IL-17 表达能减轻纤维化进程[26]。本研究亦显示MF 大鼠在IL-17表达增加的同时M1 型巨噬细胞表达同时增加,应用IL-17 抗体干预后,随着IL-17 减少,M1 型巨噬细胞表达亦减少,心肌间质胶原蛋白量同时减少,很可能说明IL-17 通过介导巨噬细胞的极化在MF 中发挥重要作用。
综上所述,在DOC/盐诱导的MF 大鼠中,IL-17和巨噬细胞表达均增加,发挥重要作用,伴随IL-17的中和,M1 型巨噬细胞数量随之减少,表明巨噬细胞极化很可能与IL-17 有关,而IL-17 具体调控巨噬细胞极化的机制有待进一步研究。
