miR-155靶向SIRT1调控缺氧/复氧心肌细胞的活力、凋亡和氧化应激
2019-12-20李世勋周凡王岩
李世勋 周凡 王岩
(新乡市中心医院心血管内科,河南 新乡 453000)
微小RNA(microRNA,miRNA,miR)是一种小的非编码RNA,长度约为20~25个核苷酸,它通过碱基互补配对方式与靶基因3'非翻译区(UTR)部分或完全互补,在转录后调控靶基因表达〔1〕。近年研究证实miRNA在肿瘤形成、生长、转移中均发挥重要作用,可作为肿瘤的标志物〔2〕。miR-155具有调节关节炎患者的炎症反应〔3〕、调控乳腺癌细胞增殖和凋亡〔4〕、调控胃癌细胞的侵袭和转移〔5〕、调控急性肺损伤炎性因子分泌〔6〕等功能。但miR-155在缺血再灌注心肌细胞损伤中的研究尚未十分清楚。Sirtuins基因家族为Ⅲ类组蛋白去乙酰化酶(SIRT),该基因家族共有7个成员分别为SIRT1~SIRT7,其在细胞内广泛存在,且具有不同的酶活性和亚细胞定位〔7〕。SIRT1为Sirtuins基因家族中的成员之一。SIRT1在基因表达调控、染色体架构维持、细胞周期进程等方面均具有重要作用,参与细胞分化、凋亡和肿瘤进展〔8〕。SIRT1具有抗氧化、抗自由基、抗衰老、调节代谢、调节免疫等多种功能,其对免疫的调节涉及固有免疫应答和适应性免疫应答过程,对炎症的抑制作用主要通过NF-κB通路实现,其之激活和抑制与多种疾病相关,有望成为免疫相关性疾病治疗的新靶点〔9〕。SIRT1可通过NF-κB信号通路调节人肝细胞的损伤〔10〕、调节过氧化物酶体增殖物激活受体(PPAR)γ/SIRT1/NF-κBp65信号通路抑制促炎因子生成起保护溃疡性结肠炎损伤作用〔11〕。李珊〔12〕在缺氧/复氧(H/R)心肌H9C2细胞的研究中证实,SIRT1可通过磷脂酰肌醇-3-激酶/丝氨酸/苏氨酸激酶(PI3K-Akt)信号通路减轻H9C2细胞H/R损伤。目前SIRT1在缺血再灌注心肌细胞损伤中的作用机制尚未完全清楚。本研究拟以H/R处理大鼠心肌H9C2细胞或大鼠原代心肌细胞为研究对象,观察敲减miR-155、敲减SIRT1表达对细胞活力、凋亡和氧化应激的影响,揭示miR-155可靶向SIRT1调控H/R大鼠心肌细胞的活力、凋亡和氧化应激,将为心肌炎的治疗奠定科学理论基础。
1 材料和方法
1.1材料 大鼠心肌H9C2细胞由本实验室保存;乳酸脱氢酶(LDH)检测试剂盒、超氧化物歧酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒、一氧化氮(NO)检测试剂盒、annexin V-FITC/PI凋亡检测试剂盒购自北京莱宝公司;BCA蛋白定量试剂盒、脂质体LipofectamineTM2000、逆转录试剂盒购于大连Takara公司;聚偏氟乙烯(PVDF)膜购于德国罗氏诊断有限公司;电化学发光(ECL)液和细胞裂解液(RIPA)均购于碧云天生物技术公司;双荧光素酶报告基因检测试剂盒购于美国Promega公司。半干转膜仪购于美国BIO-RAD公司;流式细胞仪购于美国 FALS CALIBAR BD公司;ABI 7500型实时荧光定量PCR系统购于美国ABI公司;紫外分光光度计购于美国Thermo公司;细胞培养箱购于美国Forma Scientific公司;PCR 仪购于美国BIO-RAD公司。
1.2方法
1.2.1细胞分离培养 用含10%胎牛血清的杜氏改良培养基(DMEM)培养基培养H9C2细胞,置于5% CO2的37 ℃培养箱中常规培养。
1.2.2建立H/R H9C2细胞模型 将H9C2常规培养24 h,然后换液培养。细胞融合度达到80%时,将H/R组细胞用磷酸盐缓冲液(PBS)冲洗,用不含血清的低培养液置于85% N2、10% H2、5% CO2的37℃饱和湿度厌氧培养箱中缺氧培养6 h,然后加入新鲜含血清的DMEM培养基置于5% CO2培养箱中常规培养2 h。
1.2.3细胞转染 将H9C2细胞随机分成H/R+miR-155 inhibitors组(转染miR-155 inhibitors)、H/R+miR-NC inhibitors组(转染miR-NC inhibitors)、H/R组(未转染H/R H9C2细胞)和Control组(未转染H9C2细胞)、H/R+miR-155 inhibitors+SIRT1 blocker组(miR-155 inhibitors和SIRT1 blocker共转染)、H/R+miR-155 inhibitors组(转染miR-155 inhibitors)、miR-155 inhibitors组(转染miR-155 inhibitors)、miR-NC inhibitors组(转染miR-NC inhibitors),以上各组细胞均按照LipofectamineTM2000试剂说明书进行脂质体转染,转染24 h后进行缺氧再复氧(缺氧6 h,复氧2 h),之后进行凋亡、Western印迹检测、氧化应激指标检测。
1.2.4RT-qPCR实验 RT-qPCR实验(转染后24 h检测)不经缺氧再复氧过程。Trizol法提取对数生长期的转染组细胞样本总RNA,并用进行RNA定量。按照逆转录反应试剂盒说明书操作,合成模板链cDNA。按照RT-qPCR试剂盒说明书操作步骤进行miR-124的测定。反应结束后通过分析Ct值,以2-△△Ct法计算定量结果,测定miR-124的相对表达水平。按照每个样品重复5次,取平均值,实验重复3次。
1.2.5噻唑蓝(MTT)实验 将大鼠原代心肌细胞分离后用含15%胎牛血清的DMEM培养基培养,用200目滤网除去未消化组织后,再用差速贴壁法除去成纤维细胞,纯化心肌细胞。将细胞隔天更换一次培养液,培养至第4代开始用于MTT实验。
原代心肌细胞及将方法1.2.3各组细胞均分别培养24 h、48 h和72 h时各加入20 μl 5 g/L的MTT溶液,继续培养4 h,取出后吸去上清,每孔加入150 μl 二甲基亚砜(DMSO),震荡待结晶溶解,在490 nm波长下检测细胞吸光度(A)。每组设5个重复孔,实验重复3次。
将原代心肌细胞分为miR-155 inhibitors组(转染miR-155 inhibitors)、miR-NC inhibitors组(转染miR-NC inhibitors)、H/R+miR-155 inhibitors+SIRT1 blocker组(共转染miR-155 inhibitors和SIRT1 blocker)、H/R+miR-155 inhibitors组(共转染miR-155 inhibitors),均用脂质体法转染,转染24 h后进行缺氧再复氧(缺氧6 h,复氧2 h)转染成功后,将各组细胞培养12、24、48、72 h按上述方法进行细胞活力检测。
1.2.6Western印迹实验 取适量对数生长期的各转染组细胞,RIPA裂解后,提取总蛋白,BCA法蛋白定量后变性,然后按照操作步骤进行蛋白电泳-转膜-封闭-Ⅰ抗孵育-Ⅱ抗孵育-显影曝光。以目的条带灰度值与内参甘油醛-3-磷酸脱氢酶(GADPH)灰度值的比值表示目的蛋白的表达情况。
1.2.7Annexin V-FITC/PI双染色法检测细胞凋亡 取适量对数生长期细胞,用预冷的PBS 洗涤 2次。用结合缓冲液 500 μl 悬浮细胞,分别加入5 μl的 annexin V-FITC和PI,混匀,室温避光静置15 min。细胞凋亡率采用流式细胞术分析测定。细胞的总凋亡率(%)=早期凋亡率+晚期凋亡率。每个样品重复3次。
1.2.8酶联免疫吸附试验(ELISA) 运用ELISA试剂盒检测各组细胞氧化指标LDH、SOD、 MDA、 NO的含量。具体操作步骤按照试剂盒说明书要求进行操作,分析结果。
1.2.9双荧光素酶报告基因实验 取适量对数生长期的H9C2,取5 μl细胞裂解液与萤火虫荧光素酶缓冲液和5 μl底物混匀,测荧光强度。然后加入海肾荧光素酶缓冲液和5 μl腔肠素底物,混匀,再次测得海肾荧光素酶活性。以psiCHECK2为载体,将SIRT1 WT、SIRT1 MUT用脂质体法与载体共转染,构建psiCHECK2-SIRT1 WT和psiCHECK2-SIRT1 MUT质粒载体,观察miR-155与SIRT1的结合能力。
1.3统计学分析 采用SPSS21.0软件进行方差分析,t检验。
2 结 果
2.1miR-155在H/R H9C2细胞中高表达 与Control组(1.00±0.12)比较,H/R 组的miR-155表达(3.85±0.16)显著升高(P<0.05),miR-155 在 H/R H9C2 细胞中高表达。
2.2敲减miR-155表达促进H/R H9C2细胞的活力,抑制凋亡 将miR-155 inhibitors、miR-NC inhibitors转染大鼠原代心肌细胞,用MTT法检测细胞活力。与Control组相比,miR-NC inhibitors组miR-155表达差异不显著(1.12±0.08,1.00±0.06),细胞在12、24、48、72 h的增殖差异不显著(P>0.05);与miR-NC inhibitors组比较,miR-155 inhibitors组的miR-155表达显著降低(0.36±0.01,P=0.000),细胞在24、48 、72 h的增殖显著升高(P<0.05,P<0.01)。见表1。
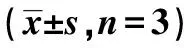
表1 MTT检测各组细胞增殖
1)miR-NC inhibitors组与Control组相比,2)miR-155 inhibitors组与Control组相比
将miR-155 inhibitors、miR-NC inhibitors转染H9C2细胞,用流式细胞术检测细胞凋亡。H/R+miR-155 inhibitors组、H/R+miR-NC inhibitors组、H/R组和Control组的H/R H9C2细胞均用Western印迹检测凋亡基因cleaved-caspase-3、Bcl-2的蛋白水平、流式细胞术检测细胞凋亡率。H/R组较Control组,cleaved-caspase-3蛋白水平显著升高,Bcl-2蛋白表达显著降低(P<0.001),见表2,图1A。H/R组较Control组细胞凋亡率显著升高〔(18.84±2.45)% vs (8.36±1.21)%,P=0.000〕,见图1B;H/R+miR-155 inhibitors组较H/R+miR-NC inhibitors组cleaved-caspase-3蛋白水平显著降低,Bcl-2蛋白表达显著升高(P<0.001),见表2,图1A。H/R+miR-155 inhibitors组较H/R+miR-NC inhibitors组细胞凋亡率显著降低〔(12.29±1.85)% vs (20.23±1.43)%,P=0.003〕,见图1B。
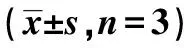
表2 Western印迹检测各组细胞中凋亡蛋白相对表达
1)H/R组与Control组相比,2)H/R+miR-NC inhibitors组与H/R+miR-155 inhibitors组相比,表3同

A:敲减miR-155的H/R H9C2细胞的蛋白表达图;B:敲减miR-155的H/R H9C2细胞凋亡图图1 敲减miR-155的H/R H9C2细胞蛋白表达和凋亡图
2.3敲减miR-155表达对H/R H9C2细胞中氧化应激指标的影响 运用ELISA检测H/R+miR-155 inhibitors组、H/R+miR-NC inhibitors组、H/R组和Control组H/R H9C2细胞中LDH、SOD、 MDA、NO的含量。与H/R+miR-NC inhibitors组比较,H/R+miR-155 inhibitors组的LDH、MDA、NO含量显著降低,SOD含量显著升高(P<0.05,P<0.001);与Control组比较,H/R组的LDH、MDA、NO含量显著升高,SOD含量显著降低(P<0.01,P<0.001)。见表3。
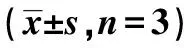
表3 miR-155对H/R H9C2细胞氧化应激指标的影响
2.4miR-155靶向调控SIRT1 运用Targetscan预测到miR-155与SIRT1存在靶向结合位点(图2A)。运用双荧光素酶报告基因检测实验检测miR-155 mimics组和miR-155 inhibitors组转染荧光素酶载体psiCHECK2-SIRT1-WT、psiCHECK2-SIRT1-MUT的H9C2细胞的荧光素酶活性,miR-155 mimics组较miR-NC mimics组SIRT1 3'UTR-WT细胞荧光素酶活性显著降低;miR-155 inhibitors组较miR-NC inhibitors组SIRT1 3'UTR-WT细胞荧光素酶活性显著升高,见图2B、C,表4。miR-155 mimics组较miR-NC mimics组SIRT1的蛋白表达显著降低(0.56±0.04,1.00±0.08),miR-155 inhibitors组较miR-NC inhibitors组SIRT1蛋白表达显著升高(2.23±0.09,1.00±0.06)。可见,miR-155靶向调控SIRT1。
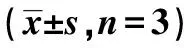
表4 荧光素酶报告基因实验验证miR-155与SIRT1靶向结合
2.5敲减SIRT1表达对大鼠原代心肌细胞活力及H/R H9C2细胞凋亡的影响 与Control组相比,miR-155 inhibitors组细胞在48 、72 h时,细胞的增殖显著升高,与miR-155 inhibitors组相比,miR-155 inhibitors+SIRT1 blocker组细胞在48 、72 h时,细胞的增殖显著升高(P<0.05,P<0.01),见表5。与Control组相比,H/R组细胞中SIRT1、Bcl-2的蛋白表达显著降低,cleaved-caspase 3蛋白表达显著升高(P<0.001),见表6、图3A、B,细胞凋亡率显著升高〔(22.84±1.35)%,(7.21±0.40)%,P<0.05〕,见图3C;与miR-155 inhibitors组相比,miR-155 inhibitors+SIRT1 blocker组细胞中SIRT1、Bcl-2的蛋白表达显著降低,cleaved-caspase 3蛋白表达显著升高(P<0.001),见表6、图3A、B,细胞凋亡率显著升高(18.54±1.38,12.63±1.03),见图3C。
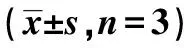
表5 miR-155通过SIRT1调控H9C2细胞增殖
1)miR-155 inhibitors组与Control组相比, 2)miR-155 inhibitors+SIRT1 blocker组与miR-155 inhibitors组相比
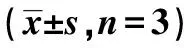
表6 miR-155通过SIRT1调控H9C2细胞中凋亡蛋白表达
1)H/R组与Control组相比,2)H/R+miR-155 inhibitors+SIRT1 blocker组与H/R+miR-155 inhibitors组相比,表7同

图3 敲减SIRT1表达对心肌细胞蛋白表达和凋亡的影响
2.6敲减SIRT1对H/R H9C2细胞氧化应激的影响 H/R组较Control组LDH、MDA、NO含量显著升高,SOD含量显著降低(P<0.001);H/R+miR-155 inhibitors+SIRT1 blocker组较H/R+miR-155 inhibitors组LDH、MDA、NO含量显著升高,SOD含量显著降低。见表7。可见miR-155靶向SIRT1调控H/R H9C2细胞的氧化应激。
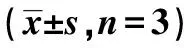
表7 miR-155通过SIRT1调控H9C2细胞氧化应激
3 讨 论
心血管疾病为世界范围内致死致残的主要原因,其中以心肌缺血再灌注损伤最为常见,危险性最大。目前临床上常用动脉搭桥、溶栓治疗、皮冠状动脉介入术治疗早期心肌缺血损伤。心肌缺血再灌注是一个复杂的病理生理过程,涉及凋亡、氧化应激、线粒体功能障碍、细胞自噬、钙超载等,此为缺血性心脏病患者预后不良的重要原因〔13〕。活性氧簇和血管活性物质NO在其中起重要作用〔14〕。因此,对心脏病的相关发病机制研究具有重要意义。
miRNA为一类内源性的小核苷酸片段,约有30%的人类基因受miRNA的调节〔15〕。miRNA在很多心脏病的发生发展中也具有重要作用,如心肌肥大、心肌凋亡及血管生成等病理生理过程〔16〕。近几年miRNA靶向治疗各种心脏病的研究日益增多。柳培雨〔17〕在心肌缺血再灌注损伤中的研究中,阐明miRNA-214在心肌损伤中表达上调且具有保护心肌损伤功能。贺王伟〔18〕在心肌梗死的研究中发现,miR-155对小鼠急性心肌梗死的心肌重构具有促进作用,其作用机制可通过靶向调控肿瘤p53蛋白诱导核蛋白1影响心脏成纤维细胞蛋白合成、凋亡、增殖及表型转化实现。
本研究运用RT-qPCR检测H/R H9C2细胞中miR-155的表达发现,miR-155高表达,这与贺王伟等的研究结果相吻合;用MTT法、Western blot、流式细胞术及ELISA检测敲减miR-155表达的H/R H9C2细胞发现,敲减miR-155 可促进H/R H9C2细胞的活力、抑制凋亡、促进氧化应激;运用Targetscan预测miR-155与SIRT1存在结合靶点,双荧光素酶报告基因实验验证SIRT1为miR-155的靶点,且与miR-155表达呈负相关,提示miR-155参与心肌细胞生长、凋亡和氧化应激。
SIRT1存在于细胞核内,通过穿梭调节细胞质中的靶基因,其具有抗炎、抗氧化。抗凋亡等作用〔19〕。SIRT1由747个氨基酸组成,形成一个高度保守的催化核心结构域 ,且具有高度无序的N-末端和C-末端区域,该核心结构域为发生NAD+依赖性脱乙酰化反应的区域〔20〕。已有研究报道,松果体素可上调SIRT1表达〔21〕、miR-34a可下调SIRT1表达〔22〕、TNF-α可抑制SIRT1活性〔23〕。孙秀玉等〔13〕在研究Sirtuin家族对心肌缺血再灌注损伤的研究中阐明,SIRT1可通过多靶点抵抗细胞氧化应激,且SIRT1的抗氧化作用在心肌保护中具有重要作用。Qiu等〔24〕发现,SIRT1为miR-204的直接靶点,且过表达SIRT1可以部分逆转miR-204对H/R诱导的H9C2凋亡和自噬的影响。本研究通过检测敲减SIRT1表达的H/R H9C2细胞的活力、凋亡蛋白cleaved-caspase-3和Bcl-2的表达、细胞凋亡率和氧化应激指标LDH、SOD、MDA、NO含量发现,敲减SIRT1表达可逆转敲减miR-155表达对H/R H9C2细胞的促生长、抑凋亡及促氧化应激作用,揭示SIRT1具有减轻H/R诱导的H9C2细胞损伤的作用。
综上所述,miR-155可促进大鼠原代心肌细胞生长、抑制H/R心肌H9C2细胞凋亡和促进氧化应激,该机制可能与靶向SIRT1有关,为心脏病的治疗提供新靶点。
