艾地苯醌对血管性痴呆大鼠海马BDNF mRNA及受体TrkB mRNA表达的影响
2019-12-20钱旭东王东徐倩倩李国芸王红梅张晓璇马征
钱旭东 王东 徐倩倩 李国芸 王红梅 张晓璇 马征
(承德医学院附属医院 1神经内科,河北 承德 067000;2呼吸内科)
血管性痴呆(VD)发生的原因主要与脑血管因素有关,其发生基础为脑组织受损而引发神经功能异常〔1,2〕。艾地苯醌对改善多种神经系统疾病造成的认知功能下降、VD治疗方面有重要的临床作用〔3~5〕。本实验拟分析艾地苯醌对VD大鼠海马脑源性神经营养因子(BDNF)mRNA及高亲和力受体酪氨酸激酶(Trk)B mRNA表达的影响。
1 材料与方法
1.1研究对象 选取100只雄性7周龄健康清洁级SD大鼠〔许可证号:SCXK(冀)2008-1-003,合格证号:1404010,河北医科大学实验动物中心提供〕,体重250~300 g。每5只放到1个笼子中饲养,维持湿度50%~70%,维持室温为20~25℃,给予颗粒型普通大鼠饲料,造模前予以适应性喂养1 w。
1.2主要试剂和仪器 TaqMan®RNA反转录试剂盒(美国ABI公司,Lot:20170634),总RNA抽提试剂盒(No:K0731,美国赛默飞生物公司),凝胶图像分析系统(Biosens SC710,美国BIOTOP公司),荧光定量PCR仪(LightCycler480,美国罗氏生物),低速离心机(TDL5,上海安亭科学仪器厂),miScript Ⅱ反转录试剂盒(上海凯杰生物公司),山羊抗小鼠〔辣根过氧化物酶(HRP)标记的二抗,上海Abcam公司,货号ab6789〕,Western印迹电化学发光(ECL)检测试剂盒(Bio-Rad公司,货号170-5060),ZS-001 Moriss 水迷宫(北京众实迪创科技发展有限公司),BDNF抗体、TrkB抗体(武汉博士德公司生产);PCR扩增引物(上海生工公司生产)。
1.3建立模型及分组 模型建立方法:两血管阻断法(2-VO)。术前大鼠禁食12 h,禁水4 h,后腹腔注射10% 水合氯醛(3.5 ml/kg)麻醉大鼠,选取颈部正中为切口,将双侧颈总动脉进行分离后用4 号丝线结扎,最后将皮肤缝合并在伤口处注射庆大霉素(0.2万U),以便减小感染发生率,分离假手术组双侧颈动脉。艾地苯醌高剂量组、艾地苯醌低剂量组、对照组在建立模型后第3天进行药物干预,艾地苯醌高剂量组灌服10 mg/kg艾地苯醌,艾地苯醌低剂量组灌服3 mg/kg艾地苯醌,对照组灌服11.06 mg/kg尼莫地平。模型组、假手术组灌服生理盐水,保持灌服10 ml/kg,1次/d,连续灌服1个月。药物干预、建立模型完成后剔除死亡大鼠,最终假手术组、艾地苯醌高剂量组、艾地苯醌低剂量组、对照组各20只。
1.4检测大鼠学习记忆能力情况 药物干预1个月后,Morris 水迷宫测试所有大鼠,共测试6 d,在前5 d只需测试定位航行,第6天测试空间探索。保持水深35 cm,水温22℃,追踪大鼠应用摄像头。对采集的所有图像、视频等及时导入电脑并对分析数据。定位航行水点标记标准:将每一象限的中点作为水点进行标记,在大鼠找平台位置的前2 min进行记录,将平台上停留时间>2 s作为逃避潜伏期。1 d记录4次,最后计算出平均值。空间探索:将平台拿走后选择任何一个水点将大鼠放入,记录2 min内大鼠跨越平台的总次数,同时记录停留时间。
1.5Western印迹测定BDNF、TrkB蛋白水平 选取脑组织:将所有大鼠处死后取出脑组织,应用刀片切开,将完整的左右双侧海马进行钝性分离,后将左侧海马组织及时放入液氮中冷冻1 h,后将其放入-80℃超低温冰箱中。取约100 mg 组织后加入1 ml 10×蛋白变性缓冲液,100℃变性5 min,后将变性溶液加入10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)内,将溶液置入90 V恒压中进行100 min电泳,当溴酚兰跑出变性胶后停止电泳,后进行转模。恒流转移:在酸纤维素膜上放上SDS-PAGE后,转膜成功进行封闭(3%BSA),封闭后将其放在4℃环境下一夜,第2天磷酸盐缓冲液(PBS)冲洗硝酸纤维素膜,按1∶500的比例将BDNF单克隆抗体加入其中,后在室温下孵育45 min,孵育完成PBS冲洗硝酸纤维素膜;后对二抗进行孵育,按1∶1 000的比例将HRP标记的二抗加入其中,后室温下孵育30 min,之后应用PBS冲洗硝酸纤维素膜,进行化学发光,后使用Kodak X曝光3 min进行成像操作。检测各条带吸光度值,内参照为β-actin,BDNF相对表达量应用灰度值表示,后采用同样方法检测组织中TrkB的表达。
1.6荧光定量PCR检测BDNF、TrkB mRNA的表达 组织RNA提取:-80℃超低温冰箱中取出海马组织,研钵中迅速磨成粉末状;取出100 mg粉末加入含有1 ml Trizol裂解液的EP管中,混合均匀;室温静止5 min,加入200 μl氯仿,充分混匀,室温放置10 min;4℃离心分取上层水相,并放置RNase-free 1.5 ml离心管内,后加入等量的异丙醇充分震荡,然后在冰上放置约30 min;取出离心管,再4℃离心分取得到RNA沉淀;应用500 μl 75%酒精洗涤RNA沉淀2次,风干;再加入50 μl RNase-free水在室温下溶解RNA;应用NanoDrop检测提取的RNA浓度,完成后将其放置-20℃条件下备用。
检测定量PCR:对抽取的RNA进行体外反转录实验,最终得到产物cDNA,操作时严格按照说明书进行;16℃条件下孵育30 min,42℃条件下孵育30 min,后85℃条件下加热5 min,后放置4℃条件下保存。将cDNA作为模板进行荧光定量PCR检测,反应体系为TaqMan®Universal PCR Master Mix 20 μl,操作仪器为罗氏LightCycler480,内参照为β-actin表达水平,ΔCT为BDNF相对值,ΔCT=CTβ-actin-CTBDNF,引物信息为BDNF:上游引物:5'-AGGGGCATAGACAATCG-3',下游引物:5'-TTCCCCTTGATAATGGTC-3';TrkB:上游引物:5'-AGTCGTCGAGACATGTC-3',下游引物:5'-CTGAAGACGGACTGTTG-3;β-actin:上游引物:5'-GCTGTCCCTGTATGCCTC-3',下游引物:5'-AGATGTCAGCGCACGAC-3'。采用同样的方法检测TrkB在RNA水平的表达。
1.7统计分析 应用SPSS18.0软件进行χ2检验、方差分析及t检验。
2 结 果
2.15组定位航行比较 模型组逃避潜伏期〔(60.24±27.84)s〕显著长于艾地苯醌低剂量组、艾地苯醌高剂量组、假手术组、对照组〔(42.51±20.12)s、(32.28±17.48)s、(21.37±15.45)s、(33.64±18.32)s,P<0.05〕,假手术组显著短于艾地苯醌低剂量组、艾地苯醌高剂量组、对照组(P<0.05);而相比于假手术组,艾地苯醌高剂量组和对照组差异无统计学意义(P>0.05)。
2.25组空间探索结果比较 假手术组穿越原平台次数、原平台停留时间明显多于艾地苯醌低剂量组、艾地苯醌高剂量组、模型组、对照组(P<0.05);模型组均明显少于艾地苯醌低剂量组、艾地苯醌高剂量组、对照组(P<0.05)。艾地苯醌高剂量组与对照组相比差异无统计学意义(P>0.05)。见表1。
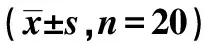
表1 各组模型水迷宫探索结果比较
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05
2.3各组脑海马BDNF、TrkB 蛋白表达比较 模型组BDNF、TrkB 蛋白表达水平显著低于艾地苯醌低剂量组、艾地苯醌高剂量组、假手术组、对照组(P<0.05)。与艾地苯醌高剂量组比较,艾地苯醌低剂量组均显著降低(P<0.05)。见图1,表2。
2.4各组脑海马BDNF mRNA、TrkB mRNA表达比较 模型组TrkB mRNA、BDNF mRNA表达水平显著低于艾地苯醌低剂量组、艾地苯醌高剂量组、假手术组、对照组(P<0.05)。与假手术组相比,艾地苯醌高剂量组和对照组均无显著变化(P>0.05);而艾地苯醌低剂量组均显著低于假手术组(P<0.05)。见表2。
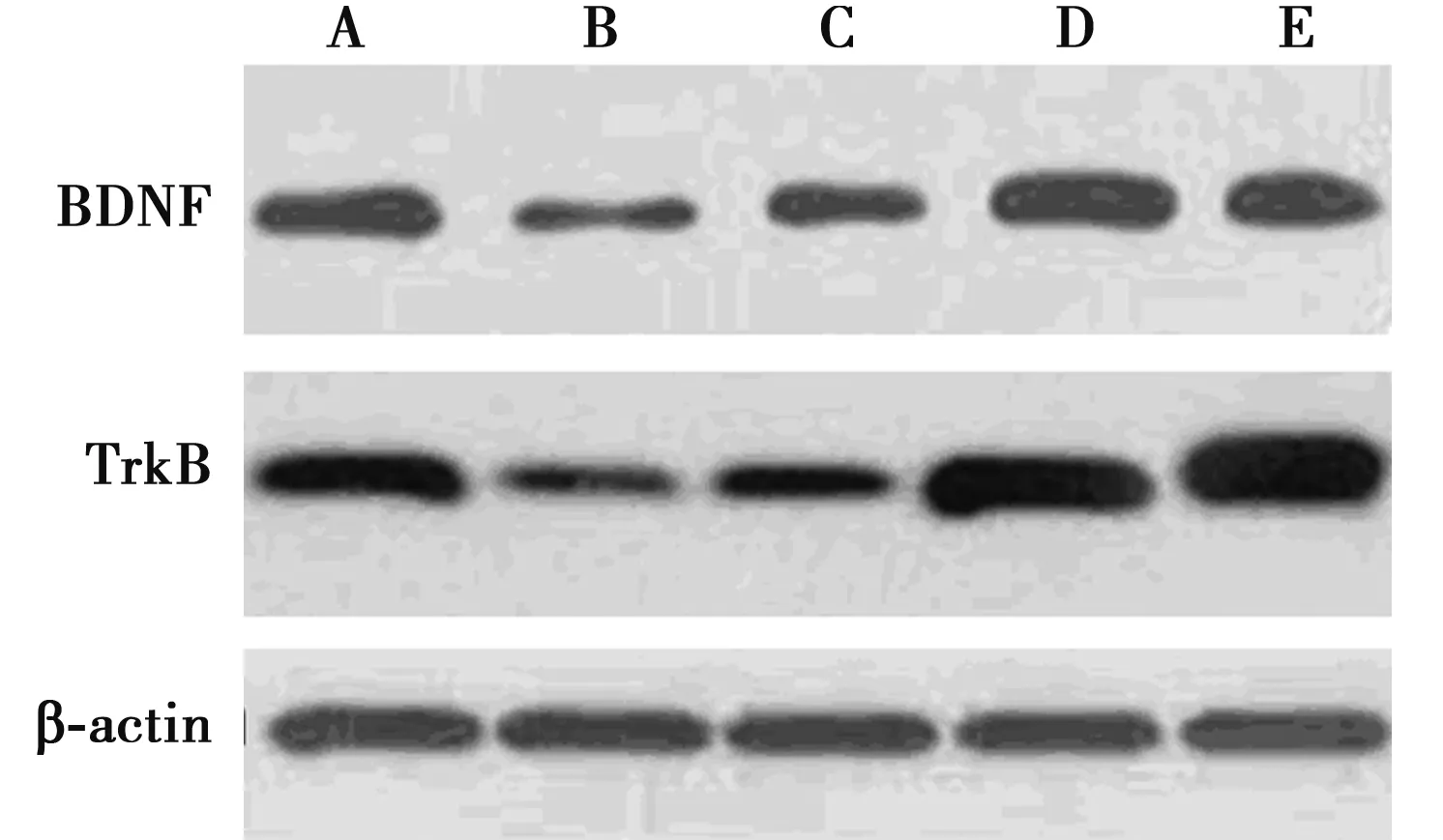
A~E:假手术组、模型组、艾地苯醌低剂量组、艾地苯醌高剂量组、对照组图1 各组脑海马BDNF 和TrkB 蛋白表达
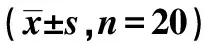
表2 各组脑海马BDNF 和TrkB 蛋白及mRNA表达比较
与模型组比较:1)P<0.05;与艾地苯醌低剂量组比较:2)P<0.05
3 讨 论
VD 的发生主要与脑部血管发生病变全脑组织或局部脑组织发生缺氧缺血,最终对脑部认知记忆、神经组织造成损伤显著相关〔6〕。小脑、海马体、大脑皮质对缺氧、缺血的敏感度非常高〔7〕。脑部缺血、缺氧导致损伤发生后会引发一系列级联反应,如氧化应激反应、细胞死亡、炎性反应、梗死周围去极化、兴奋性氨基酸毒性、能量衰竭等,发生反应会对神经递质的突触传递、调节功能产生影响,进而对神经元造成一定的损伤,且会对学习记忆功能产生很大影响〔8,9〕。有研究表明,艾地苯醌可抑制炎性反应,进而会对小胶质细胞的生长繁殖过程产生抑制作用,从而在治疗VD过程中发挥非常重要作用〔10〕。本实验表明,脑缺血导致神经元损伤是引起痴呆的重要原因,艾地苯醌药可以有效减轻缺氧、缺血对神经元造成的损伤,可以有效保护海马神经元。
神经营养因子由多种细胞分泌,对外周神经系统、中枢系统发挥重要作用,它们通过自分泌、旁分泌、靶源分泌等多种形式发挥调节神经系统活动及代谢能力,该因子在修复损伤神经系统方面起着关键性作用〔11~13〕。BDNF广泛存在于脑组织中,其在皮质、海马体中的含量最多,作用为维持脑缺血后神经元的生长繁殖,促进神经元细胞、神经元轴突、树突的生长繁殖,促使神经元突触间递质的分泌等,同时可以有效改善学习记忆功能,改善VD 认知功能〔14,15〕。BDNF通常与受体TrkB发生特异性结合,进而会增强细胞内酪氨酸激酶的生物活性,诱导TrkB发生磷酸化等,最终会刺激下游信号通路,对神经元进行保护〔16〕。当脑部组织发生缺氧、缺血时,BDNF、受体TrkB 的含量会明显升高,当BDNF、受体TrkB 含量减少时,会使动物学习记忆受到严重损伤〔17〕。本研究结果表明,艾地苯醌可以提高BDNF、受体TrkB水平,可以有效刺激下游信号通道,进而有利于修复受损海马神经元,最终提高VD 大鼠的学习能力、记忆能力。
