大分割适形放疗在晚期非小细胞肺癌患者中的应用及放疗抵抗发生与血清miR-123和肝细胞生长因子受体表达的关系
2019-12-20张利伟石安辉娄志霞刘苓苓孙瑞霞
张利伟 石安辉 娄志霞 刘苓苓 孙瑞霞
(1中国科学院合肥肿瘤医院肿瘤放疗科,安徽 合肥 230031;2北京大学肿瘤医院放疗科)
肺癌是目前全世界范围内发病率和恶性程度最高的恶性肿瘤,我国约85%肺癌属于非小细胞肺癌(NSCLC),50%~75%患者确诊时已处于中晚期,丧失了早期手术切除机会,放化疗是主要的临床治疗方案。常规分割放疗主张单次小剂量、增加放疗次数,虽然提高了放疗安全性,在放疗间歇期增加了肿瘤细胞再氧合、细胞周期再分布,也提高了下一次分割照射的敏感性〔1〕,但同时也发现更多的肿瘤细胞存活,增殖加快,导致再群体化,增加了放射抵抗性〔2〕。也有研究指出〔3〕,放疗本身作为一种应激源,对肿瘤群体起到筛选作用,使原本不耐受放疗的肿瘤细胞死亡,而放疗耐受的细胞存活下来继续增殖和转移。大分割适形放疗通过提高单次放疗剂量和缩短放疗次数,较常规放疗提高了肿瘤细胞杀伤力度,缩短了整体治疗疗程,有效控制局部病灶,抑制肿瘤细胞的存活和再增殖活性,减少了放疗抵抗,提高了患者存活率〔4〕。放疗抵抗的产生导致放疗失败,患者临床预后变差。放疗抵抗的产生是多基因、多因子和多机制共同参与的病理生理过程,与放疗方案、磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/AKT/mTOR)信号通路活化程度、肿瘤干细胞的产生、多种微小RNA(microRNAs)的表达、肝细胞生长因子受体(HGFR)活性〔5~7〕等密切相关。本研究主要探讨大分割适形放疗在晚期NSCLC患者中的应用及放疗抵抗发生与血清miR-123和HGFR表达的关系。
1 对象与方法
1.1对象资料 回顾性总结2015年1月至2017年12月中国科学院合肥肿瘤医院及北京大学肿瘤医院确诊晚期NSCLC患者86例临床资料,纳入标准:①经影像学或CT引导肿瘤穿刺或支气管镜细胞活检病理确诊NSCLC;②TNM分期Ⅲb~Ⅳ期;③Karnofsky功能状态(KPS)评分≥75分;④接受单纯的大分割适形放疗;⑤坚持完成规定疗程,取得知情同意,临床资料完善。排除标准:①存在放疗禁忌;②应用化疗、生物治疗;③严重肝肾功能障碍。86例患者中男50例,女36例,年龄58~79〔平均(65.5±7.8)〕岁,体重指数(BMI)22.5~26.5〔平均(24.5±2.3)〕kg/m2,Ⅲb期62例,Ⅳ期24例,原发肿瘤最大直径2.5~5.6〔平均(3.9±1.1)〕cm。
1.2放疗方法 入院完善相关检查,评估疾病严重程度和放疗风险,大分割适形放疗具体方案为仰卧位,医科达公司(Electa)6D-Axesse高能直线加速器;压力传感器,定位体框架,真空负压垫体位固定,Philips Brilliance CT Big Bore完成4DCT平扫+常规增强,对治疗靶区与危及器官进行勾画,确定内大体肿瘤体积(IGTV)、内临床靶区(ICTV)、计划靶区(PTV);95%等剂量曲线对计划靶体积环绕,设定容积调强放疗(VMAT)单弧或者双弧旋转照射。处方剂量DT:3.5~6.0 Gy/次,5次/w,总剂量48~60 Gy,共2~3 w,同时对危及器官进行限量,注意对放疗区域外的器官进行保护,放疗间隙期加强营养支持,密切监测各项生命体征和血生化,对不适反应进行对症处理。
1.3研究方法 放疗结束后1个月评估临床疗效,入组患者至少存在一个可测量体积的原发肿瘤病灶,临床疗效参照实体瘤标准〔8〕分为显效、有效、稳定和无效,其中显效为肿瘤体积较基线水平至少缩小70%,无明显并发症,至少稳定1个月不复发;有效为肿瘤体积缩小40%~69%,至少稳定1个月不复发;稳定为肿瘤体积缩小≤39%,无新发肿瘤病灶;无效为肿瘤体积较前增加,或出现新发肿瘤病灶,或出现严重放疗并发症,需要终止治疗。将显效和有效定义为放疗敏感,稳定和无效定义为放疗抵抗。采用反转录PCR(RT-PCR)检测血清miR-123水平,酶联免疫吸附试验(ELISA)检测血清HGFR水平。采集患者清晨空腹肘静脉血10 ml,2 500 r/min离心15 min取上层血清,分装2只EP管中,-80℃保存待检,一支用于miR-123检测,一支用于HGFR检测。ELISA试剂购自美国Sigma公司,严格按照说明书步骤进行。
1.4RT-PCR主要步骤 在装有两组样品试管中加入等体积萃取试剂Trizol,根据提示一步法提取完整细胞中RNA,减少RNA变性损失;然后测定其浓度和纯度,根据反转录试剂盒提示合成cDNA;设计引物序列,miR-123:正义链5′-GGTTTCATCCAGGATCGAGCAGG-3′,反义链5′-ACAAAGATGGTCACGGTCTGCC-3′,445 bp;内参GAPDH:正义链5′-CGCGAGAAGATGACCCAGAT-3′,反义链:5′-GCACTGTGTTGGCGTACAGG-3′,225 bp。反应体系为cDNA 2 μl+上下引物各 3 μl+Taq 聚合酶0.5 μl,加无菌反应水至总体积为25 μl,反应条件为95℃ 5 min,(95℃ 30 s、58℃ 30 s、72℃ 60 s)×30个循环,72℃ 10 min结束。2%琼脂糖凝胶电泳鉴定PCR产物,数码照相行灰度值分析,结果以目标引物与内参引物的灰度比值表示。
1.5统计学方法 采用SPSS20.0统计软件进行t及χ2检验。
2 结 果
2.1放疗抵抗的发生 86例患者均顺利完成放疗,疗效评估中显效39例,有效21例,稳定15例,无效11例,60例表现放疗敏感,26例表现抵抗;两组临床资料差异无统计学意义(P>0.05)。见表1。
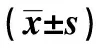
表1 放疗敏感组和抵抗组临床资料比较
2.2两组血清miR-123水平的比较 敏感组放疗前和放疗后1个月血清miR-123水平明显低于抵抗组同时点(P<0.05),敏感组放疗后明显低于放疗前(P<0.05),但抵抗组放疗后与放疗前比较差异无统计学意义(P>0.05)。见表2。
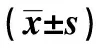
表2 两组血清miR-123水平的比较
2.3两组血清HGFR水平比较 敏感组放疗前和放疗后1个月血清HGFR水平明显低于抵抗组同时点(P<0.05),敏感组放疗后明显低于放疗前(P<0.05),但抵抗组放疗后与放疗前比较差异无统计学意义(P>0.05)。见表3。

表3 两组血清HGFR水平的比较
3 讨 论
肿瘤均会对放疗产生一定的抵抗,不同的肿瘤对不同的放疗方案产生抵抗率不同,这是目前临床研究的热点和难点〔9〕。关于放疗产生的机制学说也有多种,认为与亚致死性损伤和再修复、细胞再增殖、细胞周期再分布和再氧和、微环境改变和乏氧细胞成分等有关〔10〕。放疗在杀伤肿瘤细胞的同时,存活细胞和即将死亡细胞及周围组织间质之间存在广泛的联系,经多种细胞因子、激素和生长因子进行信号转导,进而影响肿瘤细胞基因的表达,最终产生放疗抵抗〔11〕。
本研究结果提示,晚期NSCLC患者经大分割适形放疗后产生抵抗率为30.2%。但是不同的研究对放疗抵抗的定义不同,导致不同研究结果差异较大。目前对放疗抵抗的定义也没有统一标准。本研究着眼于临床实际,采用放疗后1个月肿瘤体积的变化区分放疗效果,有一定的参考意义。本研究中放疗敏感组与抵抗组患者的性别、年龄、BMI、肿瘤分期、最大直径、病理分型和组织分化程度比较均无差异,提示患者和肿瘤的一般特征对预测放疗抵抗风险可能价值不大。进一步发现,敏感组放疗前和放疗后1个月血清miR-123和HGFR水平明显低于抵抗组,敏感组放疗后明显低于放疗前,但抵抗组放疗后与放疗前比较差异不明显,提示血清miR-123和HGFR水平上调可能预示放疗抵抗的风险增加。
miR-123是一类19~25个核苷酸组成的小单链内源性非编码RNA,主要生物学功能是与特定mRNA结合,阻断效应蛋白编码基因的表达,激活致癌通路、抑制抑癌基因活性、诱导相关肿瘤蛋白的表达来参与放疗抵抗〔12〕。体外肺癌A549细胞实验发现〔13〕,放射敏感细胞群中miR-123表达水平明显高于抵抗细胞群,考虑与miR-123增加了放疗过程中肿瘤细胞阻滞于G1期,诱导更多细胞凋亡有关。miR-123也表现抑癌效应,调节神经纤毛蛋白(NRP)-1表达活性增强NSCLC细胞的放射敏感性〔14〕。miR-123还能够抑制HGF/c-Met信号通路活性,诱导NSCLC细胞凋亡,降低放疗抵抗〔15〕。HGFR能够与HGF特异性结合,HGF/c-Met是由c-Met原癌基因编码的跨膜酪氨酸激酶受体,是肿瘤细胞增殖、侵袭及转移过程中重要的信号通路〔16〕。约40%以上NSCLC组织中c-Met呈阳性表达,c-Met阳性往往预示NSCLC患者临床预后较差〔17〕。HGFR表达上调提示HGF/c-Met信号通路活性增强,对放疗抵抗风险增加,内在机制与放疗诱导肿瘤细胞DNA损伤,激活DNA损伤修复,介导活化核因子(NF)-κB激活c-Met基因转录和HGF/c-Met信号通路相关蛋白的表达,增强细胞侵袭性,抑制细胞凋亡,增加放疗抵抗性〔18〕。此外,PI3K/AKT信号通路也参与了多种肿瘤的发生、发展和转归,与肿瘤的放疗抵抗机制有关。PI3K/AKT信号通路激活后可以抑制DNA双链断裂的主要修复机制,实现放射增敏作用;还可以作用于周期素D依赖蛋白激酶,调节细胞周期G1/S期转化,参与肿瘤细胞的增殖和细胞周期分布,抑制PI3K/AKT信号通路使细胞阻滞于G1期,防止放射治疗的再群体化,从而提高放疗敏感性〔19〕。研究证实〔20〕,mTOR抑制剂能够有效抑制PI3K/AKT信号通路活性,提高放疗敏感性。肿瘤干细胞的存在也是放疗抵抗的一个重要机制,肿瘤干细胞是肿瘤细胞中具有干细胞特性的异质性细胞,具有自我更新、多项分化潜能和不对称分裂等功能,尽管数量只占肿瘤组织1%左右,但在肿瘤侵袭、复发和转移中发挥重要作用〔21〕。肿瘤干细胞具有明显的放疗抵抗效应,促进DNA损伤修复、降低和清除活性氧、改变肿瘤微环境等多种途径来逃避放疗的杀伤作用。放疗后即使残留数量极少的肿瘤干细胞也能在放疗间隙期大量增殖,造成肿瘤的复发和转移,产生放疗抵抗〔22〕。
综上所述,尽管大分割适形放疗在晚期NSCLC患者中有较好的安全性和有效性,但仍有一定的放疗抵抗发生,可能与机体表达较高水平的miR-123和HGFR密切相关。研究不足是未能进一步阐述放疗抵抗与miR-123和HGFR表达之间的内在联系,以及miR-123和HGFR之间是否也存在紧密联系,miR-123和HGFR是否能作为增加放疗敏感性的干预靶点还需要进行深入探讨。
