树突细胞-细胞因子诱导的杀伤细胞在抗肿瘤生长免疫治疗中的应用
2019-12-20赵芳张睿王娟王建华许卫星刘静尹风雷蔡秀萍马洪玉杨博
赵芳 张睿 王娟 王建华 许卫星 刘静 尹风雷 蔡秀萍 马洪玉 杨博
(1沧州市中心医院血液一科,河北 沧州 061000;2沧州市中心医院胸外科)
治疗恶性肿瘤的经典方式为放疗、化疗、外科手术,但各自存在局限性,损坏机体免疫功能。细胞免疫治疗方式在临床研究与实际应用的案例逐渐增多,作为治疗恶性肿瘤的第四种方法受到肿瘤研究领域关注〔1〕。郭卫东〔2〕探析树突细胞(DC)-细胞因子诱导杀伤细胞(CIK)联合化疗治疗晚期非小细胞肺癌的临床效果,选择某医院两年间治疗的90例晚期非小细胞肺癌患者分为两组,观察6个周期,采用DC-CIK联合化疗治疗,统计治愈率与生存率。Van Acker等〔3〕总结普通γ链家族细胞因子在γδT细胞抗癌免疫治疗中的作用。常见γ链受体家族的细胞因子包括白细胞介素(IL)-2、IL-4、IL-7、IL-9、IL-15和IL-21,对于组织和维持健康免疫细胞功能至关重要。20世纪末期已经开始细胞免疫治疗的研究,研究对象包括淋巴因子激活的杀伤细胞、肿瘤浸润淋巴细胞、CD3单体克隆抗体激活的杀伤细胞等〔4〕,研究显示上述细胞均存在一定的杀瘤活性,因为细胞增殖能力弱导致杀瘤效果不显著。DC与CIK联合作用即细胞免疫治疗方法,DC-CIK联合作用在免疫治疗恶性肿瘤方面取得显著成绩〔5〕。其应用领域广泛、治疗安全性强、毒副作用少是DC-CIK的显著优势,具有明显优化机体免疫力,可增强抗瘤活性的功能,利于提升肿瘤患者生命,临床研究前景广阔〔6〕。本文分析恶性肿瘤患者进行DC-CIK治疗在抗肿瘤生长免疫治疗中效果。
1 材料与方法
1.1收集病例 选取沧州市中心医院肿瘤诊疗中心的临床病例26例,病理学显示均为恶性肿瘤患者,全部接受手术与化疗治疗方式。其中,乳腺癌5例、肺癌4例、肾癌3例、肝癌5例、乳腺癌转肝癌2例、肝癌转骨癌5例、乳腺癌转肺癌2例。随机分为观察组与对照组,各13例。患者及其家属签署免疫治疗同意书,自愿参与肿瘤治疗研究。上述患者排除颅内转移、重度心脏功能不健全情况,不存在重度精神病、并发性恶性肿瘤患者。两组性别、年龄、美国东部肿瘤协作组(ECOG)评分、表皮生长因子受体(EGFR)状态、TNM分期不存在统计学差异(P>0.05),见表1。
1.2仪器与材料 仪器设备为(1)低速与高速离心机分别购自北京离心机厂、德国SIGMA公司;(2)细胞计数仪购自美国Invitrogen公司;(3)孵育箱型号为MCO-15AC,由日本三洋公司提供。试剂为(1)BTN无血清培养基由北京某生物有限公司提供;(2)CD3单抗与γ-干扰素(IFN)-γ由武汉生物研究所、上海克隆生物制品研究所提供;(3)淋巴细胞分离液购自北京某生物有限公司;(4)IL-2由上海某生物技术有限公司提供;(5)人血白蛋白来自上海莱氏血液公司。
1.3DC与CIK鉴定 采集恶性肿瘤患者的外周血单个核细胞进行检测,利用粒细胞集落刺激因子(GM-CSF)、IL-4、肿瘤坏死因子(TNF)-α细胞因子诱导贴壁细胞,通过流式细胞仪检测证明为DC;利用CD3单抗、IFN-γ、IL-2细胞因子诱导悬浮细胞,通过流式细胞仪检测证明为CIK。

表1 两组一般资料〔n(%)〕
1.4细胞培养 ①DC培养:进行外周血采集,采集前准备如下:使用50 ml注射器抽取0.5 ml肝素抗凝剂、抽取生理盐水10 ml,反复多次抽吸注射器;采集患者自身外周血各65 ml后,采用血细胞分离机、淋巴细胞分离液分离提取单个核细胞,数量在2.9×109个左右,淋巴细胞分离液使用量为1.066 g/ml。单个核细胞经RPMI1640洗涤(洗涤次数为2次,转速为1 560 r/min,时长为16 min)完成置入BTN无血清培养基混悬液在细胞培养瓶内,存储在孵育箱中,设置温度为36.8℃、二氧化碳含量为4.8%。计时2 h,移除悬浮细胞后置入IL-4和GM-CSF溶液各510 U/ml、1 100 U/ml,相同环境下培养。培养期间,6 d加入一次TNF-α约510 U/ml;22~3 w换液一次,IL-4和GM-CSF溶液换液量同上;换液完成与细胞回输前实施细菌与真菌培养检测。②CIK培养:将以上悬浮细胞作为基础,使用无血清培养基至2×106U/ml,此时计时为第0天,同时置入CD3单抗与IFN-γ分别为1 μg/ml、2 000 μg/ml,孵育箱培养温度与二氧化碳含量分别为36.8℃、4.8%,培养时长为24 h。第一天置入IL-2溶液1 100 μg/ml相同环境培养。2~3 w换液一次,IL-4和GM-CSF溶液换液量为510 U/ml、1 100 U/ml;每次换液完成与细胞回输前实施细菌与真菌培养检测。③DC-CIK共培养:微力磕打DC培养瓶,令细胞处于贴壁悬浮状态;倾倒DC至CIK培养瓶中进行混合培养,孵育箱温度为36.8℃、二氧化碳含量为4.8%。用以检测DC-CIK共培养生成IFN-γ、IL-12、TNF-α细胞因子的能力。
1.5细胞回输 DC回输:细菌霉菌检测在DC培养8、10、12、14 d后进行,检测结果为阴性,且活细胞比重在95.5%以上。使用细胞刷提取细胞,并转移到55 ml的离心管中,以15 min、1 500 r/min设定进行离心操作。除去上清液后,在含有20 g/L人血白蛋白的生理盐水中进行洗涤,重复两次;随之将细胞悬浮存放在6.5~8.5 ml生理盐水中,生理盐水人血白蛋白含量为22 g/L。细胞回输以每次3×108~8×108U的量进行,注射位置为两侧颈部、腋下及腹股沟淋巴引流区,行皮下注射。CIK回输:细菌霉菌检测在CIK培养12、14、16 d进行,检测结果为阴性,且活细胞比重在95.5%以上。将细胞转移到55 ml的离心管中,除去上清液后,在含有20 g/L人血白蛋白的生理盐水中洗涤,重复两次;随后将细胞悬浮存放在260 ml生理盐水中,生理盐水人血白蛋白含量为22 g/L、IL-2含量为2×105IU,(1~3)×109为每次回输细胞数量,使用输血器以静脉方式进行输注。CIK回输注意事项:(1)予患者10%葡萄糖酸钙与苯海拉明,防止出现过敏现象;(2)观察患者回输过程中是否出现寒战、发热、过敏现象,心肺功能是否产生变化,并正确记录。细胞培养与回输期间患者进行40 d疗程肌注,每隔一日进行一次分别进行IL-2 200万U肌注、α-2b干扰素300万U肌注。观察组行DC与CIK回输治疗,对照组行CIK回输治疗。
1.6免疫治疗评估 (1)免疫疗效评估:总T细胞(CD3+)、辅助性T细胞(CD3+CD4+)、杀伤性T细胞(CD3+CD8+)、NK(CD3-CD56+)及CIK(CD3+CD56+)。免疫评估指标分两次检测,一是疗程前,二是4个周期治疗后。(2)肿瘤治疗效果评估:①有所进展:患者自身症状减少20%以下,且症状始终呈现逐渐减少趋势;②稳定:患者自身症状减少20%~30%,且呈减少趋势;③部分缓解:患者自身症状减少30%以上,且该情况保持4 w;④完全缓解:症状全部消失,保持4 w以上。
1.7指标观察与检测 (1)细胞免疫表型检测:采用流式细胞仪检测培养8 w后的DC-CIK、CIK,记录检测结果。(2)细胞因子分析:IFN-γ、IL-12、TNF-α水平检测方法为酶联免疫吸附试验(ELISA)双抗体夹心法。(3)记录治疗过程中不良反应:包括发热、发量减少、白细胞数量降低、血小板数量降低、恶心呕吐及肝功能受损。
1.8统计学处理 采用SPSS19.0统计软件进行t检验、χ2检验。
2 结 果
2.1不良反应率 观察组与对照组发量减少、发热占比存在统计学意义(P<0.05);在白细胞数量降低、血小板数量降低、恶心呕吐、肝功能受损方面,观察组占比均低于对照组,但无统计学意义(P>0.05)。见表2。
2.2细胞免疫表型 两组CD3+、CD3+/CD4+、CD3+/CD8+、CD3+/CD56+阳性细胞比例有显著差异(P<0.05)。见表3。

表2 观察组与对照组不良反应率〔n(%),n=13〕
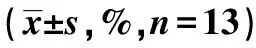
表3 两组细胞免疫表型
与对照组相比:1)P<0.05
2.3细胞上清液中分泌的细胞因子分析 对培养7 w后的CIK与DC-CIK上清液中分泌的细胞进行因子检测。CIK的IFN-γ、IL-12、TNF-α细胞因子表达均显著低于DC-CIK(P<0.05)。见表4。
2.4肿瘤治疗效果 两组治疗有效率存在显著差异(P<0.05)。见表5。

表4 CIK与DC-CIK分泌的细胞因子
与CIK相比:1)P<0.05

表5 两组肿瘤治疗效果〔n(%),n=13〕
4 讨 论
生物工程技术与肿瘤免疫学科结合形成一种崭新的生物治疗方式,又称为细胞免疫治疗〔7〕。以调动宿主原生防卫机制或者给予机体特定物质实现抗肿瘤效应,本质上是采用生物反应调节剂改善患者抵抗力,令机体具备杀伤、抑制肿瘤的功能。
CIK研究显示,利用人体外周血或者单个核细胞在体外与细胞因子结合、与CD3共同培养得到异质细胞,即自然杀伤细胞样T淋巴细胞,CIK占比为1.1%~5.1%。使用CIK进行抗肿瘤免疫治疗后,以往免疫疗法存在体外增殖细胞数量不足、效果不显著、副作用多的缺点得到改善,且基本不需注射IL-2〔8〕。迄今,研究未确定CIK杀伤靶细胞的原理,估计为肿瘤细胞和黏附因子结合后产生BLT酯酶颗粒,靶细胞膜被颗粒刺破后肿瘤细胞破裂;同时,IL-2、IL-6、TNF-α、GM-CSF是CIK细胞分泌的主要细胞因子,提升CIK诱导、杀伤肿瘤细胞的能力。
DC-CIK抗肿瘤疗效表现为:效应细胞杀伤肿瘤靶细胞的能力增强、免疫效应细胞抗肿瘤活性提升。DC-CIK存在增殖速度快、杀瘤活性高的优势,并且杀伤肿瘤细胞的同时不伤害机体免疫系统结构与功能,改善机体免疫功能〔9〕。DC-CIK回输治疗采血量少、副作用小、适用于大部分肿瘤患者,同时治疗效果显著。采用DC-CIK治疗恶性肿瘤过程中,医护人员应密切观察患者的状态与治疗反应〔10〕。已知具备最强抗原递呈能力的抗原递呈细胞为DC,在刺激幼稚T细胞活化与诱导特异性抗原免疫反应方面效果显著。免疫治疗肿瘤的关键是CIK与DC,CIK利用细胞毒功能与分泌性能因子杀伤肿瘤细胞,DC负责辨识病原并激活获得性免疫系统。
发热是DC-CIK在抗肿瘤生长过程中容易出现的不良反应,由于回输CIK悬液中存在IL-2与人血白蛋白导致患者发热。所以,使用DC-CIK进行抗肿瘤免疫治疗过程中应实时监测患者的体温、呼吸、血压及脉搏等各项指标,并准确记录,以便后续精准分析患者病情。本文显示,DC-CIK回输后2.5~10.5 h,小部分患者体温37.3~40.0℃,较大幅度升高;大部分患者体温可自然降低,极少数患者复用降低药后体温正常,高体温患者一般持续2.5~6.5 h。采用DC-CIK治疗肿瘤时应采取适当措施缓解患者发热的症状,预防措施为患者回输前30 min左右肌肉注射苯海拉明20 mg、盐酸异丙嗪25 mg。患者出现发热症状时,在医护人员指导下加量饮水,保持环境通风。若患者持续发烧40℃以上,在医生指导下药物降温。
相对化疗与放疗而言,DC-CIK免疫疗法治疗肿瘤过程中明显改善患者白细胞降低、贫血等症状,患者免疫功能不易受损。
