盐酸小檗碱对脂多糖诱导的大鼠急性脑损伤后脑组织形态学和NF-κB活性的影响①
2019-11-20何文龙高重阳余瑞云牛永超
马 竞 何文龙 高重阳 余瑞云 薛 鹏 牛永超
(新乡市中心医院神经内科,新乡453000)
脑损伤是由外力、细菌或药物引起的脑组织出现器质性的损伤。脂多糖(Lipopolysaccharide,LPS)是细菌细胞壁主要成分,也是抗生素应用后产生的内毒素的主要毒力因子,可刺激星型胶质细胞和小胶质细胞产生细胞因子,进而诱导血管内皮细胞的表面黏附分子的产生,调节内皮细胞分子间隙,从而使白细胞通过血脑屏障导致脑损伤[1]。因此,LPS常用来制作脑损伤模型。盐酸小檗碱(Berberine Hydrochloride,BH)又称为黄连素,是一种可从黄连、黄柏、三颗针等植物中提取到的季铵类化合物,属于异喹啉生物碱[2,3]。已有研究表明盐酸小檗碱具有降脂、降血糖、抗炎、抗菌和抗肿瘤等多种生理作用,但是其对LPS诱导的脑损伤的作用和机制并未见报道[4-10]。核转录因子NF-κB是具有多向性转录激活功能的调节因子,脑损伤后它在神经系统中广泛高水平表达,与其调控的细胞因子如肿瘤坏死因子 等一起积极参与炎症反应、神经细胞凋亡等生物进程,同时NF-κB又具有神经保护作用[11]。盐酸小檗碱对LPS诱导的脑损伤中NF-κB的影响还不清楚。本文主要研究盐酸小檗碱对脂多糖诱导的大鼠急性脑损伤后脑组织形态学和NF-κB活性的影响,以期为脑损伤的治疗提供参考数据。
1 材料与方法
1.1材料 SD大鼠购自四川省人民医院实验动物研究所,盐酸小檗碱购自四川升和药业股份有限公司,LPS购自美国Sigma公司,BCA试剂盒购自北京天根生化有限公司,SOD、MDA、GSH、LDH和ELISA试剂盒购自上海酶联生物。
1.2方法
1.2.1分组及处理方法 将SD大鼠随机分为对照组(Control组)、模型组(LPS组)、给药组[LPS+BH(25 mg)组,LPS+BH(50 mg)组、LPS+BH(100 mg)]组共5组,每组20只SD大鼠。给药组:各组每天分别灌胃25 mg/kg、50 mg/kg、100 mg/kg的盐酸小檗碱,连续6 d,然后大鼠腹腔注射LPS 0.6 mg/kg,6 h 后收集材料;模型组:每天灌胃等量的生理盐水,连续6 d,然后大鼠腹腔注射LPS 0.6 mg/kg,6 h后收集材料;Control组:除注射的是生理盐水之外,其他和模型组处理相同。
1.2.2HE染色 脑组织经甲醛固定后,用石蜡包埋、切片;然后经二甲苯、酒精、盐酸乙醇、伊红染液染色;接着经酒精、二甲苯固定装片;最后用显微镜观察。
1.2.3Tunel染色 脑组织经甲醛固定后,用石蜡包埋、切片;然后经二甲苯、乙醇、Proteinase K、多聚甲醛、Equilibretion Buffer、TdT酶反应液、SSC溶液、过氧化氢、Streptavidin HRP溶液、DAB显色液、苏木素复染之后,用酒精脱水、二甲苯透明;最后封片,用显微镜观察。
1.2.4RT-PCR 将脑组织的总RNA提取后反转录为cDNA,进行RT-PCR检测。以β-actin作为内参,反应条件为:95℃预变性2 min,95℃变性15 s,64℃退火30 s,72℃延伸30 s,共40个循环。Caspase-3的上游引物:5′-TGGACCTGTTGACCTGA-AAA-3′,Caspase-3的下游引物:5′-ACAAAGCGACTGGATGAACC-3′;Caspase-9的上游引物:5′-CTGAGCCAGATGCTGTCCCATA-3′,Caspase-9的下游引物:5′-GACACCATCCAAGGTCTCGATGTA-3′。
1.2.5Western blot 取脑组织,加入RIPA 裂解液,提取蛋白质;然后,使用 BCA试剂盒测定蛋白品浓度。取蛋白样品进行电泳分离,然后转入PVDF 膜,在5% 脱脂奶粉封闭30 min;接着,加入相应的一抗溶液中,室温条件下孵育 2 h;然后,加入 TBST 稀释的二抗溶液,室温孵育 1 h ;最后用ECL曝光。
1.2.6氧化应激水平检测 将脑组织加入生理盐水匀浆离心后,按SOD、 MDA、 GSH和LDH试剂盒说明书分别测定SOD、MDA、 GSH和LDH含量。
1.2.7ELISA检测 按照ELISA试剂盒说明书操作:加入蛋白、多肽和包被液混合,封闭剂封闭,再加入对应一抗,加入二抗,最后,加入显色液显色,用酶标仪检测。

2 结果
2.1盐酸小檗碱减轻脂多糖诱导的脑组织的病理损伤 通过HE染色观察发现:Control组细胞排列整齐,形态和结构正常;LPS组细胞排列紊乱,结构疏松;给药组细胞排列较紊乱,结构较疏松,程度比LPS组轻,特别是LPS+BH(100 mg)组细胞形态结构和Control组相接近(图1)。
通过Tunel染色观察发现:与Control组相比,LPS组细胞凋亡率显著增多,说明LPS诱导急性脑损伤造模成功,并且LPS会诱导脑细胞凋亡;与LPS组相比,给药组细胞凋亡率显著减少,并且随着给药量的增加,大鼠细胞凋亡率逐渐降低,说明盐酸小檗碱可以减轻LPS诱导的脑组织病理损伤,并抑制LPS诱导的细胞凋亡,且这种减轻和抑制作用随着给盐酸小檗碱量的增加而增强(P<0.01,图1)。
2.2盐酸小檗碱抑制脂多糖诱导的细胞凋亡 通过RT-PCR检测Caspase-3和Caspase-9的mRNA表达情况可知:与Control组相比,LPS组Caspase-3和Caspase-9的mRNA表达显著上调,说明LPS诱导急性脑损伤造模成功,并且LPS会诱导脑细胞凋亡;与LPS组相比,给药组Caspase-3和Caspase-9的mRNA表达显著下调,并且随着给药量的增加,大鼠细胞Caspase-3和Caspase-9的mRNA逐渐下调,说明盐酸小檗碱可以抑制LPS诱导的细胞凋亡,且这种抑制作用随着盐酸小檗碱素量的增加在增强(P<0.01,图2A)。
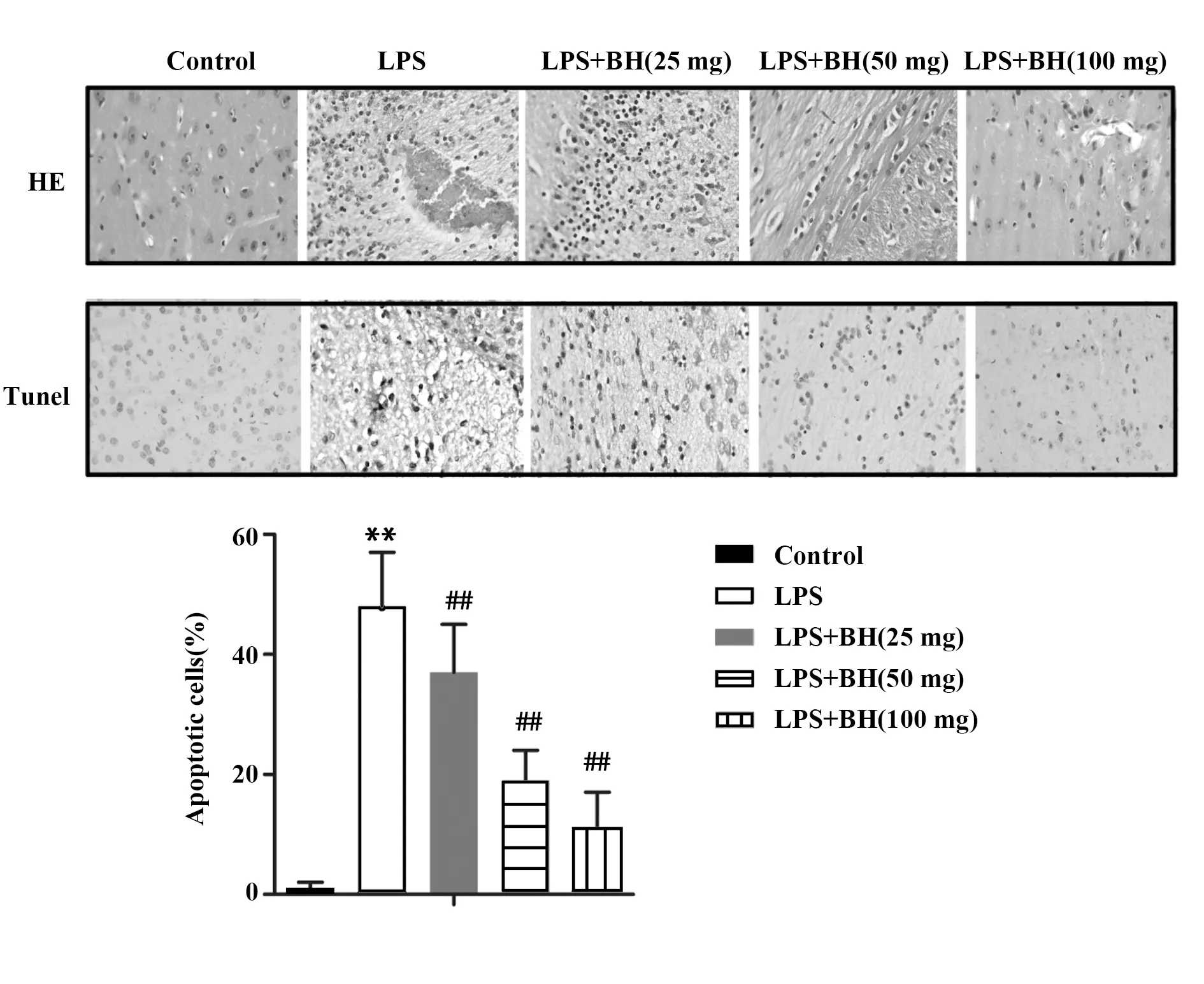
图1 通过HE染色和Tunel染色观察脑组织病理损伤(×400)Fig.1 Pathological damage of brain tissue observed by HE staining and Tunel staining(×400)Note: **.P<0.01 versus Control group;##.P<0.01 versus LPS group.

图2 Caspase-3和Caspase-9 的mRNA和蛋白表达情况Fig.2 mRNA and protein expression of Caspase-3 and Caspase-9Note: A.The expression of Caspase-3 and Caspase-9 mRNA was detected by RT-PCR;B.The expression of Caspase-3 and Caspase-9 protein was detected by Western blot;**.P<0.01 versus Control group;##.P<0.01 versus LPS group.
通过Western blot检测Caspase-3和Caspase-9的蛋白表达情况可知:与Control组相比,LPS组Caspase-3和Caspase-9的蛋白表达显著上调,说明LPS诱导急性脑损伤造模成功,并且LPS会诱导脑细胞凋亡;与LPS组相比,给药组Caspase-3和Caspase-9的蛋白表达显著下调,并且随着给药量的增加,大鼠细胞Caspase-3和Caspase-9的蛋白逐渐下调,说明盐酸小檗碱可以抑制LPS诱导的细胞凋亡,且这种抑制作用随着盐酸小檗碱素量的增加而增强(P<0.01,图2B)。
2.3盐酸小檗碱减缓脂多糖诱导的氧化应激反应 通过试剂盒检测SOD、 MDA、 GSH和LDH含量发现:与Control组相比,LPS组MDA和LDH含量显著上升,SOD和GSH含量显著下降,说明LPS诱导脑损伤造模成功;与LPS组相比,给药组MDA和LDH含量显著下降,SOD和GSH含量显著上升,并且随着给药量的增加,大鼠细胞MDA和LDH含量逐渐下降,SOD和GSH含量逐渐上升,说明盐酸小檗碱可以减缓脂多糖诱导的大鼠氧化应激反应,且这种减缓力度随着盐酸小檗碱量的增加而增强(P<0.01,图3)。

图3 氧化应激水平检测Fig.3 Oxidative stress level detectionNote: A.The SOD content is detected by the SOD kit;B.The MDA content is detected by the MDA kit;C.The GSH content is detected by the GSH kit;D.The LDH content is detected by the LDH kit;**.P<0.01 versus Control group;##.P<0.01 versus LPS group.
2.4盐酸小檗碱减缓脂多糖诱导的炎症反应 通过ELISA检测TNF-α、IL-1β、IL-6的含量发现:与Control组相比,LPS组TNF-α、IL-1β、IL-6含量显著上升,说明LPS诱导脑损伤造模成功,并且LPS诱导大鼠产生炎症反应;与LPS组相比,给药组TNF-α、IL-1β、IL-6含量显著下降,并且随着给药量的增加,大鼠细胞TNF-α、IL-1β、IL-6含量逐渐下降,说明盐酸小檗碱可以减轻脂多糖诱导的大鼠炎症反应,且这种减轻程度随着盐酸小檗碱量的增加而增强(P<0.01,图4)。
2.5盐酸小檗碱减缓脂多糖诱导的NF-κB P65和IκBa的表达 通过Western blot检测NF-κB P65和IκBa的蛋白表达情况可知:与Control组相比,LPS组NF-κB P65和IκBa的蛋白表达显著上调,说明LPS诱导急性脑损伤造模成功,并且LPS激活NF-κB;与LPS组相比,给药组NF-κB P65和IκBa的蛋白表达显著下调,并且随着给药量的增加,大鼠细胞NF-κB P65和IκBa的蛋白逐渐下调,说明盐酸小檗碱可以抑制LPS诱导的NF-κB的激活,且这种抑制作用随着盐酸小檗碱素量的增加在增强(P<0.01,图5)。

图4 ELISA检测TNF-α,IL-1β,IL-6的含量Fig.4 TNF-α,IL-1β,IL-6 levels were detected by ELISANote: **.P<0.01 versus Control group;##.P<0.01 versus LPS group.

图5 Western blot检测NF-κB P65和IκBa的蛋白表达Fig.5 Protein expression of NF-κB P65 and IκBa was detected by Western blotNote: **.P<0.01 versus Control group;##.P<0.01 versus LPS group.
3 讨论
LPS诱导脑损伤会使血脑屏障的结构不完整、通透性增加,而不完整的血脑屏障有利于LPS进一步进入脑组织造成损伤,从而形成一个恶性循环,加重脑损伤[1]。盐酸小檗碱是用于治疗胃肠炎、细菌性痢疾等肠道感染、眼结膜炎、化脓性中耳炎等疾病的常用药物[2],并已有文献报道盐酸小檗碱还具有降脂、降血糖、抗菌和抗肿瘤等多种生理作用,但是其对LPS诱导的脑损伤的作用和机制并未见报道。本研究通过HE染色和Tunel染色发现盐酸小檗碱能够使LPS诱导的损伤组织恢复正常形态,并显著减少LPS诱导的细胞凋亡率,这些结果表明盐酸小檗碱呈剂量依赖性减轻LPS诱导的脑组织病理损伤。
脑损伤会导致脑细胞的凋亡,抑制脑细胞的凋亡可达到保护脑免受损伤的目的。如,Chien等[12]研究发现丹参酚酸A通过抑制小鼠炎症和细胞凋亡,促进神经发生,减轻缺血性脑损伤。盐酸小檗碱对细胞的凋亡的作用各不相同:Wang等[13]通过研究发现盐酸小檗碱能够抑制人鼻咽癌CNE-1细胞增殖和迁移,并诱导CNE-1细胞凋亡 ;Li等[14]通过研究发现盐酸小檗碱能够抑制非小细胞肺癌细胞的增殖并促进细胞凋亡;Choi等[15]研究发现盐酸小檗碱能够通过抑制细胞内ROS的积累来减弱H2O2诱导的细胞C2C12的细胞凋亡。本文研究发现盐酸小檗碱呈剂量依赖性减少LPS诱导大鼠的细胞凋亡率和Caspase-3、Caspase-9的表达量,这说明盐酸小檗碱呈剂量依赖性抑制LPS诱导的细胞凋亡。
脑组织对氧化应激反应非常敏感,抑制机体的氧化应激反应有助于保护脑组织。如,Zhang等[16]研究发现苦柯胺A通过抑制氧化应激对辐射诱导的大鼠脑损伤的神经起保护作用。已有Choi等[15]报道盐酸小檗碱通过诱导nrf-2介导的HO-1表达来保护成肌细胞免受氧化应激诱导的损伤。因此,盐酸小檗碱有望抑制LPS诱导的氧化应激。本研究发现盐酸小檗碱呈剂量依赖性降低LPS诱导的MDA和LDH含量,并升高LPS诱导的SOD和GSH含量,这说明盐酸小檗碱呈剂量依赖性减缓LPS诱导的大鼠氧化应激反应。
炎症是脑损伤病理生理过程中一个重要的组成环节,抑制炎症有助于保护脑组织免受损伤。如,Tian等[17]通过研究发现富氢水可减轻大鼠创伤性脑损伤后的炎症缓解脑损伤。盐酸小檗碱能够显著抑制炎症:Wang等[18]研究发现盐酸小檗碱可显著减轻中性粒细胞浸润,并在一定范围内剂量依赖性地降低TNF-α、IL-1β和IL-6的分泌。因此,盐酸小檗碱有望抑制LPS诱导的炎症反应。本研究发现盐酸小檗碱呈剂量依赖性降低TNF-α、IL-1β、IL-6含量,这说明盐酸小檗碱呈剂量依赖性抑制LPS诱导的大鼠炎症。
盐酸小檗碱能够显著抑制NF-κB P65和IκBa的表达:Zhang等[3]通过研究发现盐酸小檗碱抑制腹部手术后TAK1/JNK和TAK1/NF-κB信号传导来减轻炎症。因此,盐酸小檗碱有望抑制LPS诱导的NF-κB的激活。本研究发现盐酸小檗碱呈剂量依赖性下调NF-κB P65和IκBa的蛋白表达,说明盐酸小檗碱呈剂量依赖性抑制LPS诱导的NF-κB的激活。
综上所述,盐酸小檗碱呈剂量依赖性减轻LPS诱导的脑组织病理损伤,并抑制LPS诱导的细胞凋亡、氧化应激反应、炎症和NF-κB的激活,从而抑制LPS诱导的脑损伤。这为盐酸小檗碱开发利用提供新数据,为脑损伤预防治疗奠定基础。
