小鼠小肠不同部位细胞中的胰岛素分泌水平
2019-10-17周翰驰陈皓张瑞郭刚
周翰驰,陈皓,张瑞,郭刚
(天津医科大学代谢病医院内分泌研究所,卫生部激素与发育重点实验室,天津300070)
II型糖尿病是世界范围内的主要公共卫生问题。对370个国家的270万人进行的多国健康调查分析表明,从1980-2008年,全世界II型糖尿病的患病率翻了一番[1-2]。这种趋势将持续到2025年,并给每个国家的医疗保健系统带来沉重的财政负担[3-4]。其病理生理学不仅涉及胰腺,还涉及到肝脏、骨骼肌、脂肪组织、胃肠道、脑和肾脏[5]。国际糖尿病联合会的报告指出,到2040年,预计全球将有超过6 000万人患有糖尿病。2007年,美国用于诊断和治疗糖尿病的花费达到1 740亿美元[6]。
以往的观点认为,胰岛素由胰腺分泌,胰腺中主要的分泌细胞有α细胞和β细胞两种,前者主要分泌胰高血糖素,后者主要分泌胰岛素。近年来随着研究的进一步深入,人们发现在2型糖尿病的致病因素中,β细胞去分化也占有一定的比例,并且在一定情况下去分化的β细胞会分化为α细胞,进一步的破坏血糖平衡[7];在这一过程中,PDX1扮演着重要的角色。胰腺十二指肠同源框-1蛋白(PDX1)是存在于胰腺β细胞中的含282个氨基酸的同源结构域转录因子。PDX-1是β细胞中胰岛发育和胰岛素基因转录的关键调节剂,可以加强β细胞活性,减少β细胞凋亡,并且防止其去分化。PDX-1在发育早期的所有细胞中均有表达,成年后主要限于胰腺和十二指肠。此外,还有研究指出经PDX-1处理的小肠上皮细胞(IEC-6)可以分化成为合成胰岛素的细胞[8]。
有诸多研究表明胰腺外存在胰岛素或胰岛素类似物。有文章指出,通过RT-PCR和免疫组化实验,在胎鼠和乳鼠的大脑、肝脏、视网膜等组织中发现了前胰岛素原和胰岛素类似物[9]。中枢神经系统中,也已经有研究证实下丘脑有胰岛素分泌[10]。在STZ小鼠肝脏、脂肪、骨髓等组织中也发现了胰岛素mRNA[11]。
在胚胎发育阶段,胰岛内分泌细胞和小肠上皮细胞有着共同的起源,这意味着小肠中可能有某些细胞具有分泌胰岛素的潜能。小肠可以分泌包括胰高血糖素在内的多种胰肽,但是一直以来少有证据能够证明小肠可以合成胰岛素。在我们的前期研究中发现,小肠含有胰腺细胞特异性的识别蛋白,该蛋白质为胰岛细胞抗原512(ICA512)。ICA512是一种受体型PTP样蛋白,含有跨膜区,细胞内PTP样结构域和一个胞外N端,定位于分泌颗粒,ICA-512仅在胰岛细胞中表达并且参与调节分泌颗粒的胞吐作用。本研究选用未经处理的C57BL/6J小鼠,针对小肠不同部位,从基因和蛋白等水平来证明有胰岛素在小肠的细胞中合成。
1 材料与方法
1.1 动物材料 所有的实验用小鼠均购自北京华宝生物科技有限公司。小鼠在无特殊病原菌的动物房喂养,室温为恒温23℃。适应1周后,选取健康的雄性C57BL/6J小鼠(n=5)通过腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,然后处死,剪取十二指肠、空肠、回肠、胰腺。所有动物实验得到动物伦理和实验部门的批准,且按照天津医科大学委员会的要求进行。
1.2 免疫荧光检测 将动物组织用石蜡包埋,制成切片,二甲苯脱蜡,100%~70%浓度梯度乙醇脱水,Tris-EDTA溶液抗原修复,室温下Tirton处理15min,经PBS漂洗后,用牛奶封闭,分别用胰岛素抗体、PDX1抗体、ICA-512抗体4℃孵育过夜,PBS漂洗后,分别用FITC标记的山羊抗小鼠二抗和TRITC标记的山羊抗兔二抗孵育,室温1 h,用DAPI将细胞核染色,封片。在荧光显微镜下检测。
所用试剂如下:胰岛素抗体(1:1 000,ab6995,abcam,UK),PDX1抗体(1:2 000,ab47267,abcam,UK),ICA-512抗体(1:500,sc-130570,santa cruz,USA),FITC标记的抗小鼠二抗 (1:200,ZF-0312,ZSGB,Beijing,China),TRITC 标记的抗兔二抗(1:200,ZF-0316,ZSGB,Beijing,China)。
1.3 电子扫描显微镜检测 剪取一小段组织放入2.5%戊二醛固定液中,经PBS漂洗后用1%锇酸缓冲液固定,用浓度50%~100%浓度梯度的丙酮脱水,再用spurr包埋剂进行包埋,待包埋完成后,切片在电子扫描显微镜下观察。
1.4 实时定量聚合酶链式反应(RT-PCR) 用TRIzol(9108,TaKaRa,Biotech,Japan)裂解小鼠组织,加入氯仿,4℃离心,13000r/min,取上清液,加等体积异丙醇,4℃离心,沉淀加75%乙醇,漂洗离心,13000r/min,干燥后,加入20 μL DEPC水,即为组织RNA。逆转录获得 cDNA(AT301-03,TransGen Biotech,Beijing,China)。RT-PCR(AQ131-04,TransGenBiotech,Beijing,China)检测内参β-actin以及胰岛素mRNA的表达量。
胰岛素引物序列:上游 5′-CTGGTGGG CATCCAGTAACC-3′,下游 5′-ACACACCAGGTAGAGAGCCT-3′,产物长度 209bp。
β-actin引物序列:上游 5′-CATTGCTGA CAGGATGCAGAAGG-3′,下游 5′-TGCTGGAAGGTGGACAGTGAGG-3′,产物长度 138bp。
扩增条件:95℃预变性1 min,然后依次为94℃变性10 s,58℃退火15 s,72℃延伸20 s,共40个循环。每次PCR反应至少重复3次。
1.5 Western印迹分析 组织用RIPA和蛋白酶抑制剂PMSF分解,按组织:RIPA:PMSF=20mg:100μL:1 μL的比例提取蛋白质,通过聚丙烯酰氨凝胶电泳(SDS-PAGE)之后,将蛋白转移至硝酸纤维素膜(Nitrocellulose Blotting Membranes,NC)上,用 5%的脱脂奶粉在室温下封闭2 h,用胰岛素抗体4℃孵育过夜,PBST漂洗后,与HRP标记的抗兔二抗结合,室温1 h,PBST漂洗后,用ECL印迹检测使蛋白条带可视化,检测其表达量。
所用试剂如下:胰岛素抗体(1∶2 000,15848-1-AP,proteintech),GAPDH 抗体 (1∶5 000,AP0066,Bioworld Technology,Inc.,USA),辣根过氧化物酶抗兔二抗(1∶2 000,BS13278,Bioworld Technology,Inc.,USA),ECL 印迹检测试剂(WBKLS0500,Millipore Corporation)。
2 结果
2.1 形态学检测发现小肠表达胰岛素 将小肠按照十二指肠、空肠、回肠分成3组,以胰腺作为阳性对照,分别检测其胰岛素及PDX1的表达。结果显示胰岛素及PDX1在部分细胞中同时存在(图1A),十二指肠表达量略少于空肠和回肠,空肠和回肠表达量没有显著差异。同时笔者还发现在小肠中存在少量的 ICA-512(图 1B)。
电子扫描显微镜观察的结果显示,在十二指肠(图 2A),空肠(图 2B),回肠(图 2C)中都存在类似胰岛素的分泌颗粒,表达量上并无明显差异。
形态学的结果表明,小肠中的胰岛素存在于细胞内部,众所周知,胰岛素是作用在细胞表面胰岛素受体的一种蛋白质,胰岛素本身在完成生理作用的过程中不会进入细胞,所以可以认为,笔者检测到的胰岛素是由小肠细胞自身合成的,并非由胰岛β细胞合成再经血液转运而来。

图1 免疫荧光检测小肠中的胰岛素Fig 1 Immunofluorescence detection of insulin in the small intestine
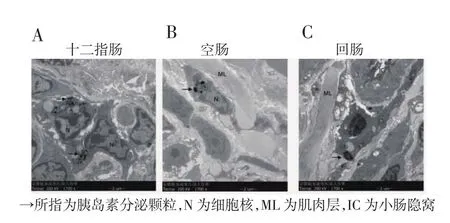
图2 电镜检测小肠中的胰岛素分泌颗粒Fig 2 Electron microscopy of insulin secretion granules in the small intestine
2.2 RT-PCR及western检测小肠胰岛素阳性 用β-actin为内参,RT-PCR检测十二指肠、空肠、回肠和胰腺中胰岛素mRNA的相对表达量(图3A)。空肠与十二指肠和回肠的胰岛素相对表达量的差异具有统计学意义(P<0.05),小肠组织与胰腺之间差异更为明显(P<0.01)。通过Western blot对小肠中胰岛素表达量的检测得到了和RT-PCR相一致的结果(图3B),同样选取β-actin作为内参,图中显示的是胰岛素在各个部位的相对表达量,其中空肠与十二指肠和回肠的表达量具有明显差异(P<0.05)。和RT-PCR结果一致,小肠中空肠的胰岛素表达量最高,十二指肠和回肠表达量没有显著差别。取样时小鼠空腹 8h,血糖水平为 7.3mol/L,8.5mol/L,5.8mol/L。

图3 RT-PCR及WB分析小肠中胰岛素mRNA和蛋白质的相对表达量Fig 3 RT-PCR and WB analysis of relative expressions of insulin mRNA and protein in the small intestine
3 讨论
I型糖尿病致病原因是胰岛β细胞功能损坏,II型糖尿病的病因除β细胞功能损害外还有胰岛素抵抗等等。目前治疗糖尿病的手段主要有口服降糖药物、胰岛素注射、胰岛素泵等,无论哪种治疗方法都需要长期用药,不但对患者身心有所危害也对患者经济条件有一定挑战。笔者急需找到新的治疗方法来解决日趋严峻的糖尿病防治问题。目前,胰岛细胞移植疗法和干细胞培育疗法获得了一定的关注,但术后的免疫排斥反应以及细胞来源的缺乏造成了很大阻碍。本研究证明小肠具有生物合成胰岛素的功能,可能为未来糖尿病的防治提供一个新的思路。
长久以来,有许多研究和报道显示,体内存在非胰腺胰岛素或称胰外胰岛素。在小肠中发现了有前胰岛素原和胰岛素mRNA存在[9,12]。短期禁食会促使小鼠的下丘脑表达胰岛素[10]。在糖尿病小鼠的肝脏、脂肪、脾脏、骨髓及胸腺中发现了胰岛素原的mRNA和蛋白质[11]。笔者可以看到在糖尿病或禁食等非正常状态下,机体很多组织都具有一定的表达胰岛素的能力。而在正常的健康状态下,仅有小肠检测出了胰岛素基因转录阳性。这说明在正常的身体能量代谢过程中,小肠胰岛素参与了某些调控能量代谢的过程。此外,我们的前期研究发现,将8周龄Wister大鼠禁食24 h,分别灌胃50%葡萄糖溶液、牛血清白蛋白溶液、油脂悬液,结果显示小肠部分存在动态变化的胰岛素mRNA,且与胰腺表达高峰时间不同[13]。
在探索小肠是否能成为潜在的胰岛素分泌的器官时,一种蛋白质GLP-1引起了极大的注意。GLP-1是一种胰高血糖素基因编码的由回肠L细胞分泌的肠促激素,其在体内的主要活性形式为GLP-17-37和GLP-17-36,主要作用在胰岛β细胞,具有防止β细胞凋亡,促进胰岛素分泌等作用[14-15]。GLP-11-37在体内的作用尚不明确,但研究发现其可以诱导小肠上皮细胞分泌胰岛素[16],还可以增加小鼠的葡萄糖耐受性[17]。有团队进一步证明,GLP-1可以诱导大鼠小肠隐窝上皮细胞(IEC-6)表达胰岛素,此外,给大鼠口服可以表达GLP-11-37的工程菌制片,可以有效增加大鼠的糖耐量[18]。
小肠胰岛素的作用虽然尚不明确,但我们根据现有文献资料猜测其可能具有以下两种功能:一是小肠胰岛素的分泌受葡萄糖含量的影响,同时回肠L细胞分泌GLP-1的过程受到胰岛素含量和血糖水平的调控[14-15],小肠胰岛素可以通过旁分泌或自分泌结合血糖水平来调节GLP-1的表达,进一步影响胰岛β细胞生成胰岛素。二是小肠胰岛素可能具有调节局部血糖的作用,尤其在进食后及肠道吸收葡萄糖的过程中,通过小肠分泌的胰岛素,防止由于集中吸收葡萄糖而使血糖快速上升造成危害。
