基于TCGA数据库分析甲基化促进精原细胞瘤进程的作用机制
2019-10-17陈赛鹏王嘉南彭华红肖龙飞
陈赛鹏,王嘉南,王 林,彭华红,肖龙飞,杨 阔
(天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津300211)
睾丸生殖细胞瘤(Testieular Germ Cell Tumor,TGCTs)占睾丸原发性恶性肿瘤的90%以上,是15~35岁男性最常见的实体瘤[1]。临床上将TGCT分为精原细胞瘤和非精原细胞瘤两大类,后者可细分为胚胎细胞癌、绒毛膜癌、卵黄囊瘤和畸胎瘤[2]。American Joint Committee on Cancer(AJCC)根据精原细胞瘤的增殖和转移的程度分为精原细胞瘤Ⅰ期、Ⅱ期和Ⅲ期。Ⅰ期精原细胞瘤术后通过密切随访,药物辅助化疗和辅助放疗可以完全治愈[3]。然而,Ⅱ期、Ⅲ期的术后的存活率较低,术后一般以放疗和化疗为主[4]。目前精原细胞瘤的组学研究进展尚不完善,因此,探索精原细胞瘤的基因表达谱对了解原始生殖细胞与肿瘤形成的关系是非常重要的。DNA甲基化是一种重要的表观遗传修饰,它可以在不改变DNA序列的情况下改变基因组的表达。DNA甲基化的主要机制是将甲基(CH3)与CG二核苷酸的细胞因子结合,从而改变染色质结构、DNA构象、DNA稳定性,以及诱导DNA与蛋白质相互作用以控制基因表达的方式[5]。许多研究表明,DNA甲基化在肿瘤的发生发展过程中起着至关重要的作用,主要表现为DNA甲基化模式和DNA甲基转移酶表达水平的改变[6]。然而,到目前为止还没有系统的分析甲基化在精原细胞瘤进展中的作用。TCGA(The Cancer Genome Atlas)中有156例精原细胞瘤的450K甲基化数据和156例精原细胞瘤的RNA seq数据。因此笔者将TCGA甲基化芯片数据与RNA seq数据进行整合,分析甲基化调控的基因表达在精原细胞瘤恶性进展过程中发挥作用。
1 资料与方法
1.1 差异基因的筛选 从TCGA数据库中下载106例精原细胞瘤Ⅱ期、Ⅲ期和26例Ⅰ期样本的转录组测序数据,使用GDCRNAtools R软件包进行差异基因分析,并取fold change为2,FDR为0.05作为筛选阈值,并将筛选的差异基因进行KEGG信号通路分析。
1.2 甲基化差异位点的筛选 在分析甲基化数据时,使用ELMER R软件包来进行甲基化差异位点分析。ELMER R包参数设定
createMAE函数:linearize.exP=TRUE
get.diff.meth函数:minSubgroupFrac=1,sig.dif=0.2,cores=1,pvalue=0.05,mode="supervised"
GetNearGenes函数:numFlankingGenes=20
get.pair函数:minSubgroupFrac=1,raw.pvalue=0.05,filter.probe=FALSE,cores=1,mode="supervised",Pe=0.05
enriched.motif.hyper函 数 :min.incidence=10,lower.OR=1.1
其他参数保持默认。对TCGA数据库中的156例精原细胞瘤标本的450K甲基化数据进行差异表达分析,每个芯片有485 577个甲基化检测位点,获取Ⅱ期、Ⅲ期和Ⅰ期的差异甲基化位点,然后将关联差异甲基化位点的前后20个基因作为可能受甲基化调控的基因。
1.3 差异甲基化位点的差异基因配对分析 将获得差异甲基化位点的关联基因与Ⅱ期、Ⅲ期和Ⅰ期的差异基因取交集,找出差异甲基化位点周围有显著表达差异的基因,并将基因表达量与甲基化位点的甲基化水平进行相关性分析。
1.4 差异基因的生存曲线分析 将差异甲基化位点-差异基因配对进行生存分析,寻找显著影响精原细胞瘤患者的生存情况的受甲基化调节的差异基因。
2 结果
2.1 通过差异基因分析,笔者找到了864个差异基因,其中上调基因有410个,下调基因有456个,差异表达火山图如图1A所示,差异基因类型的分布如图1B所示。

图1 精原细胞瘤差异基因的筛选及分类Fig 1 Screening and classification of differential genes in seminoma
2.2 将甲基化数据进行差异甲基化位点的分析,显示Ⅱ期、Ⅲ期精原细胞瘤的平均甲基化水平高于Ⅰ期,如图2。笔者对Ⅱ期、Ⅲ期精原细胞瘤与Ⅰ期精原细胞瘤之间的差异甲基化位点进行了分析,显示162个在Ⅱ期、Ⅲ期精原细胞瘤中甲基化水平升高的位点。

图2 Ⅱ期Ⅲ期和Ⅰ期的差异甲基化水平分析Fig 2 Analysisofdifferential methylation levels ofstageⅡ & Ⅲ and stageⅠ
2.3 将筛选出来的差异甲基化位点与前后最近的20个基因进行关联,并且将这些基因与差异表达基因取交集,找出表达水平受甲基化调节的基因,得到22个差异甲基化位点-差异表达基因配对。对配对的甲基化水平和基因表达水平进行了Pearson相关分析,最终得到了差异基因的表达与甲基化水平存在负相关的基因KCNC1,具有较强的相关性,结果如图3。
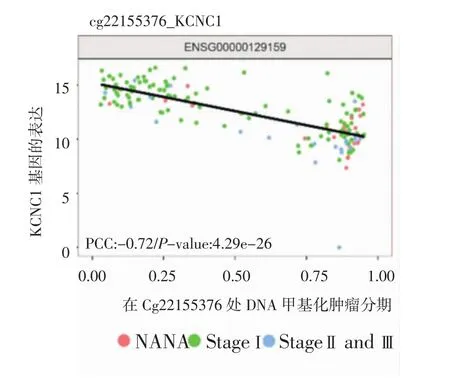
图3 高甲基化与KCNC1表达的关系分析Fig 3 Analysis of the relationship between hypermethylation and the expression of KCNC1
2.4 GEPIA在线工具(http://gepia.cancer-pku.cn)对22个差异甲基化位点-差异表达基因配对的基因进行了生存分析,发现KCNC1对精原细胞瘤患者的生存期有显著影响,高甲基化与KCNC1的低表达相关,并且KCNC1的低表达与更差的预后有关。笔者比较了KCNC1在精原细胞瘤和正常睾丸组织之间的差异,结果显示精原细胞瘤中的KCNC1表达量较低,在正常睾丸组织以及Ⅰ期和Ⅱ期、Ⅲ期精原细胞瘤中的表达呈递减趋势,如图4。

图4 KCNC1在所有肿瘤和正常组织中的表达及在精原细胞瘤中的无进展生存期分析Fig 4 Expressions of KCNC1 in all tumors and normal tissues and disease-free survival in seminoma
3 讨论
目前,对于精原细胞瘤的实验研究进展不是很完善,最近的全基因组关联研究 (GWAS)发现KITLG、SPRY4、T1、TERT、ATF7IP 与睾丸生殖细胞瘤的易感性相关[7-12]。对于精原细胞瘤的基因组学的研究也在逐渐开展。
DNA甲基化是一种重要的表观遗传修饰,在肿瘤的发生发展过程中起着至关重要的作用,然而不同基因中肿瘤特异性甲基化的改变被证明具有不同的生物学效应。一些研究表明,低甲基化通过激活不同肿瘤中的致癌基因而促进肿瘤的发生[13]。也有证据表明,高甲基化可以抑制肿瘤抑癌基因的表达,从而促进肿瘤的进展。例如,在视网膜母细胞瘤中高甲基化可以使肿瘤抑制基因Rb的表达相比无甲基化减少到 8%[6,13]。
本文通过生物信息学技术,分析筛选了TCGA上传的精原细胞瘤患者的转录组测序数据,确定了22个差异基因在Ⅱ期Ⅲ期精原细胞瘤中表达随着甲基化的程度降低,因此考虑高甲基化在精原细胞瘤中通过抑制了这些基因的表达,进而促进了精原细胞瘤的进展。通过分析差异基因的生存曲线,发现高甲基化导致基因KCNC1低表达的精原细胞瘤患者生存期短,有统计学差异。随着精准医疗的推广,精原细胞瘤的治疗不仅仅局限于手术治疗,通过基因的靶向药物治疗,可以抑制精原细胞瘤的进展,从而改善患者的预后。
KCNC1这个基因编码了一个完整膜蛋白家族,该家族可介导兴奋膜的电压依赖性钾离子渗透性[14]。K+通道是质膜中种类最丰富的离子通道,广泛分布于包括癌细胞在内的各种细胞中。能与生化信号级联进行串扰,通过调节细胞内K浓度、产生膜电位、介导细胞体积变化、参与Ca信号传递、与膜受体和下游效应子在分子复合物内直接相互作用等方式,几乎调控所有细胞过程。在肿瘤细胞表现出K通道的异常表达和活性模式通常通过影响Ca激活的IK或者BK通道,进而驱动肿瘤细胞的肿瘤转化、恶性进展、转移或耐药[15-16]。也有研究表明,K+通道在乳腺癌中影响肿瘤细胞增殖和细胞周期进展[17]。K+通道在精原细胞瘤中缺乏研究,在精原细胞瘤中发挥的作用也不清楚,本文通过筛选得到KCNC1基因,高甲基化会降低KCNC1的表达并且促进了精原细胞瘤的进展。已有的研究表明KCNC1能介导兴奋膜的电压依赖性钾离子渗透性,促进K+通道的激活,抑制精原细胞瘤的进展。
