毕赤酵母外源蛋白分泌途径的研究进展
2019-10-12黄志强张建国
刘 冰,黄志强,郑 潇,张建国
(上海理工大学 医疗器械与食品学院 食品科学与工程研究所,上海 200093)
随着现代分子生物学的飞速发展,利用工业微生物作为表达系统获得重组蛋白已经成为研究蛋白质结构和功能、制备抗体、疫苗、工业用酶及药用蛋白的重要途径[1]。目前研究比较深入的重组蛋白表达系统有大肠埃希菌表达系统、枯草芽胞杆菌表达系统、链霉菌表达系统、毕赤酵母表达系统、酿酒酵母表达系统、昆虫表达系统、哺乳动物表达系统和植物表达系统等[2],其中毕赤酵母(Komagataellaphaffii)是一种应用较为广泛的真核表达系统,目前已成功表达1 000多种外源蛋白[3],其中70多种外源蛋白已经商业化生产。外源蛋白表达量高是毕赤酵母表达系统的特点之一,羟基腈裂解酶在毕赤酵母胞内表达可达22 g/L[4],胶原蛋白利用毕赤酵母分泌表达可达15 g/L[5]。毕赤酵母的人源化改造消除了重组蛋白的免疫原性[6]。但毕赤酵母表达不同外源蛋白的表达量差异较大[7],所以,阐明外源蛋白分泌途径的相关基因和蛋白质及其功能将为改造外源蛋白分泌途径,提高外源蛋白产量奠定基础[8]。近年来,毕赤酵母基因组序列的公布,转录组学和蛋白质组学分析技术的发展,使得阐明外源蛋白分泌过程中相关基因和蛋白质成为可能。利用GeneBank数据库、KEGG生物信息数据库以及两个基因组(酵母菌属基因组数据库Saccharomycesgenome database,SGD[9]和酵母的ORCAE系统[10])对蛋白分泌过程进行分析,总结了毕赤酵母分泌外源蛋白途径中涉及的基因和蛋白质,阐明一个较为完整的外源蛋白分泌途径。为从分子水平寻找外源蛋白调控的新靶点,提高外源蛋白表达量提供参考。
1 概 述
目前研究相对较深入的蛋白质分泌途径有Sec分泌途径、双精氨酸途径(Tat)和信号识别颗粒转运途径。毕赤酵母表达系统将蛋白质分泌到胞外主要依靠信号识别颗粒介导转运的经典途径,又称为内质网-高尔基体(ER-Golgi)蛋白分泌途径(图1)。这个途径中目的基因转录成mRNA后,在细胞质中核糖体上合成新生肽链;再通过内质网膜上的蛋白通道转运至内质网腔中进行折叠和修饰;然后被运送到高尔基体中进一步加工修饰,形成特定结构并具有功能的蛋白质;最后通过高尔基体的分泌小泡与质膜融合的方式将蛋白质分泌到细胞外[11]。
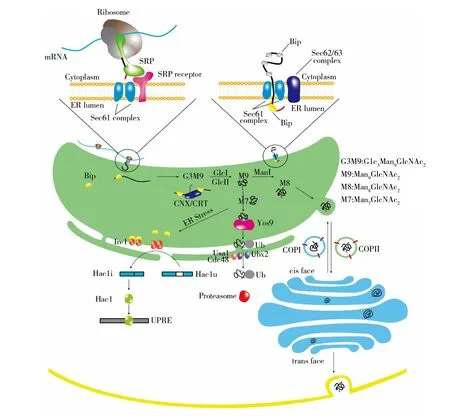
图1 毕赤酵母的蛋白质分泌途径Fig.1 Secretory pathway of protein from K. phaffii
2 新生肽链跨膜靶向内质网
根据mRNA翻译与新生肽链跨膜过程是否同时发生将新生肽链跨膜靶向内质网腔的过程分为“翻译共转运”和“翻译后转运”两种方式[12]。
2.1 翻译共转运(Co-translational translocation)
新生肽链边合成边转入内质网腔的方式称为翻译共转运。当新生肽链的N端信号肽(Signal peptide,SP)刚在核糖体中合成,即形成核糖体新生肽链复合物(Ribosome-nascent chain complex,RNC),随即信号识别颗粒(Signal recognition particle,SRP)通过疏水相互作用与N端信号肽结合[13-14],导致新生肽链在核糖体的翻译过程暂停;随后信号识别颗粒牵引着核糖体新生肽链复合物与内质网上的信号识别颗粒受体(SRP receptor,SR)结合,然后翻译过程又重新启动,同时信号识别颗粒被释放到细胞质中,重新结合其他新合成的信号肽,进行新一轮的转运[15]。内质网上存在一个由Sec61复合体和膜蛋白组成的疏水跨膜通道[16],新生肽链被信号肽牵引着由此通道进入内质网腔[17]。接着信号肽被膜内的信号肽酶及其他蛋白酶降解,而新生肽链则继续延伸直至翻译完毕。
2.1.1 信号肽 信号肽是新生肽链中一段特殊的氨基酸链,由10~40个氨基酸残基组成,可引导蛋白跨膜或分泌到胞外。信号肽大多位于新生肽链的N端,偶尔也有位于新生肽链的中部。不同蛋白质的信号肽序列各不相同,但它们的结构域可分为亲水区、疏水区、加工区。亲水区一般位于新生肽链中富含碱性氨基酸的N端。它提供正电荷,可与信号识别颗粒中带负电的酸性氨基酸残基形成静电相互作用,带电荷区域还在新生肽段转移过程中起重要作用[18]。疏水区一般为8~12个疏水性氨基酸残基组成的α螺旋结构[19],也是SRP和新生肽链相互识别和结合的关键区域。酵母SRP有 SRP9、SRP14、SRP19、SRP54、SRP68、SRP72等亚基和一个7S RNA。SRP54亚基的C段(M结构域)和疏水区结合[20]。加工区是C末端一段富含负电荷、小分子氨基酸残基的氨基酸链,也是信号肽酶切割的部位[21]。在新生肽链中,除N端有信号肽外,C端部分肽段也对肽链穿越粗面内质网膜起作用。例如C端肽段能终止肽链穿越,因此该部分肽段被称为终止转运序列,在某种意义上也是一种信号肽[7]。迄今为止,在毕赤酵母中成功实现外源蛋白分泌表达的信号肽主要有酿酒酵母α交配因子前导肽(Mating factor,α-MF)、酿酒酵母蔗糖转化酶信号肽(Sucrase2,SUC2)、毕赤酵母酸性磷酸酶信号肽(Phosphatase1,PHO1)、外源蛋白自身信号肽[22]。目前毕赤酵母分泌表达的诸多外源蛋白报道中,α-MF、SUC2、PHO1作为信号肽的分泌蛋白最高产量分别为 22.0 g/L 羟基腈裂解酶[4]、2.5 g/L 淀粉酶[23]、2.3 g/L 过氧化氢酶[24]。以脂肪酶自身信号肽(nSB)在毕赤酵母中分泌表达脂肪酶的产量为 383 U/mL[25]。α-MF分泌最高的外源蛋白产量可能与α-MF引导外源蛋白至高尔基体或小囊泡的效率,或者与蛋白质折叠和二硫键形成有关[26]。
2.1.2 SRP及其受体 1980年Walter等[27]首次分离得到SRP后证实其为核糖核酸蛋白复合物。敲除SRP的组成部分不会抑制新生肽链的合成,但是阻碍了新生肽链在内质网膜上的组装[28]。这说明SRP的功能为引导多肽至内质网膜。SRP在细菌、古菌、真核生物的细胞质中都存在[29]。细菌SRP由1条SRP RNA(4.5S RNA)和1条多肽链(SRP54)组成;古菌SRP由1条SRP RNA(7S RNA)和两条多肽链(SRP19和SRP54)组成;真核生物(哺乳动物和酵母)SRP都是由1条SRP RNA(7SL RNA或7S RNA)和6条分子质量分别为9、14、19、54、68和72 kDa的多肽链(SRP9、SRP14、SRP19、SRP54、SRP68和SRP72)组成。哺乳动物的SRP54是1条约含500个氨基酸残基的多肽链。这条多肽链由3个结构域组成:N端的N结构域,含GTP结合位点的G结构域,C端富含甲硫氨酸的M结构域[30]。M结构域可以形成一个疏水沟槽,通过槽底部的结构与信号肽序列结合[31]。SRP的RNA调节SRP与核糖体以及与SR的结合,并为SRP亚基组装充当骨架[32]。哺乳动物SR是位于内质网膜上的二聚体,由1条α链(α-SR)和1条β(β-SR)链组成。α-SR含有N结构域和G结构域。α-SR的G结构域与GTP结合,且N、G结构域与SRP54的N、G结构域结合。β-SR主要负责SRP与内质网的结合并转运新生肽链[33]。SRP与SR的N结构域通过静电相互作用而识别。GTP水解导致SRP与SR解离。目前在多种酵母菌,例如酿酒酵母[34]、粟酒裂殖酵母[35]、解脂耶氏酵母[36]中都已鉴定出SRP54。但是假丝酵母属、多形汉逊酵母、毕赤酵母中都还没有鉴定出SRP54[37]。
2.1.3 跨膜通道 新生肽链利用内质网的疏水跨膜通道进入内质网腔。疏水跨膜通道由Sec61复合体和转运相关蛋白(Translocon associated protein,TRAP)组成[16]。Sec61复合体的3个亚基(α、β、γ)形成一个疏水通道。TRAP是一个含有4个跨膜亚基的信号肽受体蛋白。TRAP与信号肽的相互作用调控转运通道[17]。TRAP还可以与错误折叠的新生肽链结合,将错误折叠的新生肽链从内质网逆向运输至细胞质中降解[38]。疏水作用在信号肽引导新生肽链进入内质网腔,信号肽和信号识别颗粒的结合,以及新生肽链穿过内质网疏水通道三个环节中都发挥重要作用[39]。信号肽疏水区有利于新生多肽的分泌。Zhang等[40]将信号肽突变为更加疏水的序列提高了胰蛋白酶的分泌量。信号肽序列和新生多肽之间的识别并没有严格的专一性[41],所以通过设计信号肽,增强疏水性也是一种提高新生多肽分泌效率的途径。
2.2 翻译后转运(Post-translational translocation)
新生肽链在细胞质中核糖体上合成完毕后,再进行跨膜转运的方式称为翻译后转运。酵母菌SRP和SR的基因突变不会造成细胞死亡,说明酵母菌还存在另外的蛋白质分泌途径。毕赤酵母表达外源蛋白也能以“翻译后转运”的方式分泌[22]。采用翻译后转运的方式是由于信号肽的疏水性较弱而逃脱了SRP的识别[42]。新生肽链翻译后,被分子伴侣(Molecular chaperone)识别后形成一定的非折叠或松散折叠的中间构象,再由信号肽牵引至内质网的疏水跨膜通道进入内质网腔[43]。内质网腔中ATP偶联的结合蛋白(binding protein,Bip)利用ATP水解提供的能量与新生肽链结合。信号肽在新生肽链进入内质网腔过程中被信号肽酶切掉。Ssa1~Ssa4(属于Hsp70家族)是毕赤酵母中4个高度同源的分子伴侣。其功能相当于大肠埃希菌的Dnak。Ssa的缺失导致新生肽链不能进入内质网而在细胞质中积累。毕赤酵母的另一种分子伴侣Ydj1(属于Hsp40家族)相当于大肠埃希菌的Dnaj。Ydj1和Ssa的协同作用促进新生肽链在细胞质中保持正确的状态,有利于顺利进入内质网进行折叠[43]。分子伴侣维持新生多肽的构象,避免新生多肽的疏水基团相互靠近形成聚体而被降解,提高了折叠效率和跨膜转运效率。所以过表达分子伴侣可促进蛋白质的分泌[42]。
3 内质网中折叠与修饰
内质网的主要功能是对多肽链进行折叠与修饰,如二硫键(Disulfide bond)的形成、糖基化(Glycosylation)、羟基化(Hydroxylation)、酰基化(Acylation)。这些修饰对于新生肽链形成正确的构象非常关键。
内质网中帮助新生肽链折叠的蛋白质有两类。一类是分子伴侣;另一类是催化新生肽链折叠的折叠酶。已知的折叠酶有催化异构反应的蛋白二硫键异构酶(Protein disulfide isomerase,PDI)、肽基脯氨酰顺反异构酶(PPI)两种[44]。而PDI不仅是糖蛋白成熟过程的折叠酶,同时也起分子伴侣的作用[42]。新生肽链在折叠酶的作用下与Bip和钙联蛋白(Calnexin/calreticulin)结合而折叠成正确构象[42]。目前已经证实在内质网腔中与新生肽链的疏水区域结合,而促进分泌效率的分子伴侣有Bip、PDI、Sec63、Ydj1、Ssa1等[21]。Li等[45]共表达Bip将皱褶假丝酵母脂肪酶提高了1.18倍。Sha等[46]通过共表达PDI将脂肪酶的产量提高了2.74倍。Kar2p、Ssa1p、PDI将粒细胞-集落刺激因子(G-CSF)的表达量提高4~7倍。而且伴侣蛋白的组合对外源蛋白表达量的提高有协同作用,共表达YDJ1p/PDI、YDJ1p/Sec63、Kar2p/PDI 将G-CSF 的表达量分别提高8.7、7.6、6.5倍[47]。毕赤酵母对新生肽链的修饰还有去除起始甲硫氨酸、N-乙酰化、C-甲基化、和豆蔻酰化等。这些修饰有利于避免外源蛋白的免疫原性,也对膜蛋白的表达有帮助[48]。
糖基化也是毕赤酵母对新生肽链常见的修饰方式。糖基化伴随着多肽链的合成同时进行。根据糖与氨基酸残基的连接类型分为O-糖基化和N-糖基化。O-糖基化由O-糖基化转移酶(PMT)催化将糖连接到丝氨酸(Ser)、苏氨酸(Thr)的羟基上。PMT是一种以二聚体形式发挥作用的跨膜蛋白。毕赤酵母有5个pmt基因。PMT利用磷酸醇介导将1个甘露糖转移到苏氨酸、丝氨酸等残基上。甘露糖转移酶进一步在甘露糖上增加4个以上的甘露糖分子,最终形成Man-α、1-2(1-4)-Ser/Thr型的O-糖链[49]。但是目前还无法准确预测O-糖基化的位点。N-糖基化是将糖链连接到新生肽链的天冬酰胺-X-丝氨酸/苏氨酸(Asn-X-Ser/Thr,X为除脯氨酸以外的任何一种氨基酸)三联体的天冬酰胺上。N-糖基化过程首先是葡萄糖、甘露糖、半乳糖、N-乙酰氨基葡萄糖与磷酸多萜醇形成一个脂多糖前体(Glu3Man9GluNAc2)。然后,N-糖基转移酶将该前体的多糖链部分转运至新生肽链中Asn-X-Ser/Thr三联体的Asn残基上。随后新生肽链经过葡萄糖苷酶Ⅰ和Ⅱ切除多糖链的3个葡萄糖残基,并且经过甘露糖苷酶Ⅰ切除1个甘露糖后,形成GluMan8NAc2结构[50]。这两种糖基化修饰步骤和新生肽链招募分子伴侣和折叠酶同步进行得到折叠与修饰后的糖蛋白。最后,糖蛋白以囊泡形式转运到高尔基体。进而,在α-1,6-甘露糖基转移酶(OCH)和α-1,3-甘露糖基转移酶(MNN)的作用下添加α-1,6-甘露糖和α-1,3-甘露糖。其他的甘露糖转移酶和磷酸甘露糖转移酶继续特异地识别此糖链,并添加甘露糖和磷酸甘露糖,形成高甘露糖结构[51]。酿酒酵母的寡糖转移酶复合物(Oligosaccharyltransferase complex,OST)包括Ost1p、Ost2p、Ost3p、Ost4p、Ost5p、Ost6p、Stt3p、Swp1p、Wbp1p共 9个亚基,催化N-糖基化反应。其中Ost3p、Ost4p和Stt3p形成的复合物直接参与靶肽识别。毕赤酵母的Stt3p与酿酒酵母Stt3p有65%的同源性[52]。
与酿酒酵母相比,毕赤酵母表达外源蛋白的糖基化程度有所减轻,但与天然蛋白质相比,仍然存在着过度糖基化的问题。过度糖基化会使蛋白产物相对分子质量不均一,蛋白质的功能位点被掩盖。因此对毕赤酵母糖基化过程改造非常必要。目前毕赤酵母糖基化改造方法有通过抑制OCH1酶活性消除内源性高甘露糖;引入α-1,2-糖苷甘露糖苷酶Ⅰ降解高甘露糖;引入类似于哺乳动物的唾液酸化复杂聚糖成分[53]。
新生肽链在内质网腔进行折叠和修饰后应该进入高尔基体进行再加工。外源蛋白过量表达会占用大量的分子伴侣等辅助因子。在葡萄糖饥饿等胁迫条件下,有的新生肽链会因为缺乏分子伴侣而无法正确折叠,内质网内会积累大量未折叠和折叠错误的蛋白质,引发内质网应激反应(Endoplasmic reticulum stress,ERS)。这些未折叠或错误折叠会被保留在内质网中继续折叠或被运转到细胞质中降解[54]。细胞主要通过未折叠蛋白反应(Unfolded protein response,UPR)[55]和内质网相关蛋白降解(Endoplasmic reticulum associated degradation,ERAD)途径[56]来调控内质网压力。如果内质网长时间保持ERS状态,细胞会启动凋亡程序。
UPR是内质网应激条件下激活的主要信号通路之一,通过一系列信号转导反应上调分子伴侣和折叠酶的表达量来提高内质网的折叠能力。内质网膜上有3种跨膜蛋白可以感知未正确折叠新生肽链,分别为Ire1p、Hac1p、Rlg1p。当大量未正确折叠新生肽链存在时,Ire1上的Bip/Kar2解离后暴露了Ire1的二聚体结合位点,Ire1形成二聚体而导致自身磷酸化[57]。磷酸化后的Ire1二聚体能特异地剪切细胞质中的hac1 mRNA(hac1u)内含子。剪切后的hac1 mRNA(hac1i)由Rlg1p连接后翻译成具有活性的转录因子Hac1。Hac1结合染色体的UPR元件上调UPR相关基因。这些UPR相关基因主要编码内质网的分子伴侣和折叠酶类,如Bip/Kar2、二硫键异构酶PDI和凝集素类蛋白CNX/CRT等[58]。
ERAD是广泛存在于酵母和哺乳动物的降解未正确折叠新生肽链的途径。当未正确折叠新生肽链与Hsp70长时间结合就会被E3泛素连接酶Hrd1复合物识别。新生肽链糖基化错误而带有Man7GlcNAc2糖链时,会被凝集素类蛋白Yos9的腔结构域识别。被识别的新生肽链在E泛素激活酶(Uba1)、E2泛素结合酶(Ubc6/Ubc7)、E3泛素连接酶(Hrd1/Doa10)的作用下将泛素结合到新生肽链中赖氨酸残基的ε氨基上。经泛素化的新生肽链在Usa1、Ubx2和Cdc48等因子作用下逆向运出内质网后,被细胞质中蛋白酶体降解,然后用于合成新的蛋白质[58]。
4 高尔基体加工和运输
高尔基体主要对新生肽链进行分类转运、糖链改造。带寡糖链的新生肽链还需要在高尔基体中加工才能成为有活性的外源蛋白。细胞中大量的高尔基堆成具有多个扁平囊泡后,以囊泡穿梭和囊泡成熟2种方式转运外源蛋白。囊泡穿梭是基于扁平囊泡内存在一套特殊的蛋白加工系统。外源蛋白在囊泡中沿着高尔基堆穿梭而成为有活性的外源蛋白。囊泡成熟方式认为囊泡沿着高尔基由顺面向反面移动,再将外源蛋白从反面扁平囊泡运回[59-60]。高尔基体通过出芽的方式形成小泡将外源蛋白运输到细胞膜附近,然后与质膜融合使分泌小泡内的外源蛋白释放到胞外。
外源蛋白分泌有被膜小泡COPⅠ(Coat protein complex I)、被膜小泡COPⅡ (Coat protein complex II)和网格蛋白(Calthrin)介导3种方式。COPⅠ的作用为介导外源蛋白从高尔基体反面分泌到顺面,介导从内质网到高尔基体的顺行转运,以及从高尔基体到内质网的逆向运输,将逃逸蛋白回收到正确位置[61]。被膜小泡COPII是由5个高度保守蛋白(小G 蛋白Sar1、内衣被蛋白Sec23和Sec24、外衣被蛋白Sec13和Sec31)组成的基本单位形成[62]。COPII小泡主要介导蛋白从内质网到高尔基体的顺向运输。网格蛋白产生于高尔基体,介导外源蛋白从高尔基体到细胞膜的运输。这三种小泡都需要GTP结合蛋白(Sar与ARF)的协助才能完成运输。小泡到细胞膜的过程借助于细胞骨架完成蛋白识别、装配、去装配等步骤的调控[63]。小泡与质膜的融合主要由SNARE蛋白(Soluble n-ethylmaleimide-sensitive factor attachment protein receptor)介导。小泡上的v-SNARE蛋白识别质膜上的t-SNARE后,形成SNARE复合体,达到定位的作用。最后,小泡和质膜融合将外源蛋白释放到胞外[64]。
5 展 望
改造毕赤酵母的外源蛋白分泌途径是研究热点。随着毕赤酵母基因组序列的公布,从整体视角考虑各种限制因素,有利于对外源蛋白分泌的分子机制研究[65]。目前已有改造分泌途径的蛋白而提高外源蛋白的产量的研究成果。例如共表达内质网膜的跨膜蛋白Hac1p分别提高白介素-10和唾液酸酶达2.2倍和2.1倍[66]。Vanz等[67]优化培养过程降低UPR和ERAD途径的相关蛋白,将胰岛素原的表达量大幅度提高。Wang等[68]优化氮源流加降低UPR和ERAD途径相关蛋白使肽链内切酶的表达量提高1.48倍。本文总结毕赤酵母外源蛋白分泌途径中涉及的基因和蛋白,介绍了其功能,为进一步调控外源蛋白分泌提供基础。在毕赤酵母的5 000多个基因中,已知可能参与外源蛋白分泌的约有400多个,但仍然难以达到对蛋白分泌的控制[42],因此需要进一步挖掘影响外源蛋白分泌的关键基因和蛋白。例如,毕赤酵母中仍有很多基因还没鉴定,所以鉴定毕赤酵母基因,表征其蛋白的功能是完善蛋白分泌途径不可或缺的工作。而且,外源蛋白的分泌是一个动态的生物化学过程。其中影响基因转录和翻译的各种因素相互作用,形成调控蛋白表达的动态网络,也是调控外源蛋白分泌的难点。毕赤酵母表达外源蛋白的机制为底物依赖性,培养条件的变化也会引起毕赤酵母代谢途径的改变。这些改变也涉及到基因转录和翻译的变化。所以进一步阐明毕赤酵母的外源蛋白分泌途径和机制还有很多工作需要开展。
