CVB对OL细胞和OL/BDV细胞I型IFN信号转导途径的影响
2019-10-12翟爱霞颜冬梅王海萍崔乐乐考文萍张凤民
翟爱霞,颜冬梅,王海萍,卜 桐,崔乐乐,考文萍,张凤民*
(1.哈尔滨医科大学 微生物学教研室 伍连徳研究所 黑龙江省感染与免疫重点实验室 黑龙江省普通高校病原生物学重点实验室 黑龙江省普通高校感染与免疫科技创新团队 黑龙江 哈尔滨 150081;2.哈尔滨医科大学 附属第四医院,黑龙江 哈尔滨 150001)
I型干扰素(interferon,IFN)是一种在抗病毒、抗肿瘤、免疫调节领域发挥着关键作用的细胞因子,包括IFN-α和IFN-β[1-2]。许多物质可以诱导I型IFN的产生,如各种病毒、真菌、寄生虫、双链RNA、细菌脂多糖等,其中以病毒和双链RNA的诱导最为有效[3-5]。RNA病毒复制过程中形成双链RNA(double-stranded RNA,dsRNA)中间体,可被细胞内体膜上的Toll样受体(Toll-like receptor,TLR)3识别,激活TANK结合激酶(TANK-binding kinase,TBK)1/核因子κB激酶抑制剂(inhibitor of nuclear factor kappa-B kinase,IKK)ε,进而磷酸化IRF3/7转移到细胞核,诱导I型IFN产生[6-7]。柯萨奇病毒(coxsackievirus,CVB)为单股正链小RNA病毒,在复制过程中生成大量dsRNA,因此,CVB可作为诱导I型IFN信号转导通路活化的有效诱导剂[8],但其在病毒持续感染中对I型IFN的调控作用研究较少。博尔纳病病毒(Borna disease virus,BDV)是一种有包膜的单负链RNA病毒,属于嗜神经病毒,能够感染鸟类、家禽、牲畜和灵长类等多种动物[9-10]。研究发现BDV感染人后,主要引起以中枢神经系统功能障碍为临床体征的精神障碍性疾病[11]。多数情况下,BDV感染后会形成持续性的感染,被BDV感染的宿主细胞在细胞形态、增殖能力及生物学特性上与正常细胞没有明显分别[12]。我们前期研究发现microRNA-155(miR-155)通过抑制I型IFN负性调控因子人细胞因子信号转导抑制分子(human suppressor of cytokine signaling,SOCS)3表达促进I型IFN产生,BDV编码磷蛋白(phosphoprotein,P)通过调控miR-155抑制I型IFN建立病毒持续感染状态[13]。因此,本研究以BDV持续感染的人类少突胶质瘤细胞(oligodendrocyte,OL)(OL/BDV)为研究模型,探讨CVB在病毒持续感染状态下对I型IFN信号转导通路的影响。
1 材料与方法
1.1 材料
1.1.1 病毒和质粒 柯萨奇病毒B3型(CVB3),由哈尔滨医科大学微生物学教研室提供,是CVB的6个血清型中致病性最强的一型。IRF7本身是IFN诱导表达的转录因子,存在于细胞浆中,其活性主要通过蛋白质水平调节,许多因素如病毒感染和DNA损伤等能诱导IRF7磷酸化并促进IRF7转移至细胞核,发挥转录激活作用。IRF7-EGFP质粒由澳大利亚墨尔本大学许大康教授惠赠,转染至细胞内表达IRF7绿色荧光融合蛋白。
1.1.2 主要试剂与仪器 TRIzol、dNTP Mixture (each 2.5 mmol/L)、Lipofectamine 2000购自美国Invitrogen公司,M-MLV购自美国Promega公司,Oligo d(T)18、SYBR Premix Ex TaqTM购自日本TaKaRa公司。Axiovert 200倒置荧光显微镜(ZEISS),LightCycler 2.0荧光定量PCR仪(Roche),-80 ℃低温冰箱(SANYO),TGL-16G高速冷冻离心机(HITACHI),RS232C核酸分析仪(Eppendorf),Mili-Q plus超纯水系统(Milipore)。
1.2 方法
1.2.1 细胞转染和病毒感染 选择对数生长期的OL细胞和OL/BDV细胞,加入PBS缓冲液清洗细胞。加入0.25%的胰酶浸过细胞表面,37 ℃条件消化细胞,显微镜下观察,如发现细胞收缩,细胞间隙增大,立即停止消化,弃去消化液。用适量的细胞培养液,吹打细胞瓶内的细胞,制成细胞悬液,以2.0×105细胞/孔铺于12孔培养板内。将细胞培养板置于5% CO2、37 ℃孵箱中培养24 h,加入CVB(MOI:0.5),分别于0、2、4、6、12和24 h收集细胞。按照Lipofectamine 2000操作说明书将IRF7-EGFP质粒转染至OL细胞和OL/BDV细胞,转染24 h后加入CVB感染4 h,荧光显微镜观察IRF7的细胞定位情况。
1.2.2 RNA提取 上述操作中收集的细胞加入TRIzol,充分融化并混匀至液体无细胞团块。加入氯仿,充分混匀室温静置3 min,4 ℃、12 000 r/min离心15 min,上清移至新的无菌离心管中。加入异丙醇,充分混匀,4 ℃、12 000 r/min离心15 min,弃上清。加入75%乙醇,轻轻漂洗沉淀,4 ℃、12 000 r/min离心15 min,弃上清。开口倒置于无菌滤纸上,干燥核酸沉淀,加入去离子水溶解核酸沉淀,核酸分析仪检测RNA浓度。
1.2.3 荧光实时定量PCR(qPCR)取1.2.2操作中RNA 2 μg,加入随机引物Oligo d(T)18、M-MLV、dNTP Mixture等逆转录RNA为cDNA,反应条件为42 ℃ 1 h、95 ℃ 5 min。取cDNA 2 μL,分别加入GAPDH、IFN-α和IFN-β上下游引物[13]、SYBR Premix ExTaq、ddH2O,进行qPCR检测IFN-α mRNA和IFN-β mRNA相对表达水平。取1.2.2操作中RNA 2 μg,加入miR-155 RT引物[13],逆转录RNA为cDNA。取cDNA 2 μL,分别加入U6和miR-155上下游引物[13],进行qPCR检测miR-155相对表达水平。
2 结果与分析
2.1 CVB感染OL细胞和OL/BDV细胞I型IFN mRNA和miR-155表达水平的变化
2.1.1 I型IFN mRNA表达水平 CVB分别感染OL细胞0、2、4、6、12和24 h,其中4个时间点(2、4、12和24 h)IFN-α mRNA表达水平显著增加(图1A),IFN-β mRNA表达水平在4、12和24 h显著增加(图1B)。我们前期研究发现,BDV持续感染显著抑制OL细胞I型IFN的诱导表达[13]。CVB感染OL/BDV细胞6个时间点后,IFN-α和IFN-β mRNA表达水平除0 h均显著增加(图1A和1B),但是诱导作用显著低于对OL细胞I型IFN的诱导作用,说明CVB仅能部分解除BDV对I型IFN诱导的抑制作用。

图1 CVB感染OL细胞和OL/BDV细胞I型IFN mRNA表达水平的时间点分析Fig.1 Time point analysis of the expression of type I IFN mRNA in OL cells and OL/BDV cells infected with CVBA:CVB感染OL细胞和OL/BDV细胞后IFN-α mRNA的表达水平;B:CVB感染OL细胞和OL/BDV细胞后IFN-β mRNA的表达水平;与对照组相比,*P<0.05,**P<0.01,***P<0.001,图2同A:Expression of IFN- α mRNA in OL cells and OL/BDV cells infected with CVB;B.Expression of IFN-β mRNA in OL cells and OL/BDV cells infected with CVB:Compared with the control group,*P<0.05,**P<0.01,***P<0.001,the same as figure 2
2.1.2 miR-155表达水平 我们前期研究发现,miR-155正性调节I型IFN表达,BDV持续感染显著抑制OL细胞miR-155的产生[13]。因此,将CVB感染OL细胞和OL/BDV细胞后,于6个时间点收集细胞检测miR-155的表达水平。由图2可以看出,CVB在2、4、12和24 h显著诱导OL细胞miR-155表达水平,4 h诱导水平最高。CVB仅在12和24 h增加OL/BDV细胞miR-155表达,诱导作用显著低于对OL细胞miR-155的诱导作用,说明CVB仅在感染OL/BDV细胞后期促进miR-155表达。
2.2 CVB感染OL细胞和OL/BDV细胞IRF7细胞定位的变化
2.2.1 CVB未感染细胞IRF7细胞定位情况 IRF7是I型IFN信号转导途径中的关键因子,转染IRF7-EGFP质粒至OL细胞和OL/BDV细胞,荧光显微镜观察IRF7绿色荧光蛋白于细胞中的定位情况,400倍视野进行拍照。结果发现,IRF7绿色荧光蛋白位于细胞浆内(图3A和3C)。
2.2.2 CVB感染细胞IRF7细胞定位情况 转染IRF7质粒至OL细胞和OL/BDV细胞,再加入CVB感染4 h,IRF7绿色荧光蛋白转移至细胞核内(图3B和3D),说明CVB能够活化IRF7,进而激活I型IFN信号转导途径。

图2 CVB感染OL细胞和OL/BDV细胞miR-155表达水平的时间点分析Fig.2 Time point analysis of the expression of miR-155 in OL cells and OL/BDV cells infected with CVB
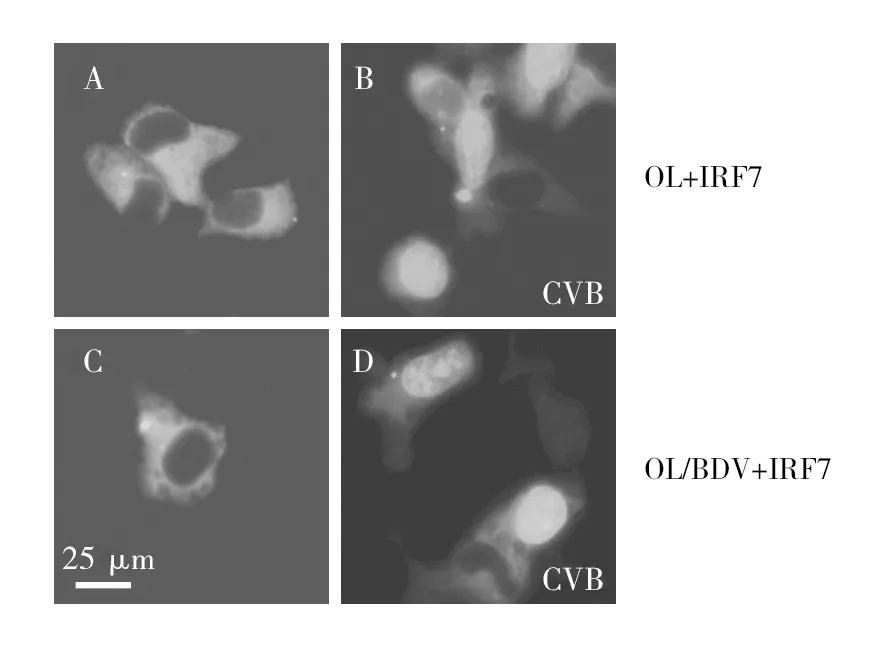
图3 CVB感染OL细胞和OL/BDV细胞IRF7的细胞定位情况Fig.3 Cellular localization of IRF7 in OL cells and OL/BDV cells infected with CVBA:IRF7在OL细胞中的定位;B:CVB感染OL细胞IRF7的细胞定位;C:IRF7在OL/BDV细胞中的定位;D:CVB感染OL/BDV细胞IRF7的细胞定位A:Cellular localization of IRF7 in OL cells;B:Cellular localization of IRF7 in OL cells infected with CVB;C:Cellular localization of IRF7 in OL/BDV cells;D:Cellular localization of IRF7 in OL/BDV cells infected with CVB
3 讨 论
RNA病毒常作为诱导剂用于I型IFN信号转导途径的研究,常用的RNA病毒有流行性感冒病毒(influenza virus,Flu)、仙台病毒(Sendai virus,SeV)和水疱性口炎病毒(Vesicular Stomatitis Virus,VSV)等。Qi等[14]研究发现Cdc25A能够抑制Flu RNA对IFN-β萤光素酶报告基因的激活,并能抑制SeV等病毒诱导的IFN-β基因转录。登革病毒(dengue virus,DENV)感染后24和48 h,DDX 25沉默细胞的IFN-β表达较对照组分别增加1.5倍和1.4倍,DDX 25沉默也增强了IFN-β启动子驱动荧光素酶(IFNβ-Luc)在VSV和SeV感染的HEK293T细胞中的表达[15]。miR-223在VSV感染的巨噬细胞中上调了Ⅰ型IFN的表达水平,由VSV感染诱导的I型IFN对miR-223的上调起着重要作用,从而形成了对Ⅰ型IFN产生的正调控回路[16]。本研究发现CVB显著激活I型IFN信号转导途径,并可增加病毒持续感染时I型IFN的产生,为CVB作为诱导I型IFN信号转导途径的RNA病毒提供了参考。
BDV感染细胞后,常建立持续感染状态,抑制I型IFN表达,因此BDV可作为病毒持续感染模型用来研究I型IFN信号转导途径。BDV编码蛋白P,可通过与TBK1发生相互作用影响IRF3的活化,即IRF3的磷酸化、二聚反应以及入核,从而抑制IFN-β的合成[17]。还有研究发现,BDV编码蛋白P降低神经元细胞的组蛋白乙酰化水平,这种作用依赖于蛋白酶C对其磷酸化,BDV P同时抑制细胞组蛋白乙酰转移酶的活性,通过药物调控细胞的乙酰化水平后,细胞乙酰转移酶降低了培养细胞中的病毒复制,说明BDV与宿主细胞相互作用建立持续感染状态[18]。本研究发现CVB能够解除BDV对I型IFN的抑制作用,为进一步研究病毒持续感染逃逸宿主免疫提供新的思路。
MiR-155位于人类的染色体(21q21.3)上,定位于GRCh37,参与多种生物学过程,如调控免疫细胞和造血细胞的分化及发育,参与调节肿瘤的发生和发展,也能在病毒感染、炎症和抗体合成等多种免疫应答反应中发挥重要的调节作用[19-20]。有研究发现,RNA病毒诱导的miR-155表达能够增强I型IFN的信号传导途径从而促进I型IFN的抗病毒效应。miR-155通过靶向结合I型IFN信号传导通路的负性调节因子SOCS1,从而增强I型IFN的信号传导并促进其抗病毒效应[21]。而且,miR-155还能够促进人的肝癌细胞内一些经由I型IFN诱导的抗病毒蛋白产生增加,并且miR-155产生增加后使SOCS1蛋白的产生受到了抑制,从而激活了STAT1和STAT3的磷酸化,促进I型IFN的JAK/STAT信号传导通路进而增强天然抗病毒免疫反应[22]。课题组前期研究发现miR-155可以通过抑制IFN信号途径中的负性调控因子SOCS3的表达来调控内源性I型IFN的诱导过程。BDV编码蛋白P利用减少宿主miR-155的产生而逃逸免疫应答反应,进而建立了病毒的持续性感染[13]。本研究证实CVB显著诱导OL细胞中miR-155表达,但是在BDV持续感染中仅在CVB感染后期诱导miR-155升高,可能是BDV对miR-155的抑制作用较强,而I型IFN的产生存在多条信号途径的原因。
Zhong等[23]用酵母多糖(10 mg/mL)刺激小鼠巨噬细胞、中性粒细胞、淋巴细胞和角膜上皮细胞A6细胞8~24 h,IFN mRNA和蛋白表达水平在24 h前显著升高,8 h达高峰,此外,Ⅰ型IFN和Ⅱ型IFN的表达水平与真菌性角膜炎的进展呈正相关。通过设立6个时间点检测CVB对I型IFN和miR-155的诱导作用,正常细胞4 h为诱导表达最显著时间,BDV持续感染细胞24 h为诱导表达最显著时间点,提示CVB对病毒未感染和持续感染时诱导I型IFN信号转导途径的时间点可能存在不同。
RNA病毒感染及其复制过程中的dsRNA是诱导I型IFN产生的重要因子,在今后的研究中,如何合理地利用RNA病毒调控I型信号转导途径,确保机体在病毒感染后启动适当的反应来控制疾病的发生与发展是未来的研究方向。
