2型糖尿病血管病变患者TIPE2与TF的检测及临床意义
2019-10-11熊石龙吴一行龚芳何伟
熊石龙,吴一行,龚芳,何伟
随着人们生活水平的提高以及生活模式“西方化”、社会人口老龄化,我国糖尿病患病人数逐年增高。糖尿病是一种全身性代谢紊乱性疾病,不仅会影响糖类的代谢,导致高血糖、血糖波动,还会影响蛋白质和脂质代谢,导致脂代谢紊乱和高脂血症,从而造成血管壁炎性损伤、狭窄。相关研究表明,炎症和免疫反应可能与2 型糖尿病(T2DM)及其并发症的发生发展密切相关[1]。
组织因子(tissue factor,TF),又称组织凝血活酶(Thromboplastin),在糖尿病患者中表达明显增高,是血管内皮损伤的重要标志,也是外源性凝血途径的启动因子和重要的炎症因子[2]。新近发现的肿瘤坏死因子α 诱导蛋白8 样分子2(tumor necrosis factor-α induced protein 8 like-2,TIPE2)属于肿瘤坏死因子α 诱导蛋白8(tumor necrosis factor-α induced protein-8,TNFAIP8)家族,优先表达在淋巴组织和炎症组织中,是一种炎症负性调节因子,在保持免疫平衡中发挥着至关重要的作用[3]。但免疫调节因子TIPE2与炎症因子TF在T2DM血管病变患者中的作用及其关系尚不明确。本研究旨在探讨T2DM 血管病变患者外周血单个核细胞(PBMCs)中TIPE2与TF的变化,了解TIPE2、TF及肿瘤坏死因子(TNF)-α 对T2DM 血管病变患者的临床意义,为进一步对T2DM 血管并发症的临床有效干预提供依据。
1 对象与方法
1.1 研究对象 选择广州医科大学附属第二医院番禺院区2015年5月—2016年5月收集的T2DM患者78例,其中男54例,女24例。所有患者诊断均符合2013版中国T2DM防治指南中的诊断标准[4]。患者依据是否合并有血管病变,分为血管病变(T2DM+V)组36 例和非血管病变组(T2DM)组42 例,T2DM+V 组患者均合并微血管及大血管病变,T2DM 组均未合并微血管及大血管病变。排除1型糖尿病(T1DM)及继发性糖尿病者;患急性感染性疾病者;合并高血压肾病、慢性肾小球肾炎、尿毒症或透析患者;合并风湿性疾病或其他内分泌代谢疾病者;合并心脑血管疾病、肝肾功能不全、血液系统疾病、肿瘤、感染者;长期服用避孕药者;妊娠、哺乳期女性。另选取同期在我院体检正常者40例为对照(CON)组,均排除糖尿病及内分泌系统疾病,空腹糖耐量正常,无感染、心、肝、肺、肾等疾病。本研究经医院伦理委员会论证通过,患者及家属签署知情同意书。
1.2 主要试剂及仪器 糖化血红蛋白(HbA1c)分析仪(东曹上海生物科技有限公司,HLC-723G8),贝克曼全自动生物化学分析仪(美国贝克曼库尔特有限公司,DXC600),实时荧光定量PCR 仪(美国应用生物系统公司,7500fast),酶标仪(美国伯腾仪器有限公司,Synergy HT)。HbA1c检测试剂盒购自广州惠尧生物科技有限公司;总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)检测试剂盒均购自德国德赛诊断系统有限公司;Ficoll 淋巴细胞分离液购自美国GE 医疗集团;Trizol 试剂及RNA 反转录试剂盒均购自美国Invitrogen 公司,实时荧光定量PCR试剂盒购自日本TaKaRa公司。引物购自上海吉凯生物技术有限责任公司。血浆TF 酶联免疫吸附法(ELISA)检测试剂盒购自美国ADI公司,血浆TNF-α ELISA试剂盒购自美国R & D公司。
1.3 方法
1.3.1 临床资料收集 收集并记录研究对象年龄、性别、血清HbA1c、TC、TG、HDL-C、LDL-C水平。高效液相色谱法检测HbA1c;酶比色法检测TC 和TG;修饰酶法检测HDL-C 和LDL-C。
1.3.2 PBMCs 分离 清晨采集空腹血样3 mL,加入Ficoll 淋巴细胞分离液,密度梯度离心法进行分离,取中间白膜层,即PBMCs。
1.3.3 实时荧光定量PCR检测PBMCs中TIPE2、TF mRNA表达 利用Trizol 试剂从新鲜的PBMCs 中提取总RNA,一步法逆转录获得cDNA 后使用SYBR Green 染料法进行实时荧光定量PCR,按照说明书步骤检测TIPE2、TF 的mRNA 表达。引物序列:TIPE2,上游5´-TGTGCTGCTAGAGTTGGTGGA-3´,下游5´-TGCCAAGGTGCTGAGTGAA-3´;TF,上游5´-CCCAAACCCGTCAATCAAGTC-3´,下游5´-CCAAGTACGTCTGCTTCACAT-3´ ;β - actin,上游 5´- GGTGGTCTACCCTTGGACCC-3´ ,下 游 5´- GATACTTGTGGGCCAGGGCA-3´。两步法PCR 扩增条件:95 ℃30 s;95 ℃3 s,60 ℃30 s,40 个循环。总反应体积20 μL。根据qPCR 得出的荧光曲线Ct 值,以β-actin 为内参,用2-ΔΔCt法统计结果,ΔCt=目的基因Ct 值-内参Ct 值,ΔΔCt=实验组ΔCt 值-对照组ΔCt值。实验重复3次。
1.3.4 ELISA 检测血浆TF和TNF-α水平 采集清晨空腹外周血,静置30 min 后,3 000 r/min 离心10 min,将血浆分装冻存于-80 ℃冰箱备用,集中测量。严格按照说明书进行检测,使用酶标仪在450 nm波长处测定标准品和样品光密度(OD)值,并根据标准曲线计算TF及TNF-α浓度,每个样品设3个复孔。
1.4 统计学方法 应用SPSS 13.0软件进行统计学分析。计数资料应用例(%)表示,多组之间比较应用χ2检验。计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,指标间关系测定采用Pearson线性相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组一般临床资料比较 3组性别、年龄、血脂方面的差异无统计学意义(P>0.05);与CON 组相比,T2DM 组和T2DM+V 组HbA1c 升高,且T2DM+V组高于T2DM组(P<0.05),见表1。
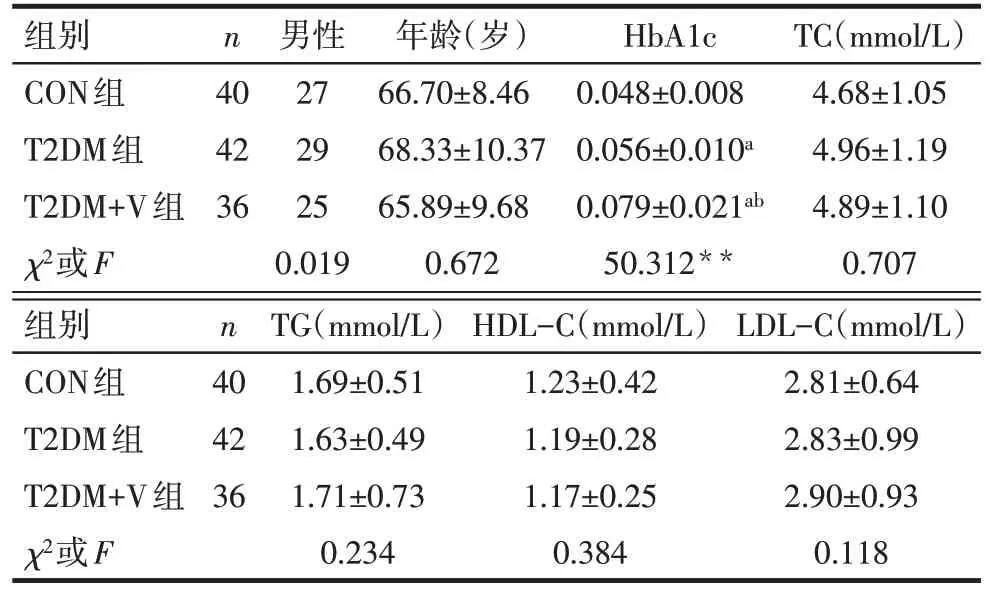
Tab.1 Comparison of general clinical data between three groups表1 3组一般临床资料比较
2.2 3组PBMCs 中TIPE2、TF mRNA 表达情况 与CON 组比较,T2DM 组TIPE2 mRNA 表达水平降低,T2DM+V 组较T2DM 组更低(均P<0.05)。T2DM 组TF mRNA 表达水平高于CON 组,T2DM+V 组高于T2DM组(均P<0.05),见表2。
Tab.2 Comparison of TIPE2 mRNA and TF mRNA of PBMCs between three groups表2 3组PBMCs中TIPE2、TF mRNA表达水平的比较(±s)
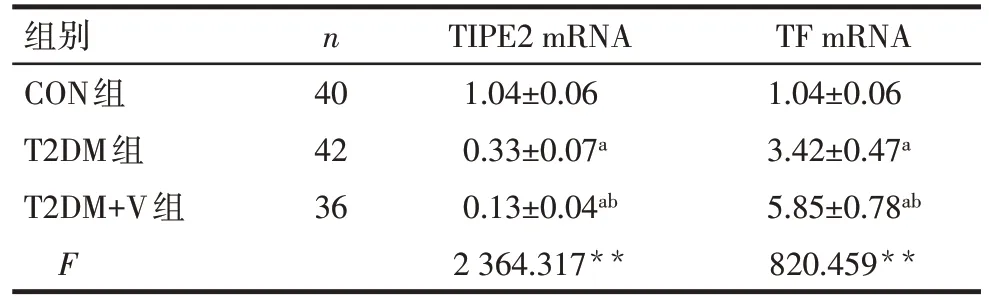
Tab.2 Comparison of TIPE2 mRNA and TF mRNA of PBMCs between three groups表2 3组PBMCs中TIPE2、TF mRNA表达水平的比较(±s)
**P<0.01;a与CON组比较,b与T2DM组比较,P<0.05
组别CON组T2DM组T2DM+V组F n 40 42 36 TIPE2 mRNA 1.04±0.06 0.33±0.07a 0.13±0.04ab 2 364.317**TF mRNA 1.04±0.06 3.42±0.47a 5.85±0.78ab 820.459**
2.3 3组血浆中TF、TNF-α浓度比较 与CON组相比,T2DM 组TF、TNF-α 浓度明显升高,T2DM+V 组较T2DM 组TF、TNF-α 浓度升高更明显(均P<0.05),见表3。
Tab.3 Comparison of plasma levels of TF and TNF-α between three groups表3 3组血浆中TF、TNF-α浓度的比较 (ng/L,±s)

Tab.3 Comparison of plasma levels of TF and TNF-α between three groups表3 3组血浆中TF、TNF-α浓度的比较 (ng/L,±s)
**P<0.01;a与CON组比较,b与T2DM组比较,P<0.05
组别nTFTNF-α CON组T2DM组T2DM+V组F 40 42 36 21.63±2.66 32.21±2.48a 38.39±3.89ab 299.337**20.13±2.04 29.79±2.16a 39.27±4.96ab 329.118**
2.4 3组间各指标相关性分析 CON 组及T2DM 组内各指标间无相关性。T2DM+V 组PBMCs 中TF mRNA 与TIPE2 mRNA 呈负相关(r=-0.340,P<0.05),血浆TF与血浆TNF-α呈正相关(r=0.724,P<0.001)。3组PBMCs 中TIPE2 mRNA 表达与TF mRNA 及血浆TF、TNF-α 浓度的相关性分析结果显示,T2DM+V 组中TIPE2 mRNA 表达水平与TF mRNA及血浆TNF-α均呈负相关,见表4。
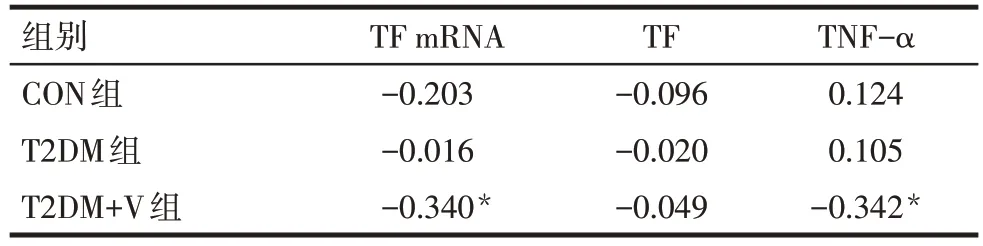
Tab.4 Correlation between TIPE2 mRNA and TF mRNA,plasma levels of TF and TNF-α in three groups表4 3组TIPE2 mRNA表达水平与TF mRNA表达水平及血浆TF、TNF-α浓度的相关性分析(r)
3 讨论
随着胰岛素、口服降糖药物的广泛应用,高血糖及急性合并症,如酮症酸中毒导致的死亡人数己显著下降,目前各种急慢性并发症已成为严重影响糖尿病患者生存质量的主要原因,其中糖尿病血管病变是最常见的也是患者致死、致残的最主要的原因之一。T2DM 血管病变主要包括大血管病变和微血管病变,并发大血管病变多见于主动脉、脑动脉及冠状动脉,极易引起严重的心、脑血管意外;微血管病变主要表现为糖尿病肾病、视网膜病变和糖尿病心肌病,严重影响患者的生活质量[5]。
3.1 血管内皮细胞损伤是糖尿病血管病变的根本原因 高血糖引起超氧化物生成增多,继而引起氧化应激及生成的糖基化终末产物(advanced glycation end products,AGEs)被公认为是导致血管内皮功能损伤的两个重要环节[6],高血糖还可诱导内皮细胞炎症、凋亡,从而造成血管壁的结构改变和血管内皮功能损伤[7]。此外,T2DM患者体内普遍存在微炎症状态。微炎症状态是指既非微生物感染,又不同于全身炎症反应综合征的慢性、进展性、低强度性、相对隐匿性的炎症状态,其特征是单核巨噬细胞系统激活,产生TNF-α和白细胞介素(IL)-6等炎症因子,进而参与T2DM 及其并发症的发生发展[8]。TNF-α可抑制血管内皮细胞一氧化氮合成酶(NOS)表达与活性,降低内皮细胞胰岛素受体表达及磷酸化,抑制胰岛素信号转导,导致内皮依赖性血管舒张功能受损,并促进多种因子及细胞黏附分子的表达,最终引发内皮细胞功能异常甚至凋亡。本研究结果表明,T2DM+V 组血浆TF 和TNF-α 水平高于T2DM组和CON 组,相关性分析表明TF 与TNF-α 呈正相关,提示炎症因子TF、TNF-α在T2DM血管病变的发生发展中起协同促进作用。
3.2 血管内皮细胞损伤可诱导炎症因子TF 表达 病理情况下,TF过度表达及活性异常升高将导致动、静脉血栓形成。在动脉粥样硬化过程中,粥样斑块中的巨噬细胞表达大量TF,高水平TF 暴露引发血栓形成和心肌梗死。除诱导生理性凝血和病理性血栓形成外,TF本身还可以作为一种炎症因子参与炎症反应,抑制TF 表达可减轻内毒素诱导的凝血、炎症反应和小鼠的死亡率[9]。TF是损伤-炎症-凝血网络关键分子,在凝血与炎症反应中起重要作用[10]。因此,有效抑制TF 表达具有重要的临床意义。
3.3 TIPE2是先天性免疫及获得性免疫的负性调节者 TIPE2 通常表达在髓系和淋巴系的免疫细胞中,特别是在T淋巴细胞、单核细胞或巨噬细胞中高表达,是调节炎症反应以及维持免疫平衡的重要负性调节因子。TIPE2敲除的小鼠可出现慢性炎症反应,表现为体质量下降、脾肿大、白细胞增高以及多器官自发性炎症反应,内毒素刺激后则出现过度应答以致发生脓毒症,甚至死亡[3]。临床研究发现,系统性红斑狼疮(SLE)患者PBMCs 中TIPE2 mRNA 表达水平较健康对照者明显降低,且与SLE 患者的疾病活动度评分呈负相关[11]。Ma等[12]研究发现,在哮喘患儿PBMCs 中TIPE2 mRNA 表达水平明显下降。此外,慢性HBV感染肝炎患者PBMCs 中TIPE2的表达水平也明显下降,且TIPE2 水平与血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)水平呈负相关[13]。本课题组前期研究也表明,增强脐静脉血管内皮细胞TIPE2 表达可有效下调TF 的表达[14],但在PBMCs 中TIPE2 与TF 的关系鲜见报道。本研究发现,T2DM+V 组患者PBMCs 中TIPE2表达下调,而TF表达上调,与单纯T2DM组和CON 组比较差异有统计学意义;外周血中炎症因子TF、TNF-α则高于其他2组,且T2DM+V 组TIPE2表达与TF mRNA、TNF-α呈负相关,提示TIPE2下调可活化下游信号传导,合成释放炎症因子TF、TNF-α,触发炎症级联反应,加重炎症程度,恶化细胞生存环境,引发血管内皮损伤、功能障碍和机体血糖进一步升高,最终导致糖尿病血管病变的发生。
3.4 不足与展望 由于研究病例数较少,且具有一定地域特点,在一定程度上限制了研究结果的涵盖性和代表性,下一步需要多中心协作、大样本的临床研究来进一步验证。
综上所述,T2DM 患者PBMCs 中TIPE2 与TF 的表达密切相关,TIPE2、TF可能通过炎症机制参与糖尿病血管病变的发生发展,有效提高TIPE2、抑制TF可为T2DM的分子治疗提供新的思路。
