程序性坏死特异性抑制剂-1对呼吸机相关性肺损伤的保护作用
2019-10-11杜学柯荆忍张韵希葛万运
杜学柯,荆忍,张韵希,葛万运
机械通气是危重症患者治疗过程中重要的生命支持手段,使用不当可诱发肺损伤,即呼吸机相关性肺损伤(ventilator-induced lung injury,VILI)[1]。在细胞水平上,VILI 可以诱导坏死性细胞死亡(necroptosis)。程序性细胞坏死是细胞死亡的一种方式,与机体先天免疫反应,炎症相关疾病的发生、发展等关系密切,比如细菌和病毒感染,或者动脉粥样硬化等无菌损伤导致的炎性病变[2]。程序性坏死特异性抑制剂-1(programmed necrosis inhibitor -1,Nec-1)是一种能够特异性抑制细胞程序性坏死的生物碱物质[3],而对于Nec-1 能否改善呼吸机相关性肺损伤的程度,目前尚少见相关报道。本研究旨在探讨程序性细胞坏死在VILI 中的作用及相关机制,并观察Nec-1 在其中的影响,以期为临床治疗VILI提供新的思路与靶点。
1 材料与方法
1.1 一般资料 清洁级雄性成年SD大鼠40只,8周龄,体质量240~260 g,购自广西医科大学实验动物中心,采用标准饲料喂养,自由饮水和饮食,适应性饲养1 周后进行实验。Nec-1购自美国Sigma 公司,1 mg Nec-1溶于0.04 mL二甲基亚砜(DMSO)中,加生理盐水至0.5 mL 备用;TRIzol、逆转录试剂盒购自TaKaRa 公司;SYBR Green 实时定量PCR 试剂购自Roche 公司;DMSO 购自美国Amresco 公司;蛋白定量试剂盒购于上海碧云天生物技术研究所;白细胞介素(interleukin,IL)-6、IL-1β 和肿瘤坏死因子(tumor necrosis factor,TNF)-α 酶联免疫吸附试验(ELISA)试剂盒购自武汉华美生物工程有限公司;TOPO 型小动物呼吸机购自美国KENT 公司;酶标仪购自BIO-RAD 公司;PCR 扩增仪购自美国Thermo Fisher Scientific 公司。本研究经广西医科大学附属肿瘤医院伦理委员会批准。
1.2 实验分组与模型构建 采用随机数字表法将SD大鼠分为自主呼吸组(C组)、正常潮气量(VT)组(N组)、高VT组(H组)和程序性坏死特异性抑制剂组(Nec-1 组),每组10 只。VILI模型构建参考文献[4],大鼠麻醉固定后行气管切开插管术。C组大鼠保持自主呼吸;N组、H组和Nec-1组大鼠经股静脉给予肌松药,连接小动物呼吸机进行双肺机械通气4 h。呼吸机参数设置分别为:N 组潮气量8 mL/kg,H 组和Nec-1组潮气量40 mL/kg,呼吸比1∶1,呼吸频率80 次/min。Nec-1组在机械通气开始时股静脉给予Nec-1(1 mg/kg),其他机械通气组大鼠经股静脉给予等体积DMSO。
1.3 肺泡灌洗液的收集及检测 机械通气4 h后处死大鼠,用冷的磷酸盐缓冲液反复灌洗支气管肺泡,并收集支气管肺泡灌洗液(BALF),采用血球仪对肺泡灌洗液中渗出的细胞进行计数;按照蛋白定量试剂盒操作步骤说明书检测肺泡灌洗液中总蛋白含量;ELISA 检测肺泡灌洗液中炎症介质IL-6、IL-1β和TNF-α含量。
1.4 肺组织湿/干质量比值(W/D)计算 处死大鼠后取右肺下叶组织称湿质量(W),置于60 ℃烘干箱48 h后再称干质量(D),计算肺组织W/D。
1.5 肺组织病理学观察 用手术器械分离肺组织,用滤纸把大鼠左肺组织表面的血迹清理干净,放入10%多聚甲醛溶液固定液中24 h,石蜡包埋、切片,苏木素-伊红(HE)染色,分别在10 倍和40 倍光镜下观察。观察肺组织病理学改变,进行损伤程度评分[5],在镜下根据肺组织切片评分标准:①肺泡充血;②出血;③白细胞渗出到肺泡腔或血管壁;④肺泡壁损伤,分别按照0~4 分(0 分,少量轻微损伤;1 分,轻度损伤;2分,中度损伤;3分,重度损伤;4分,严重损伤)进行评分。
1.6 逆转录-聚合酶链反应(RT-PCR)检测肺组织受体相互作用蛋白1(RIPK1)、受体相互作用蛋白3(receptor-interacting protein kinase 3,RIPK3)和核因子κB(nuclear factor kappa-B,NF-κB)p65 的mRNA 表达 取冷冻肺组织,用TRIzol提取总RNA,用逆转录试剂盒将总RNA反转录为cDNA进行PCR。引物序列:RIPK1,上游5´-CTTAAGCCCAAGTGCAGTCA-3´,下游5´-ATAGCCCAACAAGGAGGATG-3´;RIPK3,上游5´-CAGTGTTGGCTGGAAGAGAA-3´,下游5´-AGGCTCAGAACTCCAGCAAT-3´;NF-κB p65,上游5´-GATGGGACGACACCTCTACACATA-3´,下游5´ - CCCAAGAGTCGTCCAGGTCA- 3´;GAPDH 作为内参,上游5´-GAAGGTGAAGGTCGGAGT - 3´;下 游 5´- CTTTAGGGTAGTGGTAGAAG-3´。反应条件:预变性95 ℃30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。采用2-ΔΔCt法计算目的基因的相对表达量[4]。
1.7 蛋白免疫印迹(Western blot)检测RIPK1、RIPK3 和NF-κB p65的蛋白表达 采用RIPA组织裂解液与蛋白酶抑制剂苯甲基磺酰氟(体积比100∶1)提取肺组织总蛋白,4 ℃离心5 min,留取上清液并用BCA法进行蛋白定量。取45 μg蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后进行转膜、封闭,加入一抗(稀释度:RIPK1为1∶1 000、RIPK3为1∶500 和NF-κB p65 为1∶2 000)孵育过夜,次日洗膜3 次,每次10 min;一抗孵育1 h,洗膜3次,每次10 min;采用电化学发光试剂盒显影,ChemiDocTMMP 成像系统成像并进行灰度值分析,以目的蛋白与内参GAPDH 的灰度值比值代表目的蛋白的相对表达量。
1.8 统计学方法 采用SPSS 16.0 统计学软件进行统计分析。符合正态分布的计量资料以±s表示,C 组、N 组和H 组各指标对比用单因素方差分析(one-way ANOVA),组间多重比较用SNK-q检验;H组和Nec-1组间均数比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组BALF 中各检测指标比较 C 组和N 组大鼠BALF 中各指标差异均无统计学意义。H 组总细胞数、总蛋白和炎性因子IL-6、IL-1β、TNF-α 水平较C 组和N 组明显升高(P<0.01)。与H 组相比,Nec-1组总细胞数、总蛋白和炎性因子IL-6、IL-1β、TNF-α水平下降(P<0.01),见表1。
Tab.1 Comparison of related indexes in alveolar lavage fluid between four groups表1 各组肺泡灌洗液中相关指标的比较(n=10,±s)
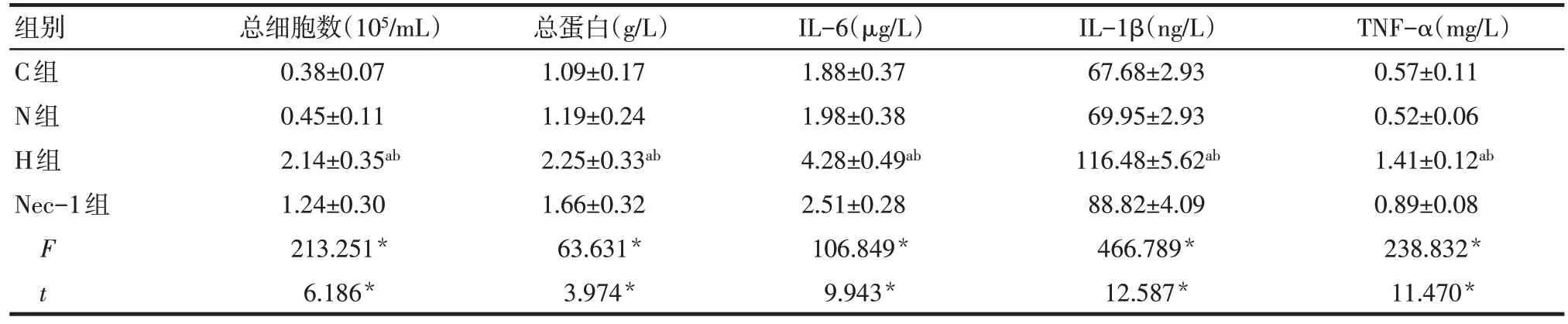
Tab.1 Comparison of related indexes in alveolar lavage fluid between four groups表1 各组肺泡灌洗液中相关指标的比较(n=10,±s)
*P<0.05;F为C组、N组、H组单因素方差比较结果,a与C组比较,b与N组比较,P<0.05;t 为H组与Nec-1组比较结果,表2、3同
组别C组N组H组Nec-1组F t总细胞数(105/mL)0.38±0.07 0.45±0.11 2.14±0.35ab 1.24±0.30 213.251*6.186*总蛋白(g/L)1.09±0.17 1.19±0.24 2.25±0.33ab 1.66±0.32 63.631*3.974*IL-6(μg/L)1.88±0.37 1.98±0.38 4.28±0.49ab 2.51±0.28 106.849*9.943*IL-1β(ng/L)67.68±2.93 69.95±2.93 116.48±5.62ab 88.82±4.09 466.789*12.587*TNF-α(mg/L)0.57±0.11 0.52±0.06 1.41±0.12ab 0.89±0.08 238.832*11.470*
2.2 各组肺组织病理学改变 肺组织HE 染色显示,C组和N组大鼠肺组织结构正常,肺泡内无明显炎性细胞浸润。与C 组和N 组相比,H 组大鼠肺泡内大量炎症细胞浸润,肺间隔增宽。与H 组相比,Nec-1 组肺组织损伤程度较显著减轻,仅有少量炎性细胞浸润,见图1。
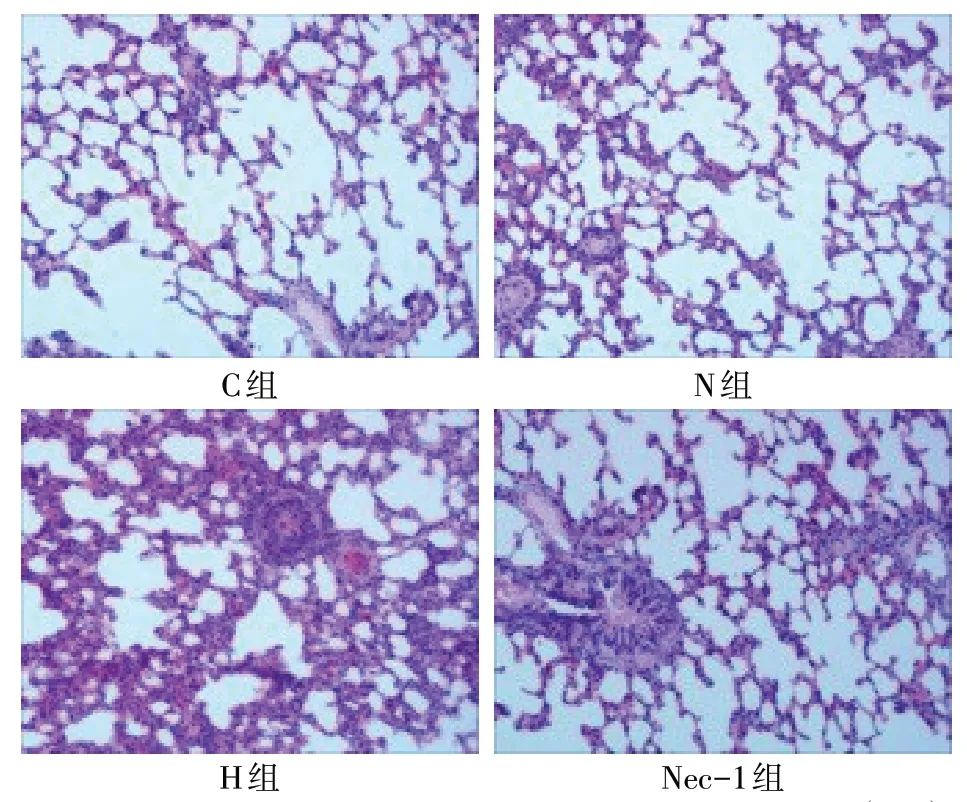
Fig.1 Comparison of HE staining results between four groups(×40)图1 肺组织病理HE染色结果比较(×40)
2.3 各组肺组织W/D 及和肺组织病理学评分比较 C组和N组W/D和肺组织病理评分无统计学意义。H组大鼠肺组织W/D和肺组织病理评分较C组和N 组明显增高(P<0.01)。与H 组相比,Nec-1 组大鼠肺组织W/D和肺组织病理评分下降(P<0.01),见表2。
2.4 各组肺组织RIPK1、RIPK3 和NF-κB p65 的mRNA 表达水平比较 C 组和N 组肺组织RIPK1、RIPK3和NF-κB p65的mRNA和蛋白相对表达水平差异无统计学意义。与C 组和N 组相比,H 组RIPK1、RIPK3和NF-κB p65的mRNA和蛋白相对表达水平升高(P<0.01)。与H 组相比,Nec-1 组肺组RIPK1、RIPK3和NF-κB p65的mRNA和蛋白表达明显下降(P<0.01),见图2、表3。
Tab.2 Comparison of the lung tissue wet-to-dry ratio and histopathologic scoring between four groups表2 各组肺组织W/D及肺组织病理学评分比较(n=10,±s)

Tab.2 Comparison of the lung tissue wet-to-dry ratio and histopathologic scoring between four groups表2 各组肺组织W/D及肺组织病理学评分比较(n=10,±s)
组别肺组织W/D 肺组织病理学评分(分)C组N组H组Nec-1组F t 4.89±0.50 4.99±0.82 7.94±0.80ab 6.21±0.52 57.983*5.739*2.41±0.23 2.49±0.31 4.89±0.35ab 3.85±0.44 221.208*5.884*
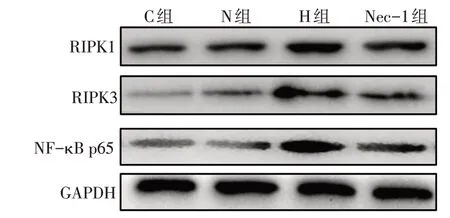
Fig.2 Expressions of related proteins in lung tissue in four groups图2 各组肺组织相关蛋白表达情况
3 讨论
机械通气可导致VILI,继而可发展为急性呼吸窘迫综合征(ARDS)[6]。其机制主要是由于机械通气导致的机械损伤和生物损伤共同影响的结果,异常的机械牵拉作用于肺组织内,可激活相关信号传导,引起炎症介质的释放和细胞死亡的增加,导致肺部及全身的炎症反应[7]。本课题组以往研究发现,大鼠经过40 mL/kg 的潮气量机械通气后,过度机械牵张导致了线粒体自噬激活和线粒体DNA逃逸,机械通气介导了VILI 的发生,提示细胞凋亡和自噬存在于VILI 的发病过程中;而程序性坏死是细胞死亡方式,这一调控途径包含:RIPK1和RIPK3激酶相关作用形成坏死复合体,从而导致细胞坏死,细胞膜破裂,细胞内容物释放,作为损伤相关的分子模式加重炎症反应的程度,影响炎症消退[8],但程序性坏死在VILI的发病过程中作用及其机制尚不清楚。

Tab.3 Comparison of related genes and proteins in lung tissue between four groups表3 各组肺组织相关基因和蛋白表达比较
Nec-1 可特异性抑制RIPK1,进而抑制程序性坏死的发生。既往研究发现,Nec-1能促进炎症的消退,可能是炎症性疾病潜在的治疗性药物,它不仅可以是程序性坏死的抑制剂,也可以促进炎症过程中性粒细胞的凋亡,从而影响炎症消退[9]。研究证实,Nec-1能减少缺血/再灌注对脏器的损伤[10];对脂多糖诱导肺损伤[11]和新生儿脓毒症相关肺损伤具有保护作用[12];也可减少脓毒症相关的急性肾损伤[13]。本研究结果显示,与自主呼吸组比较,高潮气量组(40 mL/kg)BALF 中总细胞数、总蛋白和炎性因子IL-6、IL-1β、TNF-α水平增高,肺组织W/D 和肺组织病理学评分增高,肺组织内RIPK1、RIPK3 mRNA和蛋白相对表达水平上调,表明大鼠经40 mL/kg 的潮气量机械通气4 h后,肺泡结构紊乱,肺泡壁萎陷,肺泡内大量炎症细胞浸润,肺间隔增宽,机械通气导致肺损伤,其损伤机制可能与RIPK1/RIPK3/NF-κB 信号传导通路激活有关。另外,与高潮气量组比较,Nec-1 组BALF 中总细胞数、总蛋白和炎性因子IL-6、IL-1β、TNF-α水平降低,肺组织W/D和肺组织病理学评分降低,肺组织内RIPK1、RIPK3 mRNA 和蛋白表达下调,表明Nec-1 可以降低大鼠VILI 动物模型BALF 中总细胞数、总蛋白和炎性因子水平,减低肺组织的W/D和肺组织的病理学评分,降低高潮量导致的肺损伤,提示其可能与RIPK1/RIPK3/NF-κB 信号传导通路的抑制有关。笔者推测在机械通气肺损伤过程中Nec-1可通过抑制RIPK1和RIPK3的表达,抑制NF-κB的激活,从而减轻肺损伤的程度,对VILI具有一定保护作用。
