沉默hnRNP A2/B1基因后通过Bcl-2/Bax影响宫颈癌CaSki细胞的凋亡
2019-10-11蔡僮许修颖方文
蔡僮,许修颖,方文
在发展中国家,宫颈癌是女性癌症致死的第三大原因,2018 年全球大约有569 847 例宫颈癌新发病例及311 365例死亡病例[1],而且晚期宫颈癌转移患者预后较差,中位生存期仅为8~13个月[2]。在传统治疗手段效果不理想的情况下,利用当前技术寻找与宫颈癌相关的新型分子标志物及治疗靶点变得迫在眉睫。核内不均一核糖核蛋白A2/B1(Heterogeneous nuclear ribonucleoprotein A2 / B1,hnRNP A2/B1)是一种RNA结合蛋白,由A2及B1两种蛋白以适宜比例相结合,在细胞的胞质和胞核中均可表达,但是在不同组织和不同类型细胞中表达水平不同[3]。作为一种新论证的致癌分子,hnRNP A2/B1在乳腺癌[4]、非小细胞肺癌[5]及食管鳞状细胞癌[6]中均呈过表达状态,且hnRNP A2/B1作为介导神经胶质瘤侵袭的关键分子,为神经胶质瘤的治疗提供了潜在的干预位点[7]。本课题组前期实验也证实了在宫颈癌CaSki 细胞中,洛铂处理细胞后hnRNP A2/B1 表达下降,凋亡增加[8]。本研究通过沉默hnRNP A2/B1基因后,探讨宫颈癌细胞部分生物学的变化及其可能的相关机制,为临床对宫颈癌的治疗寻找可能的基因位点及实验依据。
1 资料与方法
1.1 一般资料 宫颈癌CaSki 细胞株购自中国科学院细胞库;胎牛血清购自美国Gibco公司;RPMI-1640培养液购自美国Hyclone 公司;流式凋亡检测试剂盒购自南京凯基生物;SYBR Green PCR Master Mix 购自美国Biosystems 公司;Trizol、逆转录试剂盒购自天根生化科技(北京)有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)检测试剂盒、苯甲基磺酰氟(Phenylmethylsulfonyl fluoride,PMSF)、RIPA裂解液及BCA蛋白定量试剂盒购自碧云天生物技术公司;磷酸盐缓冲液(Phosphate buffer saline,PBS)、二甲基亚砜(Dimethylsulphoxide,DMSO)购自北京索莱宝生物公司;兔抗hnRNP A2/B1抗体购自美国Invitrogen 公司,SDS-PAGE 凝胶试剂盒、兔抗Bcl-2 和兔抗Bax 购自万类生物公司,兔抗βactin购自博奥森生物公司,辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自北京中杉金桥生物技术有限公司;超敏ECL化学发光试剂盒和PVDF膜购自美国MILLIPORE公司。
1.2 方法
1.2.1 沉默宫颈癌CaSki细胞中hnRNP A2/B1基因 慢病毒载体介导shRNA转染沉默宫颈癌CaSki细胞中hnRNP A2/B1已由课题组前期完成[9-10]。
1.2.2 细胞培养 根据课题组前期已构建好的基因沉默细胞,分为未沉默hnRNP A2/B1的空白组(CaSki组)、转染阴性序列的阴性对照组(CaSki-NC组)、转染阳性hnRNP A2/B1干扰序列的实验组(CaSki-shRNA组)。3组细胞均用含有10%胎牛血清、1%青/链霉素、1%L-谷氨酰胺的RPMI-1640培养液于37 ℃、5%CO2的细胞培养箱中培养。
1.2.3 实时荧光定量PCR(Quantitative real-time PCR,qRTPCR)检测hnRNP A2/B1mRNA表达情况 采用Trizol试剂盒提取RNA 并根据试剂说明步骤取1 μg 总RNA 逆转录为cDNA,依据SYBR Green PCR Master Mix 试剂盒说明书取2 μL cDNA 进行实时荧光定量反应。qRT-PCR 引物:β-actin,上游5´- GTCTCCTCTGACTTCAACAGCG-3´,下游5´- ACCACCCTGTTGCTGTAGCCAA-3´;hnRNP A2/B1,上游5´-GATGGCAGAGAACGGTGTGAAG-3´,下游5´-AGGCATAGGTATTGGCAACTGC-3´。反应条件:95 ℃10 min;95 ℃15 s,60 ℃1 min;40次循环,结果以2-ΔΔCt值表示。
1.2.4 MTT实验检测细胞增殖情况 取对数生长期的CaSki组、CaSki-NC组及CaSki-shRNA组细胞用0.25%的胰酶消化悬浮后稀释至5×104/mL,以每孔200 μL接种至96孔板中,摇匀后放入37 ℃、5%CO2培养箱,每组细胞又分为培养12 h、24 h及48 h亚组,相应时点后每孔加入含10 μL MTT 的培养液继续于培养箱中培养4 h,而后去除MTT 培养液并每孔加入150 μL 的DMSO 充分震荡反应后于酶标仪上检测490 nm波长处光密度(OD)值。
1.2.5 平板克隆实验检测细胞增殖能力 以0.25%胰酶消化3组对数生长期细胞制备单细胞悬液,以每孔500 个细胞接种至6孔板中并用RPMI-1640完全培养基于37 ℃、5%CO2培养箱中持续培养2周。去除上清培养液并用PBS清洗2次后用4%的多聚甲醛固定15 min,龙胆紫染液染色30 min,然后用流水缓慢洗去染色液,空气干燥,在显微镜(低倍镜)计数大于50 个细胞的克隆数。克隆形成率=克隆数/接种细胞数×100%。
1.2.6 流式细胞检测细胞凋亡 将各组对数生长期细胞消化稀释至5×104/mL 并接种至6 孔板过夜,取5×105个细胞并用缓冲液悬浮成单细胞悬液,之后取5 μL Annexin APC 和5 μL PI 染液避光染色15 min,以流式细胞仪检测细胞凋亡变化。
1.2.7 蛋白印迹(Western blot)检测hnRNP A2/B1、Bax、Bcl-2的表达 用含有1%PMSF的RIPA裂解液于冰上裂解各组细胞并在预冷的4 ℃离心机上以12 000 r/min 离心20 min,收集上清蛋白液分装保存于-80 ℃。用BCA 法测定提取的蛋白浓度,SDS-PAGE 凝胶电泳分离目的蛋白并将蛋白转入PVDF 膜,5%脱脂奶粉封闭液封闭PVDF 膜2 h。4 ℃过夜孵育兔抗β-actin(1∶6 000)、兔抗Bcl-2(1∶500)、兔抗Bax(1∶500),兔抗hnRNP A2/B1(1∶1 000),次日TBST 洗膜3 次,将PVDF膜在山羊抗兔二抗(1∶90 000)中室温孵育1 h。ECL显影并曝光,Image J 1.51软件分析灰度值。
1.3 统计学方法 采用SPSS 22.0软件进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较应用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 验证hnRNP A2/B1沉默效率 与CaSki 组比较,CaSki-shRNA 组hnRNP A2/B1的mRNA 及蛋白表达水平均明显减低(P<0.01),而CaSki 组和CaSki-NC组差异无统计学意义,见图1、表1。
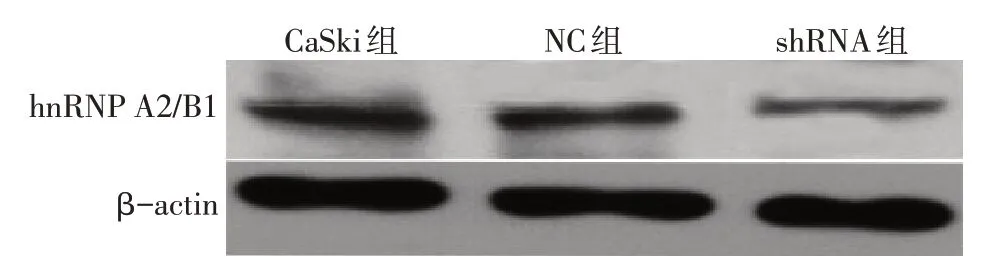
Fig.1 Expression of hnRNP A2/B1 protein after transfection图1 转染后hnRNP A2/B1蛋白表达情况
Tab.1 Relative expression levels of hnRNP A2/B1 after transfection in three groups表1 转染后3组hnRNP A2/B1 mRNA和蛋白相对表达量(±s)

Tab.1 Relative expression levels of hnRNP A2/B1 after transfection in three groups表1 转染后3组hnRNP A2/B1 mRNA和蛋白相对表达量(±s)
**P<0.01;a与CaSki组比较,b与CaSki-NC组比较,均P<0.01
组别CaSki组CaSki-NC组CaSki-shRNA组F n3 3 3 hnRNP A2/B1 mRNA 1.00±0.04 0.96±0.07 0.44±0.02ab 124.342**hnRNP A2/B1 蛋白0.69±0.08 0.67±0.03 0.42±0.05ab 19.759**
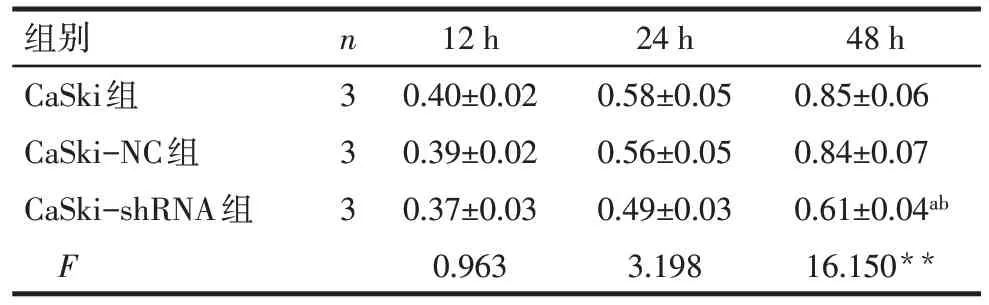
2.2 沉默hnRNP A2/B1对CaSki 细胞增殖的影响 MTT 法检测结果显示,在48 h 时间点,与CaSki组相比,CaSki-shRNA 组OD值明显降低(P<0.01),细胞增殖能力减弱,而CaSki 组和CaSki-NC 组差异无统计学意义,见表2。
Tab.2 Comparison of CaSki cell proliferation between three groups表2 各组CaSki细胞增殖情况比较 (OD值,±s)
Tab.2 Comparison of CaSki cell proliferation between three groups表2 各组CaSki细胞增殖情况比较 (OD值,±s)
组别CaSki组CaSki-NC组CaSki-shRNA组F n3 3 3 12 h 0.40±0.02 0.39±0.02 0.37±0.03 0.963 24 h 0.58±0.05 0.56±0.05 0.49±0.03 3.198 48 h 0.85±0.06 0.84±0.07 0.61±0.04ab 16.150**
2.3 沉默hnRNP A2/B1对CaSki 细胞克隆形成能力的影响 CaSki 组、CaSki-NC 组、CaSki-shRNA 组的克隆形成率分别为(90.80±3.80)%、(82.23±5.69)%、(45.37±4.97)%,组间比较差异有统计学意义(n=3,F=73.361,P<0.01),其中CaSki-shRNA 组与CaSki组、CaSki-NC组比较克隆形成率降低,而CaSki组和CaSki-NC组差异无统计学意义(P>0.05),见图3。
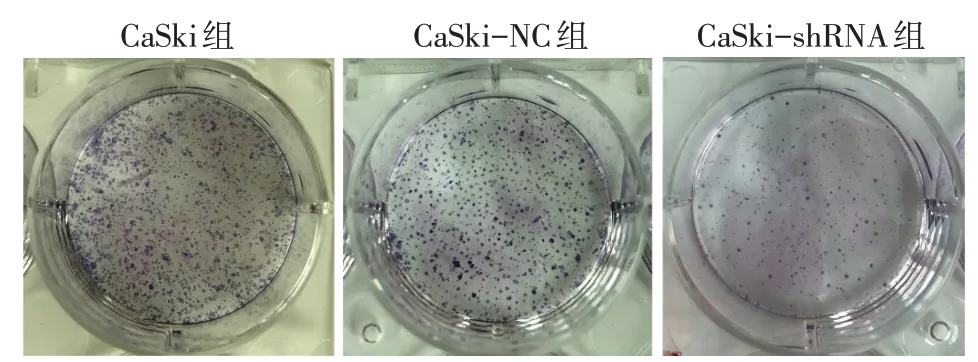
Fig.3 Detection of clone forming ability by plate clone experiment图3 平板克隆实验检测克隆形成能力
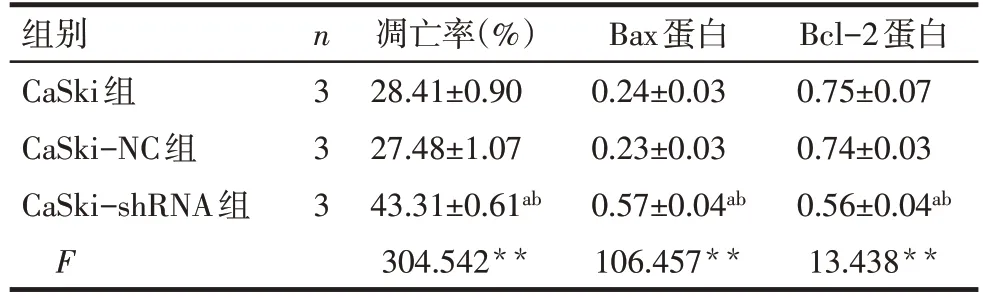
2.4 沉默hnRNP A2/B1对CaSki 细胞凋亡的影响 流式细胞结果显示,与CaSki 组及CaSki-NC 组相比,CaSki-shRNA 组凋亡率明显增加(P<0.01),Western blot结果也显示其凋亡相关蛋白Bcl-2表达减低,Bax 表达增加(P<0.01),而CaSki 组和CaSki-NC组差异无统计学意义,见表3,图4。
Tab.3 The apoptosis rate and protein expressions of bax and bcl-2 in three groups表3 各组凋亡率及Bax和Bcl-2蛋白表达情况 (±s)
Tab.3 The apoptosis rate and protein expressions of bax and bcl-2 in three groups表3 各组凋亡率及Bax和Bcl-2蛋白表达情况 (±s)
**P<0.01:a与CaSki组比较,b与CaSki-NC组比较,P<0.01
组别CaSki组CaSki-NC组CaSki-shRNA组F n3 3 3凋亡率(%)28.41±0.90 27.48±1.07 43.31±0.61ab 304.542**Bax蛋白0.24±0.03 0.23±0.03 0.57±0.04ab 106.457**Bcl-2蛋白0.75±0.07 0.74±0.03 0.56±0.04ab 13.438**
3 讨论
宫颈癌是当前全球对女性威胁最大的恶性肿瘤之一,其发病率居我国四大恶性肿瘤的第二位[11]。正是由于宫颈癌在女性肿瘤中的高发病率,因此目前也有许多关于寻找与宫颈癌致病相关的基因位点的研究,期望在分子水平上对宫颈癌进行干预。随着对hnRNP A2/B1基因的相关研究的深入,逐渐发现了其与部分肿瘤存在着密切关系,但hnRNP A2/B1与宫颈癌的关系目前研究报道甚少,因此本研究通过沉默宫颈癌CaSki 细胞hnRNP A2/B1基因后探索其对增殖、凋亡的影响及其可能的相关作用机制。
核不均一核糖核蛋白(hnRNP)家族包含超过20种RNA结合蛋白,大部分结合于内含子与外显子的剪接序列而参与调控作用,其在mRNA转录、剪接过程中起着重要的作用[12-13]。hnRNP A2/B1是一种多功能RNA结合蛋白[14]。在对乳腺癌的研究中发现,长链非编码RNAHOTAIR与hnRNP A2/B1之间存在着特异性相互作用,hnRNP A2/B1是HOTAIR介导的乳腺癌细胞染色质调控的关键因素[15]。本次研究验证了课题组前期建立的稳定沉默hnRNP A2/B1的CaSki细胞中的hnRNP A2/B1的表达情况,qRT-PCR和Western blot 结果显示,与CaSki组及CaSki-NC 组相比,CaSki-shRNA组细胞中hnRNP A2/B1的mRNA及蛋白表达水平明显降低,表明hnRNP A2/B1基因的沉默效果仍然稳定存在。在MTT 实验中,CaSkishRNA 组培养48 h 后细胞增殖能力较CaSki 组及CaSki-NC组明显降低,且在平板克隆实验中CaSkishRNA 组的克隆形成率也较CaSki 组、CaSki-NCz 组明显降低,表明沉默hnRNP A2/B1的表达可抑制CaSki 细胞的生长,这与Li 等[16]发现的沉默hnRNP A2/B1的表达后明显抑制肺癌细胞的生长的结果一致,提示hnRNP A2/B1与宫颈癌发生发展相关。
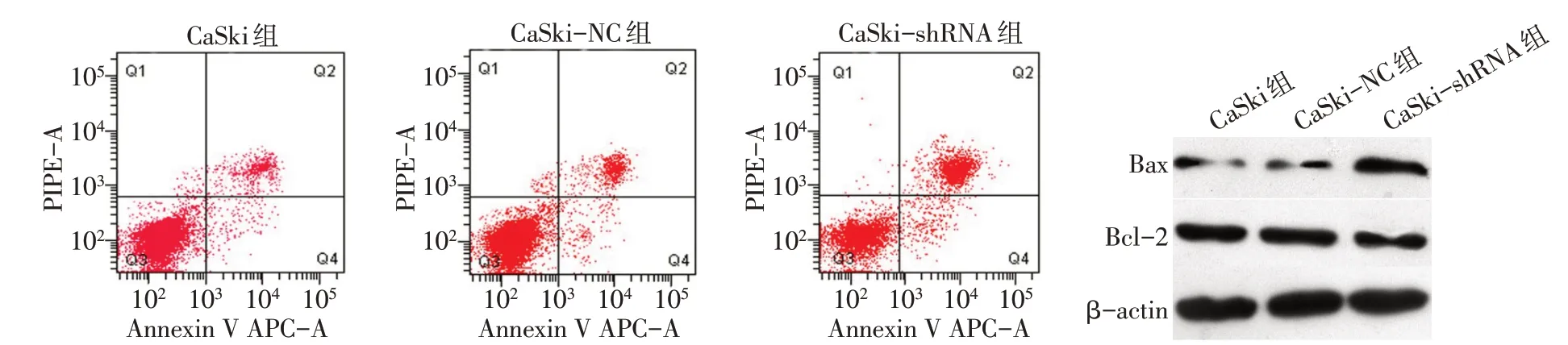
Fig.4 Detection of apoptosis by flow cytometry and Western blot assay图4 流式细胞术及Western blot检测凋亡相关变化
本研究显示,hnRNP A2/B1 与宫颈癌细胞的凋亡同样存在调控关系,因此本研究重点检测了凋亡相关蛋白Bcl-2、Bax 的表达变化。该凋亡蛋白家族主要包含促进凋亡蛋白Bax 及抑制凋亡蛋白Bcl-2及其各自的亚基。研究表明,由于p53 肿瘤抑制因子突变会导致BH3 结构域中蛋白的信号转导受损,Bcl-2 过表达可触发细胞凋亡[17]。Bax 主要存在于细胞质中,通过调控DNA 损伤、蛋白质错误折叠等方式触发线粒体内细胞色素C 的释放,进而激活半胱天冬酶级联反应,从而诱导细胞调亡[18]。Bcl-2/Bax 已被证明参与调控了许多肿瘤的凋亡变化,在对铂耐药卵巢癌细胞的研究发现,利用siRNA 沉默Bcl-2基因或蛋白酶抑制剂abt-737阻断Bcl-2的表达均可使顺铂诱导的MCS 细胞凋亡增强[19]。本研究Western blot 结果显示,沉默宫颈癌CaSki 细胞中hnRNP A2/B1后,其凋亡相关蛋白Bcl-2 表达减低,Bax 表达增加,流式细胞术的结果显示其凋亡率明显增加,表明沉默hnRNP A2/B1的表达可促进CaSki细胞的凋亡,提示沉默宫颈癌细胞中hnRNP A2/B1后可能是通过抑制Bcl-2 及升高Bax 来介导细胞的凋亡。这与Deng等[20]在胶质瘤中研究结果一致,该研究发现沉默hnRNP A2/B1能诱导胶质瘤细胞发生凋亡。
综上所述,本研究通过沉默宫颈癌细胞中hnRNP A2/B1基因后的体外相关研究表明,沉默hnRNP A2/B1基因后能抑制宫颈癌细胞的增殖能力且可能通过Bcl-2/Bax 介导宫颈癌CaSki 细胞的凋亡,这将为宫颈癌的分子靶向治疗提供新的思路。
