番石榴叶总黄酮对糖尿病大鼠肾脏Nrf2/HO-1信号通路的影响
2019-10-11高飞曾瑞霞姜东
高飞,曾瑞霞,姜东△
糖尿病肾病(diabetic nephropathy,DN)以肾小球病变为基础,可引起肾功能损害和障碍[1-2]。氧化应激为DN 的重要发病机制之一,核因子NF-E2 相关因子(nuclear factor erythroid-2-related factor-2,Nrf2)与氧化应激密切相关,激活Nrf2/HO-1 信号可以防治DN[3-4]。番石榴叶提取物之一番石榴叶总黄酮(total flavones of psidium guajava leaves,TFPGL)因具有降低血糖及强大的抗氧化应激的作用被逐步应用于糖尿病合并症的防治[5-6]。然而,TFPGL 对DN的作用机制尚不清楚。本研究拟观察TFPGL 对DN的影响,为DN的防治提供新的可能药物。
1 材料与方法
1.1 材料
1.1.1 动物分组及模型制备 SPF 级雄性SD 大鼠24 只,体质量180~220 g,购自锦州医科大学。将大鼠按随机数字表法分成对照组、糖尿病组、TFPGL 治疗组,每组8 只。后2组大鼠正常饮食3 d 后,隔夜禁食水,配制1.5 g/L 链脲佐菌素(Streptozotocin,STZ)溶液(55 mg/kg)腹腔给药。给药3 d 后检测血糖,将血糖大于16.7 mmol/L的大鼠定为糖尿病大鼠模型,造模成功率为93.8%,造模未成功者于3 d 后小剂量(30 mg/kg)STZ 再次注射直到造模成功。模型诱导成功后,依据文献[7],TFPGL 治疗组给予TFPGL 灌胃治疗(200 mg/kg),将TFPGL 溶于2 mL PBS 中,每日2 次。对照组、糖尿病组给予等剂量PBS。12 周后,进行各项指标检测,实验遵循国家《实验动物管理条例》。
1.1.2 试剂及仪器 STZ(美国Sigma 公司);TFPGL(纯度98%,西安瑞恩生物科技有限公司);Nrf2一抗(兔抗大鼠)、血红素氧合酶-1(heme oxygenase-1,HO-1)一抗(兔抗大鼠)、GAPDH(小鼠抗大鼠)一抗(英国Abcam 公司);HE染色试剂盒、荧光二抗及Western blot 二抗(北京碧云天公司);荧光倒置显微镜(日本Olympus 公司);石蜡切片机(德国SLEE 公司);水平电泳仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 样本制备 12周后,每组取4只大鼠,4%多聚甲醛固定后摘除肾脏,石蜡包埋、切片,常温保存,用于HE 染色、免疫荧光、免疫组织化学染色。另每组取4只大鼠取肾脏,依据质量加蛋白裂解液,冰上剪碎,4 ℃离心25 min 后取上清液,-20 ℃保存用于Western blot检测。
1.2.2 大鼠血糖(BS)、血尿素氮(BUN)、尿蛋白/尿肌酐比值(ACR)及血清肌酐(SCr)指标检测 分别于实验的第4、8、12周末采集尾静脉血测定大鼠血糖,于12周末取材前心脏取血3 mL左右,离心后留取血清,用于检测BUN、ACR及SC含量。
1.2.3 大鼠肾脏HE染色 切片脱蜡后浸于PBS洗涤3次,每次3 min;滴加苏木素,2 min;PBS 中1 min,自来水冲洗;95%乙醇1 min;伊红浸染,2 min,自来水冲洗;脱水透明后封片,拍照观察。
1.2.4 免疫荧光检测大鼠肾脏Nrf2表达 脱蜡步骤同上,切片浸于PBS 洗涤3 次,每次3 min;3%山羊血清+0.3% Triton X-100室温孵育1 h;不洗,滴加兔抗大鼠Nrf2(1∶500),4 ℃过夜;PBS 洗涤4 次,每次3 min;滴加荧光二抗,室温避光1 h;PBS洗涤4次,每次3 min;封片后荧光显微镜观察。
1.2.5 免疫组织化学染色检测大鼠肾脏HO-1表达 脱蜡步骤同上,切片于PBS 洗涤3 次,每次5 min;3%H2O2室温10 min,PBS洗涤3次,每次3 min;3%山羊血清室温孵育30 min;不洗,滴加兔抗大鼠HO-1(1∶800),4 ℃过夜;PBS洗涤3次,每次3 min;滴加二抗,室温30 min;PBS洗涤3次,每次3 min;滴加SABC试剂,室温30 min;PBS洗涤3次,每次3 min;DAB显色,复染、脱水、透明封片后显微镜拍照,并应用Image J软件分析HO-1表达阳性率。
1.2.6 Western blot 检查大鼠肾脏Nrf2、HO-1 相对表达水平 BCA法测定蛋白浓度,确定电泳时加入10 μL样品;电泳后半干转膜后取目的条带,1%BSA 室温封闭2 h;加入一抗(兔抗大鼠Nrf2,1∶5 000;兔抗大鼠HO-1,1∶10 000),4 ℃孵育过夜;TBST 洗涤4 次,每次5 min;加入二抗室温2 h,孵育后TBST洗涤4次,每次5 min;ECL试剂盒显影,以GAPDH为内参,Image J软件分析灰度值,计算Nrf2、HO-1与GAPDH灰度值的比值。
1.3 统计学方法 采用SPSS 20.0 统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组间多重比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠BS、BUN、ACR 及SCr 的变化 与对照组相比,糖尿病组血糖明显升高(P<0.01),说明造模成功,BUN、ACR 和SCr 亦明显升高(P<0.05)。而与糖尿病组相比,TFPGL治疗组BS、BUN、ACR和SCr均不同程度下降(均P<0.05),见表1。
Tab.1 Comparison of BS,BUN,ACR and SCr values between the three groups表1 3组BS、BUN、ACR和SCr比较 (n=8,±s)

Tab.1 Comparison of BS,BUN,ACR and SCr values between the three groups表1 3组BS、BUN、ACR和SCr比较 (n=8,±s)
**P<0.01;a与对照组相比,b与糖尿病组相比,P<0.01;表2同
组别对照组糖尿病组TFPGL治疗组F BS(mmol/L)4.31±0.17 21.61±1.87a 17.82±0.68b 499.93**BUN(mmol/L)6.22±0.55 17.68±0.76a 13.39±0.55b 675.07**ACR(μg/mg)113.45±3.71 322.56±6.52a 189.40±6.84b 2 610.54**SCr(μmol/L)27.45±0.93 46.40±1.18a 35.48±1.28b 559.34**
2.2 HE染色检测大鼠肾脏形态学变化 光镜结果显示,对照组肾组织基本正常;与对照组相比,糖尿病组肾小球体积增大,细胞外基质增生,并可见肾小管上皮细胞水肿;而与糖尿病组相比,TFPGL治疗组上述变化有所改善,见图1。
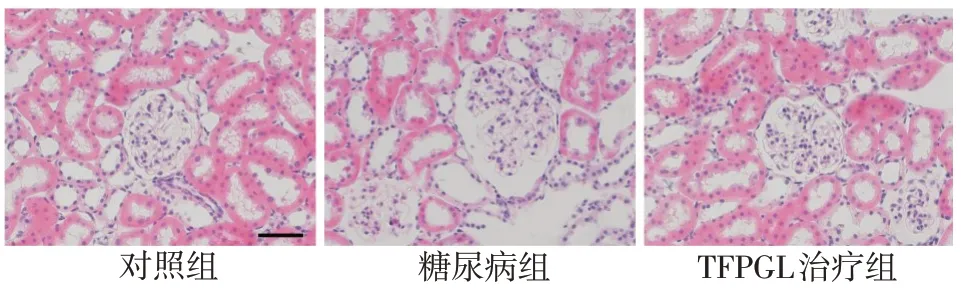
Fig.1 Morphological observation of kidneys(HE staining,×400)图1 肾脏形态学观察(HE染色,×400)
2.3 免疫荧光染色检测结果 将对照组大鼠肾脏Nrf2 荧光强度设定为100%,荧光强度分析结果显示,与对照组比较,糖尿病组Nrf2荧光强度有所增加(P<0.05);而与糖尿病组比较,TFPGL 治疗组明显增加(P<0.05),见表2、图2。
Tab.2 Comparison of expressions of Nrf2 and HO-1 between the three groups表2 各组大鼠肾脏Nrf2、HO-1表达比较(n=4,%,±s)

Tab.2 Comparison of expressions of Nrf2 and HO-1 between the three groups表2 各组大鼠肾脏Nrf2、HO-1表达比较(n=4,%,±s)
组别对照组糖尿病组TFPGL治疗组F Nrf2荧光强度100.00±0.00 125.25±1.77a 162.98±2.14b 1 566.87**HO-1阳性率31.51±0.59 17.77±0.87a 38.90±0.67b 896.87**Nrf2 12.94±0.70 15.95±0.61a 22.61±1.01b 155.06**HO-1 23.47±0.37 18.00±0.60a 25.58±0.78b 167.517**
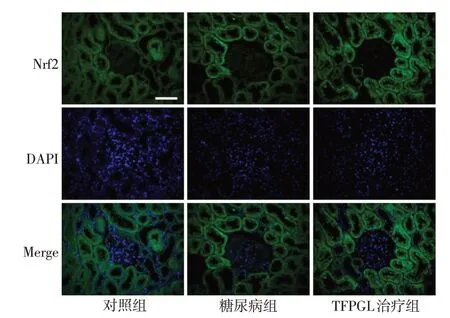
Fig.2 The expressions of renal Nrf2(immunofluorescence staining,×400)图2 肾脏Nrf2表达变化(免疫荧光染色,×400)
2.4 免疫组织化学染色检测结果 与对照组相比,糖尿病组HO-1 表达明显降低(P<0.05);与糖尿病组相比,TFPGL 治疗组明显增加(P<0.05),见表2、图3。
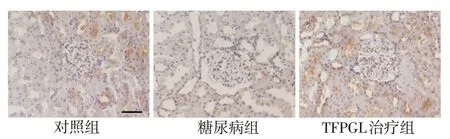
Fig.3 The expressions of renal HO-1(Immunohistochemical staining,×400)图3 肾脏HO-1表达变化(免疫组织化学染色,×400)
2.5 Western blot检测结果 与对照组相比,糖尿病组Nrf2 表达有所增加,HO-1 表达明显降低(P<0.05);与糖尿病组相比,TFPGL 治疗组Nrf2 表达明显增加,HO-1 表达明显增加(P<0.05),见表2、图4。
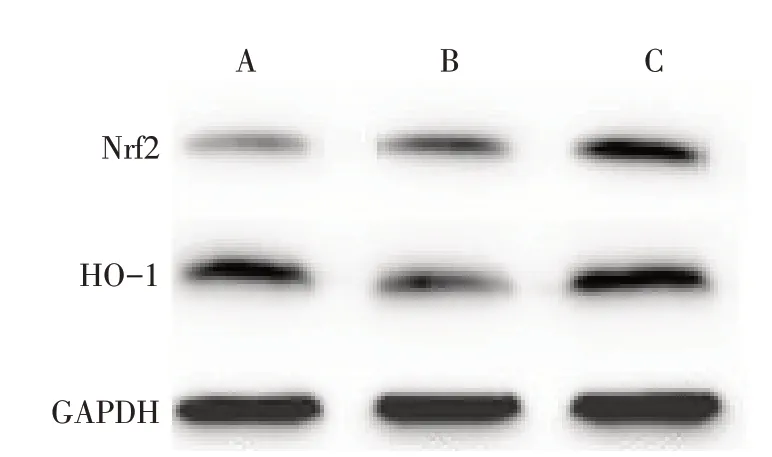
Fig.4 The relative expressions of renal Nrf2 and HO-1 detected by Western blot assay图4 Western blot 检测Nrf2、HO-1蛋白相对表达
3 讨论
Diabetes Atlas 第七版中国区统计数据得出,2015年中国糖尿病(20~79岁)患者数量较2013年增加1 120万,达1.096亿,已居全球首位[8]。随糖尿病病程的延长,可引起DN。DN 状态下,高血糖、炎症因子等可引起活性氧族(ROS)堆积,进而加重DN[9-10],而外源性给予抗氧化应激药物可对DN 产生保护作用及减缓DN的发生发展[11-12]。
TFPGL为番石榴叶的提取物,具有调节血糖、缓解氧化应激损伤等多种生物学活性。蔡丹昭等[6]研究发现,TFPGL可有效降低STZ糖尿病小鼠血糖,且随着给药时间的延长,降血糖效果明显增加。笔者推测TFPGL对DN会有一定的治疗效果。本研究首先诱导建立糖尿病模型,12周后对反映肾功能的相关指标进行了检测,结果显示糖尿病组BS、BUN、ACR、SCr 均明显升高,而给予TFPGL 治疗后,大鼠血糖有所下降,BUN、ACR、SCr 均有所降低,说明TFPGL 对DN 的防治效果明显,这可能与TFPGL 的降血糖作用有关。
Nrf2 可与抗氧化反应元件(antioxidant response element,ARE)结合,上调HO-1的表达,进而提高组织的抗氧化能力[13-14]。近年来研究发现,Nrf2 信号通路对包括DN 在内的多种以氧化应激为主要发病机制的疾病都具有保护作用。氧化应激增强时,Kelch 样环氧氯丙烷相关蛋白1(Kelchlike ECH associatedprotein 1,Keap1)发生构象改变,Nrf2 与Keapl 解离,进一步与ARE 靶向结合,启动基因转录,可上调HO-1等的表达,从而拮抗体内的氧化应激反应[15-16]。Tidke等[17]研究发现,激活Nrf2信号通路后可减轻四氧嘧啶诱导的糖尿病小鼠肾功能不全、降低氧化应激水平。而本研究结果显示,DN 状态下大鼠肾脏Nrf2 表达增加,这可能为DN 时肾脏对抗氧化应激的适应性反应[18],然而HO-1表达却明显下降,这可能与DN时氧化应激反应过度消耗了通过机体自身的Nrf2/HO-1通路激活而增加的HO-1,进而引起氧化应激损伤有关。而给予TFPGL 治疗后,大鼠肾脏Nrf2、HO-1表达明显增加,提示TFPGL在一定程度上可以激活Nrf2 的表达,上调HO-1 的表达,进而对抗大鼠DN状态下氧化应激损伤。
综上所述,TFPGL 对糖尿病大鼠肾脏病变具有一定的治疗效果,其机制可能与降低血糖和激活Nrf2/HO-1信号通路有关。当然,DN发病机制复杂,TFPGL对DN的防治效果有待进行深入探讨。
