TGF-β1对结直肠癌细胞株侵袭转移及IL-22表达的影响
2019-10-11阮洪训秦晓宁黄炜李猛赵晶任鹏涛郝英豪林林
阮洪训,秦晓宁,黄炜,李猛,赵晶,任鹏涛,郝英豪,林林
近年来,结直肠癌在全球的发病率和死亡率呈逐年上升趋势,是常见的消化道肿瘤之一,威胁着人类的健康。2014 年WHO 在《世界癌症报告》中公布,结直肠癌发病率位居第3 位,死亡率位居第4位[1]。在我国,结直肠癌发病率仅次于肺癌和胃癌位居第3 位,死亡率仅次于肺癌、肝癌、胃癌和食管癌位居第5位[2]。近年来,结直肠癌的危险因素及其发生发展机制已引起人们的高度重视。有研究报道转化生长因子β1(TGF-β1)和白细胞介素-22(IL-22)与结直肠癌的发生发展密切相关,并在结直肠癌的转移中发挥着重要的作用,TGF-β1可能通过间接或直接刺激肿瘤血管形成进而促进肿瘤的浸润转移[3];IL-22可能通过调控信号转导和转录激活因子3(STAT3)信号通路进而促进肿瘤细胞的增殖和迁移[4]。本研究以结直肠癌HCT116 细胞株为研究对象,探讨TGF-β1对结直肠癌细胞侵袭转移和IL-22蛋白表达的影响及其作用机制,为结直肠癌的防治提供理论依据。
1 材料与方法
1.1 一般资料 结直肠癌HCT116 细胞株购自上海中乔新舟生物科技有限公司;TGF-β1 人重组蛋白购自北京义翘神州生物技术有限公司;IL-22 抗体、TGF-β1 抗体、E-钙黏蛋白(E-cadherin)抗体购自英国Abcam 公司;STAT3 抗体购自美国Antibody revolution 公司;内参GAPDH 抗体购自北京博奥森生物技术有限公司;CCK-8 试剂盒购自日本Dojindo Laboratories 公司;Transwell 小室购自美国Corning 公司;Matrigel 基质购自北京全式金生物技术有限公司;1%结晶紫染液购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 细胞培养 细胞培养条件:用含90%DMEM 高糖+10%FBS+1%双抗的培养基,在37 ℃、5%CO2饱和湿度条件下培养,每2~3 d传代1次。实验用细胞均处于对数生长期。
1.2.2 CCK-8法测定HCT116细胞增殖情况 通过倒置显微镜观察HCT116 细胞生长状态并放置超净工作台内,经过无菌PBS冲洗、0.25%胰酶消化、离心,按照35个孔计算细胞数量,接种于96 孔细胞培养板中,每孔100 μL约5 000 个细胞,37 ℃、5%CO2孵育过夜;每个板分别设置对照孔及5、10、15、20、30、50 μg/L TGF-β1 处理孔,每组设定5 个复孔,37 ℃、5%CO2细胞培养箱孵育24、48 h;每孔加入10 μL CCK-8 溶液,37 ℃孵育3 h;采用酶标仪检测450 nm 波长下光密度(OD)值。
1.2.3 实验分组 将实验对象分为对照组(DMEM培养液)、TGF-β1处理组(DMEM+10 μg/L TGF-β1),各组加药处理48 h后,收集细胞进行检测。
1.2.4 Transwell 检测HCT116 细胞侵袭、迁移能力 在Transwell 侵袭小室底部铺一层Matrigel 基质胶,放入24 孔培养板中,上室中加入5×104个细胞稀释于200 μL无血清培养基中,下室加入600 μL 含10%血清的完全培养基;放入37 ℃、5%CO2恒温培养箱中孵育48 h,小心用棉签擦拭基质胶和上室细胞,使用结晶紫染色下室细胞,显微镜下随机取中央及四周5 个400 倍视野,观察并计数穿透Transwell 膜的细胞数,实验重复3 次。Transwell 迁移实验除小室底部不需铺Matrigel基质胶外,其他实验方法同Transwell侵袭实验,实验亦重复3次。
1.2.5 划痕实验检测HCT116细胞迁移能力 取对数生长期HCT116 细胞,消化离心(1 000 r/min,5 min),重悬至2×105mL,将细胞接种于6孔板中,培养过夜后用200 μL枪头在培养板孔内划横线,PBS冲洗3次,加入无血清培养基和10 μg/L TGF-β1,每组设置3个复孔,培养48 h后在显微镜下观察拍照,使用Image-pro Plus 6.0软件分别测量处理前和处理后细胞划痕边界的距离,细胞迁移率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.2.6 RT-PCR 检测HCT116 细胞中TGF-β1、IL-22 mRNA表达 收集实验组和对照组细胞,采用Trizol 一步法从HCT116 细胞中提取总RNA,采用反转录试剂盒反转录为cDNA,取反转录产物2 μL 作为模板,以GAPDH 为内参进行PCR 扩增。TGF-β1 和IL-22 部分片段的引物采用Premier 5.0 软件进行设计。GAPDH 引物:上游5´-ACCACAGTCCATGCCATCAC-3´,下游5´-AGCCAGTTGTAGGCTCATCCA-3´,扩增片段452 bp。TGF-β1 引物:上游5´-GGACACCAACTATTGCTTCAG-3´ ,下游5´-TCCAGGCTCCAAATGTAGG-3´,扩增片段160 bp。IL-22 引物:上游5´-AGCTCCAGGTCAACCGCACCTA-3´,下游5´-GCCCAGGTGGGAACGCAAATCA-3´,扩增片段124 bp。反应条件:95 ℃预变性5 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸60 s,共40个循环;最后72 ℃延伸10 min,4 ℃、-20 ℃保存;1.5%琼脂糖凝胶电泳检测扩增结果。应用Image J 图像分析软件计算各样本条带与内参条带的灰度值比值。
1.2.7 免疫细胞化学染色检测HCT116 细胞中TGF-β1、IL-22、E-cadherin 蛋白表达 各组细胞爬片,PBS 清洗3 次,4%多聚甲醛固定10 min,Triton X-100孵育20 min,3%过氧化氢溶液室温孵育15 min,血清工作液封闭30 min,一抗孵育4 ℃过夜,PBS代替一抗作阴性对照,二抗孵育30 min,DAB显色,苏木精复染,封片。阳性反应为棕黄色或黄色颗粒。采用Image-ProPlus 6.0 图像分析软件,检测TGF-β1、IL-22 和E-cadherin 阳性细胞平均吸光度(A)值,以间接反映TGF-β1、IL-22和E-cadherin蛋白的表达量,并取其均值。
1.2.8 Western blot 检测HCT116 细胞中TGF-β1、IL-22、STAT3、E-cadherin 蛋白表达 细胞培养皿弃上清,PBS 清洗4 遍,刮取细胞;加入蛋白裂解液,震荡离心30 s,冰上静置5 min,重复4 次,12 000 r/min 离心15 min 后取上清液,BCA 法测定总蛋白浓度。100 ℃、10 min 煮蛋白变性、电泳、转膜,10%脱脂奶粉封闭1.5 h,加一抗4 ℃过夜,次日复温1 h,加二抗37 ℃震荡孵育1 h,TBST漂洗3次,加入超敏ECL化学发光剂显影。以GAPDH 为内参,采用Image J 图像处理系统计算各样本条带与内参条带的灰度值比值。
1.3 统计学方法 采用SPSS 22.0 进行统计学分析,计量资料采用均数±标准差(±s)表示,2组间样本均数比较采用t检验,多组间样本均数的比较采用方差分析。检验水准α=0.05。
2 结果
2.1 不同浓度TGF-β1 对HCT116 细胞增殖情况的影响 结果显示,不同浓度的TGF-β1 作用于HCT116 细胞24、48 h 后,各处理组OD 值差异均无统计学意义(均P>0.05),见表1。
Tab.1 Effects of different concentrations of TGF-β1 on proliferation of HCT116 cells表1 不同TGF-β1浓度对HCT116细胞增殖情况的影响(±s)
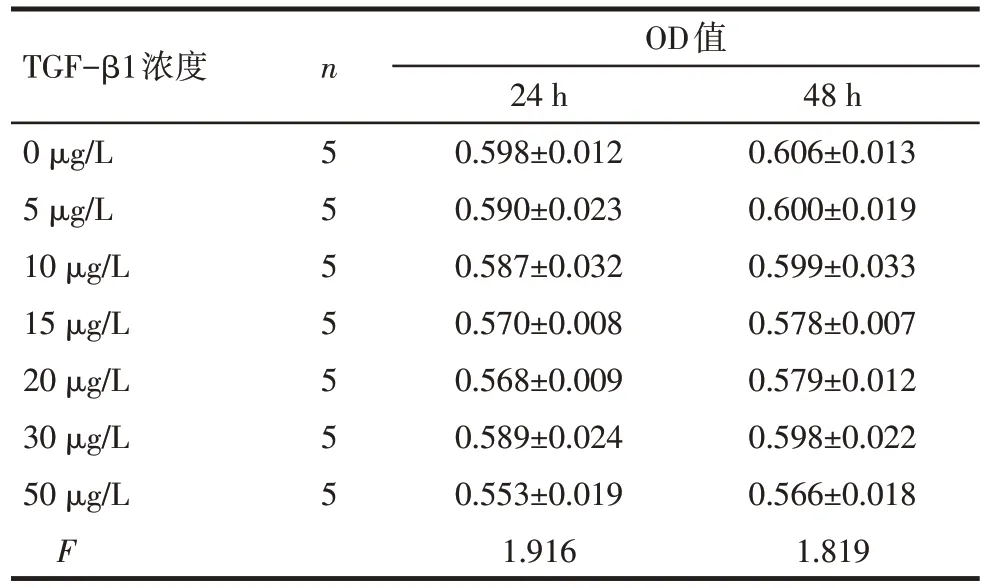
Tab.1 Effects of different concentrations of TGF-β1 on proliferation of HCT116 cells表1 不同TGF-β1浓度对HCT116细胞增殖情况的影响(±s)
均P>0.05
TGF-β1浓度0 μg/L 5 μg/L 10 μg/L 15 μg/L 20 μg/L 30 μg/L 50 μg/L F n5 5 5 5 5 5 5 OD值24 h 0.598±0.012 0.590±0.023 0.587±0.032 0.570±0.008 0.568±0.009 0.589±0.024 0.553±0.019 1.916 48 h 0.606±0.013 0.600±0.019 0.599±0.033 0.578±0.007 0.579±0.012 0.598±0.022 0.566±0.018 1.819
2.2 Transwell 实验检测TGF-β1 对HCT116 细胞侵袭、迁移能力的影响 侵袭实验结果显示,TGF-β1处理组穿过Transwell小室的细胞数多于对照组(个/视野:162.00±18.33vs.98.00±13.98,n=5,t=6.207,P<0.01),见图1。迁移实验结果显示,TGF-β1处理组穿过Transwell 小室的细胞数多于对照组(个/视野:232.40±25.62vs.99.40±12.78,n=5,t=10.388,P<0.01),见图2。
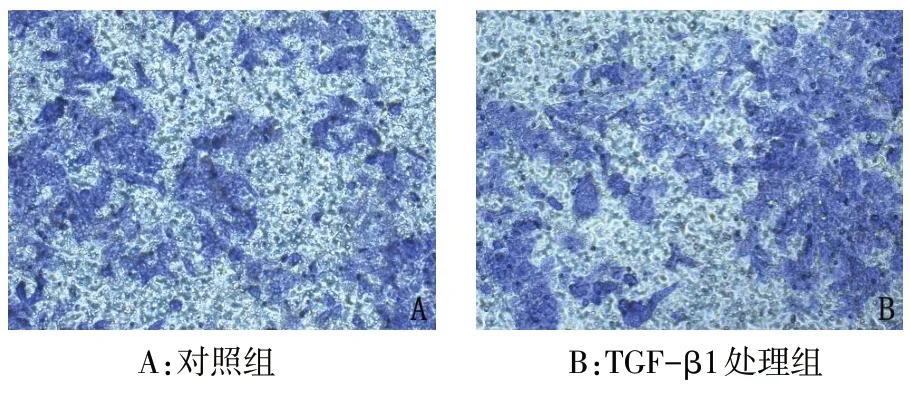
Fig.1 Effects of 10 μg/L TGF-β1 on invasion of HCT116 cells by Transwell invasion assay(×400)图1 Transwell侵袭实验检测10 μg/L TGF-β1对HCT116细胞侵袭情况的影响(×400)
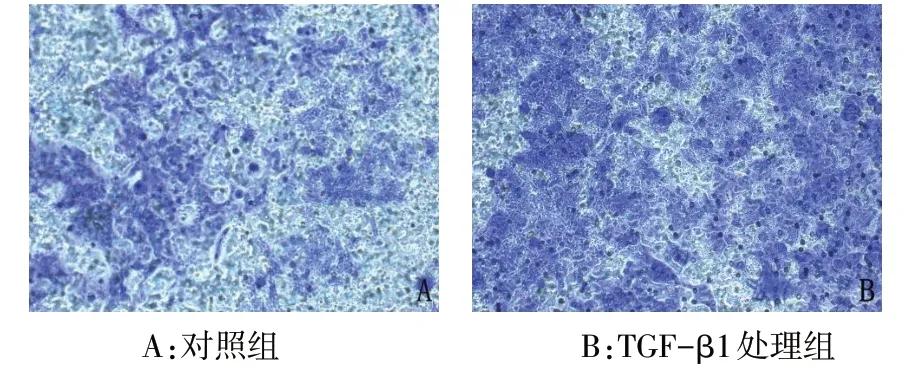
Fig.2 Effects of 10 μg/L TGF-β1 on migration of HCT116 cells by Transwell migration assay(×400)图2 Transwell迁移实验检测10 μg/L TGF-β1对HCT116细胞迁移情况的影响(×400)
2.3 划痕实验检测TGF-β1 对HCT116 细胞迁移能力的影响 结果显示,0 h 时对照组与TGF-β1 处理组划痕距离差异无统计学意义[(759.897±15.612)μmvs.(735.192±4.318)μm,n=3,t=2.642,P>0.05]。48 h 时对照组划痕距离大于TGF-β1 处理组[(580.625±4.920)μmvs.(403.688±7.587)μm,t=33.891,P<0.01],TGF-β1 处理组细胞迁移率明显高于对照组(45.09%±0.72%vs.23.58%±1.06%,t=28.978,P<0.01),表明TGF-β1促进HCT116细胞迁移能力,见图3。
2.4 RT-PCR检测TGF-β1对HCT116细胞TGF-β1、IL-22 mRNA 表达情况的影响 结果显示,TGF-β1处理组TGF-β1 mRNA 表达水平明显高于对照组(P<0.01),而IL-22 mRNA 表达水平明显低于对照组(P<0.01),见表2、图4。
2.5 免疫细胞化学染色检测TGF-β1 对HCT116 细胞TGF-β1、IL-22、E-cadherin 蛋白表达的影响 结果显示,TGF-β1处理组TGF-β1蛋白表达水平明显高于对照组(P<0.01),而IL-22、E-cadherin 蛋白表达水平明显低于对照组(均P<0.05),见表3、图5。
2.6 Western blot 法检测TGF-β1 对HCT116 细胞TGF-β1、IL-22、STAT3、E-cadherin 蛋白表达的影响 结果显示,TGF-β1处理组TGF-β1、STAT3蛋白表达水平明显高于对照组,而IL-22、E-cadherin 蛋白表达水平明显低于对照组(均P<0.01),见表4、图6。

Fig.3 Effects of 10 μg/L TGF-β1 on migration of HCT116 cells by scarification text(×200)图3 划痕实验检测10 μg/L TGF-β1对HCT116细胞迁移情况的影响(×200)
Tab.2 The expressions of TGF-β1and IL-22 mRNA in cells detected by RT-PCR表2 RT-PCR检测细胞中TGF-β1、IL-22 mRNA表达情况(±s)
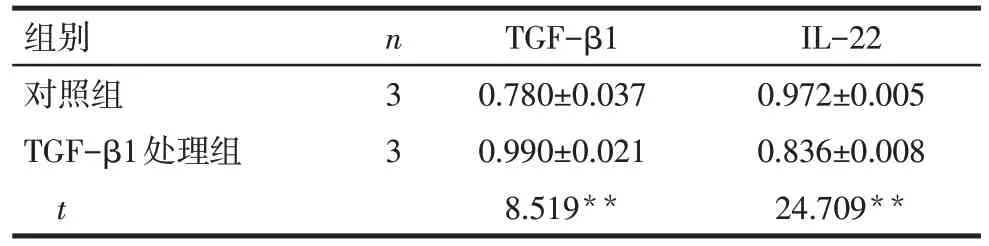
Tab.2 The expressions of TGF-β1and IL-22 mRNA in cells detected by RT-PCR表2 RT-PCR检测细胞中TGF-β1、IL-22 mRNA表达情况(±s)
**P<0.01
组别对照组TGF-β1处理组t n3 3 TGF-β1 0.780±0.037 0.990±0.021 8.519**IL-22 0.972±0.005 0.836±0.008 24.709**
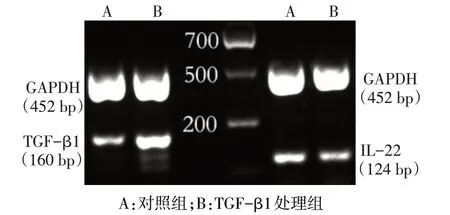
Fig.4 Effects of 10 μg/L TGF-β1 on expressions of TGF-β1 and IL-22 mRNA in HCT116 cells detected by RT-PCR图4 RT-PCR检测10 μg/LTGF-β1对HCT116细胞TGF-β1、IL-22 mRNA表达情况的影响
3 讨论
3.1 TGF-β1、IL-22对结直肠癌发生发展影响的研究现状 近年来,随着人们生活水平的改善和饮食结构的变化,我国结直肠癌死亡率仅次于肺癌、肝癌、胃癌和食管癌,位居第5 位,发病率呈逐年上升趋势[5],已严重威胁到人们的健康。结直肠癌的发病机制较为复杂,且呈慢性阶段性发展,可能是由多种因子共同作用的结果[6-7]。在影响结直肠癌发生发展的因子中,TGF-β1、IL-22 尤其受到人们的关注。结直肠癌细胞本身具有分泌TGF-β1 的功能,TGF-β1与结直肠癌淋巴结转移显著相关,已有研究证实TGF-β1 与肿瘤的发生发展密切相关,在肿瘤的增殖、浸润、迁移和转移中发挥着巨大的作用[8-9]。IL-22作为肿瘤微环境中的细胞因子,与肿瘤细胞增殖、侵袭、转移等重要过程的调控密切相关[10-11]。有研究发现IL-22 可能参与结肠癌的发展过程,通过激活STAT和MAPK信号通路,促进肿瘤细胞的增殖和迁移[12]。因此,抑制肿瘤增殖和促进凋亡成为治疗结直肠癌的关键。
Tab.3 Expressions of TGF-β1,IL-22 and E-cadherin protein in cells detected by immunocytochemical assay表3 免疫细胞化学检测细胞中TGF-β1、IL-22、E-cadherin蛋白表达情况(A,±s)
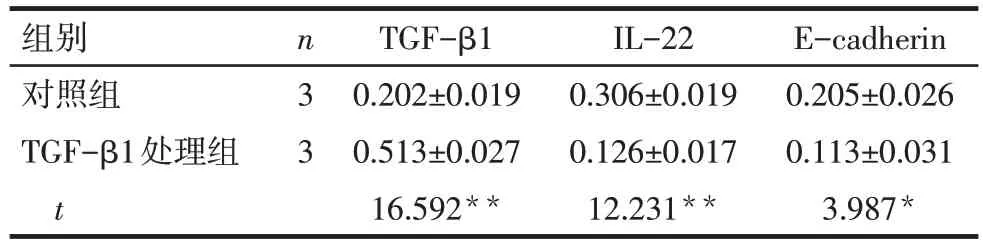
Tab.3 Expressions of TGF-β1,IL-22 and E-cadherin protein in cells detected by immunocytochemical assay表3 免疫细胞化学检测细胞中TGF-β1、IL-22、E-cadherin蛋白表达情况(A,±s)
*P<0.05,**P<0.01
组别对照组TGF-β1处理组t n3 3 TGF-β1 0.202±0.019 0.513±0.027 16.592**IL-22 0.306±0.019 0.126±0.017 12.231**E-cadherin 0.205±0.026 0.113±0.031 3.987*
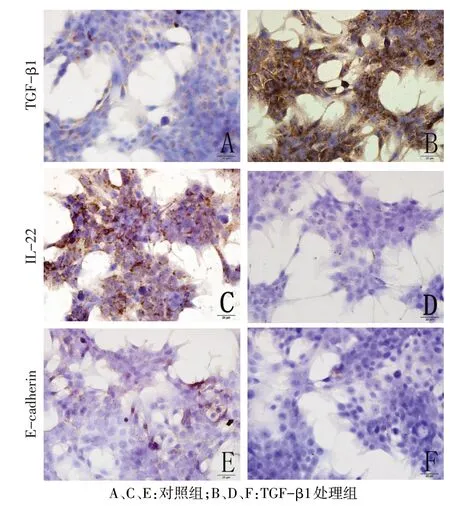
Fig.5 Effects of 10 μg/L TGF-β1 on expressions of TGF-β1,IL-22 and E-cadherin protein in HCT116 cells detected by immunocytochemical assay(×400)图5 免疫细胞化学染色检测10 μg/L TGF-β1对HCT116细胞TGF-β1、IL-22、E-cadherin蛋白表达的影响(×400)
Tab.4 Expressions of TGF-β1,IL-22,STAT3 and E-cadherin protein in cells detected by Western blot assay表4 Western blot 法检测细胞中TGF-β1、IL-22、STAT3、E-cadherin蛋白表达情况(n=3,±s)
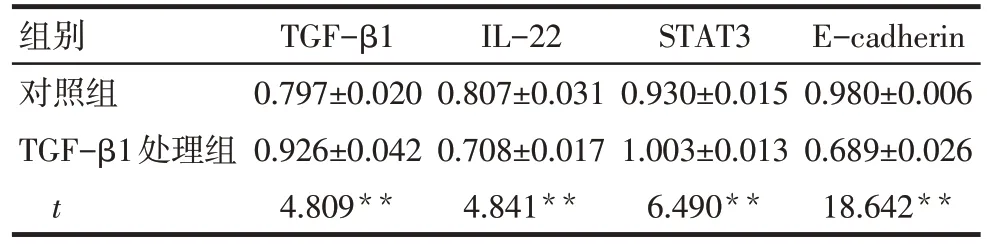
Tab.4 Expressions of TGF-β1,IL-22,STAT3 and E-cadherin protein in cells detected by Western blot assay表4 Western blot 法检测细胞中TGF-β1、IL-22、STAT3、E-cadherin蛋白表达情况(n=3,±s)
**P<0.01
组别对照组TGF-β1处理组t TGF-β1 0.797±0.020 0.926±0.042 4.809**IL-22 0.807±0.031 0.708±0.017 4.841**STAT3 0.930±0.015 1.003±0.013 6.490**E-cadherin 0.980±0.006 0.689±0.026 18.642**
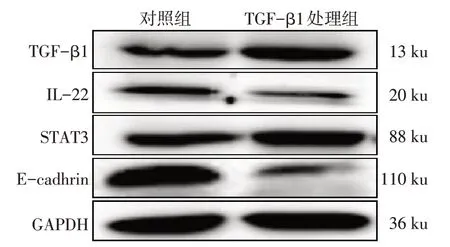
Fig.6 Effects of 10 μg/LTGF-β1 on the expressions of TGF-β1,IL-22,STAT3 and E-cadherin protein in HCT116 cells detected by Western blot assay图6 Western blot 法检测10 μg/L TGF-β1对HCT116细胞TGF-β1、IL-22、STAT3、E-cadherin蛋白表达的影响
3.2 TGF-β1 对结直肠癌HCT116 细胞增殖、侵袭、迁移的影响 目前TGF-β1对肿瘤影响的研究存在很大分歧。有研究发现TGF-β1可以抑制结直肠癌细胞的增殖和促进凋亡,进而抑制结直肠癌的发展[13-14]。也有研究发现,TGF-β1可明显促进结直肠癌细胞的增殖,进而促进其发展[3]。人们普遍认为,TGF-β1对肿瘤的作用具有双面性:在恶性肿瘤发展的早期,TGF-β1作为抑癌因子抑制肿瘤细胞的增殖和促进肿瘤的凋亡;在肿瘤发展的晚期,TGF-β1 作为促癌因子促进肿瘤细胞的侵袭和迁移[15]。但TGF-β1 从抑癌作用到促癌作用的转变机制尚不完全清楚。本研究采用CCK-8法测定不同浓度TGF-β1 对HCT116 细胞增殖的影响,结果发现不同浓度TGF-β1刺激HCT116细胞24、48 h后,HCT116细胞增殖差异不明显,提示TGF-β1可能对HCT116细胞增殖影响不明显。此外,本研究将10 μg/L TGF-β1刺激HCT116 细胞48 h 后,采用Transwell 侵袭迁移实验和划痕实验测定TGF-β1 对HCT116 细胞侵袭和迁移能力的影响,结果发现TGF-β1 处理组HCT116细胞侵袭和迁移能力明显高于对照组,表明TGF-β1 可能促进结直肠癌HCT116 细胞的侵袭和迁移,进而促进结直肠癌的发生和发展,这与Tan等[16-17]的研究结果一致。
3.3 TGF-β1 对结直肠癌HCT116 细胞中IL-22 表达的影响 近年来研究发现,大肠癌患者血清和组织中TGF-β1、IL-22 水平明显高于正常人,两者与结直肠癌发生、发展密切相关[3-4]。本研究发现,TGF-β1 处理组TGF-β1 mRNA 和蛋白表达水平明显高于对照组,但IL-22 mRNA 和蛋白表达水平明显低于对照组。此外,STAT3 作为TGF-β1 和IL-22通路共同的下游分子,TGF-β1 处理组STAT3 蛋白表达水平明显高于对照组,提示TGF-β1 可能与结直肠癌的发生发展密切相关,结直肠癌HCT116 细胞中TGF-β1可能抑制IL-22蛋白表达,但没有抑制IL-22 通路下游因子STAT3 蛋白表达,TGF-β1 可能通过其他信号通路调控STAT3蛋白表达水平。Rutz等[18]研究发现,TGF-β1通过转录因子c-Maf可抑制Th17 细胞中IL-22 蛋白的表达,而在结直肠癌细胞中尚鲜见报道TGF-β1 和IL-22、STAT3 蛋白表达的关系。此外,本研究虽然发现TGF-β1能抑制IL-22蛋白的表达,但并没有体现TGF-β/Smads 经典信号通路及下游因子在其中的作用,今后将进一步深入研究。
综上所述,TGF-β1可能促进HCT116细胞侵袭和迁移,但对HCT116 细胞的增殖影响不明显。结直肠癌HCT116细胞中TGF-β1可能抑制IL-22蛋白的表达,但没有抑制IL-22 通路下游因子STAT3 蛋白表达,这为如何防治结直肠肿瘤的侵袭和转移提供了一个新思考。
