大豆分离蛋白酶促聚集行为的表征
2019-09-06张志国
曾 祺,张志国*
(齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353)
大豆分离蛋白(soybean protein isolate,SPI)由于其优异的营养学特性与加工特性,被广泛运用于现代食品工业中[1]。SPI主要由β-伴大豆球蛋白(7S)和大豆球蛋白组成(11S)[2],这些蛋白通过氢键与分子内二硫键形成了稳定的球型结构[3],所以相较于其他蛋白而言,SPI稳定的球形结构阻碍了SPI分子间的相互作用,导致天然状态下其聚集性较差,为满足食品加工中各类食品的需求,需要改善SPI的聚集特性,酶法改性得益于其温和安全的反应条件与安全高效的操作过程,已成为蛋白质食品资源的重要改性方式[4-6]。Zang Xiaodan等[7]报道了木瓜蛋白酶与植酸酶混合处理可提升SPI的乳化性能,Kuipers等[8]发现酶处理可拓宽SPI的冷凝胶条件。酶解处理不仅提高了SPI的功能性质,并且增强了食品的营养特性,因此,SPI的酶法改性受到了食品工业的广泛关注。适当条件下的酶处理可引起SPI分子构象的改变,从而引起蛋白分子间作用力的一系列变化,导致SPI聚集特性改变。蓝色刺孢霉是一种从红曲米中分离得到的一种具有产天冬氨酸蛋白酶(aspartic protease,APs)能力的霉菌[9],APs可对SPI进行水解[10],改善其功能特性。本研究通过研究酶解后SPI组分、结构的变化,结合激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM)与原子力显微镜(atomic force microscope,AFM)表征SPI的酶诱导聚集过程与聚集体的性质,揭示酶解后组分变化与结构特性的变化与SPI聚集特性之间的相关性,为SPI聚集特性在食品中的运用提供理论依据及参考。
1 材料与方法
1.1 材料与试剂
脱脂大豆粉由山东省禹王有限公司提供,Quambalaria cyanescens APs为实验室自制(317.46 U/mL),其余试剂均为分析纯。
1.2 仪器与设备
pHS-3E型pH计 上海佑科仪器仪表有限公司;UV759紫外-可见光分光光度计 上海佑科仪器仪表有限公司;电泳仪 美国Bio-Rad公司;F-4500型荧光分光光度计 日立高新技术公司;J-815型圆二色光谱仪日本Jasco分析仪器公司;Leica SP8型LSCM 德国莱卡生物系统;Multimode8 型AFM 德国布鲁克公司。
1.3 方法
1.3.1 SPI的制备
SPI是由山东禹王有限公司提供的脱脂大豆粉为原料制得。制备步骤如下:将脱脂大豆粉悬浮于10 倍体积的蒸馏水中,用2 mol/L NaOH溶液调节pH值至8.0,室温搅拌2 h后,置于离心机中以13 000×g离心20 min,收集上清液;上清液用2 mol/L HCl溶液调节pH值至4.5,随后13 000×g离心15 min,收集沉淀,即为SPI。样品冻干后,在4 ℃贮存备用。
1.3.2 SPI水解度的测定
采用pH-stat法,根据Adler-Nissen[11]的方法测定SPI在不同水解时间下的水解度,称取一定量的SPI,用pH 7.0、10 mmol/L的磷酸盐缓冲液配制为最终质量浓度5 mg/mL的SPI分散液,均质后的体系中加入Quambalaria cyanescens APs(质量分数1%),当所需的酶解时间达到后,加入2 mL的1 mg/mL Pepstatin A溶液终止酶解反应,滴定起始pH 8.0,水解过程中不断加入0.5 mol/L的NaOH溶液以维持体系pH值稳定在8.0,水解度表示为在水解过程中破坏肽键与天然蛋白质中肽键总量之间的比值,由下式计算:
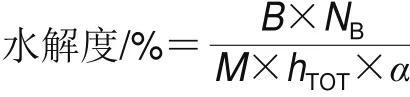
式中:B为反应过程中消耗碱量/mL;NB为碱浓度/(mol/mL);α为α-氨基酸在体系中的平均解离度,本实验条件下取0.93[11];M为被酶解蛋白的总质量/g;hTOT为每克蛋白质底物具有的肽键物质的量,本实验条件下为7.8 mmol/g[11]。
1.3.3 浊度的测定
采用UV759紫外-可见光分光光度计测定SPI在不同水解时间660 nm波长处光密度,以此表示浊度变化,表征SPI水解过程中聚集程度。
1.3.4 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
采用Leammli[12]建立的不连续的电泳系统,将12%分离胶溶液灌注到胶室中,加胶高度为整个胶室的3/4。待分离胶完全聚合,除去分离胶胶面的水封层后,将配好的3%浓缩胶溶液灌注到分离胶的上方,至距凹玻璃板上方0.5 cm处,快速插入进样梳,待浓缩胶完全聚合后,将主体放入电泳槽内。并倒入适量的pH 8.3的电极缓冲液,准确称取0.001 g冷冻干燥后的不同酶解时间SPI置于EP管中,加入1 mL包含0.05 mol/L pH 8.0的Tris-HCl溶液、1% SDS、10%甘油、0.02%溴酚蓝和1% β-巯基乙醇的还原性样品溶解液,在沸水浴中加热3 min,冷却至室温后加样。加入10 μL样品溶液和Marker,加至凝胶凹型样品槽的底部。初始电流为15 mA,待样品进入分离胶后,将电流调至30 mA,当溴酚蓝染料距凝胶底部1 cm时停止电泳,将胶片取出固定、染色、脱色。
1.3.5 内源荧光光谱分析
将不同酶解时间处理后的SPI用10 mmol/mL pH 7.0磷酸盐稀释至最终质量浓度为0.05 g/mL,为减少SPI内部酪氨酸对荧光光谱的贡献,设置激发波长为280 nm,在300~500 nm波长范围内扫描检测SPI内源性荧光强度的变化,扫描速率240 nm/min,激发和发射狭缝宽均为5 nm。
1.3.6 圆二色光谱分析
将不同酶解时间处理后的SPI用超纯水稀释至0.05 g/mL,以超纯水为背景去除背景噪音,在温度25 ℃、扫描速度100 nm/min、带宽1.0 nm、反应时间0.50 s条件下测定SPI在远紫外区(185~245 nm)的圆二色性。利用Applied Photophysics软件表征SPI的二级结构包括α-螺旋、β-折叠、β-转角和无规卷曲含量的变化。
1.3.7 LSCM观察
将酶解后的SPI酶解液稀释至1 mg/mL,取1 mL稀释后的SPI加入10 μL 0.2 g/100 mL Rhodamine B染料,取20 μL染色后的SPI溶液滴加于凹槽载玻片中,盖上盖玻片,并用指甲油密封以防止加热过程中溶液挥发,在40 ℃保温2 h后,置于4 ℃保藏12 h。用Leica SP8型LSCM观察SPI的聚集状态。激发光568 nm,物镜参数40×/NA 0.85。
1.3.8 AFM观察
采用轻敲模式对不同酶解时间处理后的SPI微观聚集形态进行观察,探针微悬臂长度为180 μm,针尖曲率半径为10 nm,针尖为商用氮化硅针尖,力常数为2.8 N/m。所有图像只经过自动平滑处理,以消除慢扫描方向上的低频噪音。每个样品随机选取6 个不同的区域,并用图像分析软件对SPI聚集体的微观形态进行表征。
1.4 统计及分析
每组数据至少重复3 次,利用Origin 8.5软件处理数据作图,利用SPSS V17.0软件对数据进行ANOVA差异显著性分析及t检验。
2 结果与分析
2.1 不同酶解时间SPI的水解度与浊度
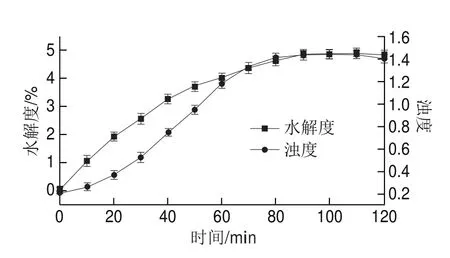
图1 SPI的水解度与浊度变化Fig. 1 Change in DH value and turbidity of SPI
由图1可知,SPI的水解度与浊度随着酶解时间的延长而增加,通过SPI水解度的变化曲线可知,SPI的水解速度随酶解时间的延长而减缓,并且在90 min左右到达酶解过程终点;由SPI的浊度变化曲线可知,SPI的聚集程度随酶解时间延长而增大,但相较于SPI的水解程度,SPI的聚集行为存在一定的滞后,黄苏[13]研究木瓜蛋白酶诱导的SPI酶促聚集行为,也发现相似的SPI聚集行为较于水解进程的滞后,可能由于水解初期所引起的SPI聚集驱动力的变化不足以克服SPI分子间保持的斥力,从而导致酶解SPI聚集行为的滞后现象。
2.2 不同酶解时间SPI的SDS-PAGE分析

图2 不同时间酶处理后SPI的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of SPI with different AP treatment times
SPI主要由7S和11S球蛋白组成,7S球蛋白主要由α(58~83 kDa)、α’(58~77 kDa)、β(42~53 kDa)3 个亚基结合而成[14-16],11S球蛋白由6 个亚基组成,每个亚基包含1 条酸性肽链和1 条碱性肽链,这些亚基通过二硫键连接起来,酸性肽链和碱性肽链的分子质量为31~45 kDa和18~20 kDa[17-18]。由图2可知,天然SPI在40~55 kDa范围内具有清晰蛋白条带,此部分为SPI 7S组分中的β亚基(42~53 kDa),随着酶处理时间延长,β亚基条带逐渐消失,同时在37 kDa左右出现了新蛋白条带的多肽,表明7S球蛋白中的β亚基被解离,并形成了分子质量大约为37 kDa的组分;相似的,在32 kDa的11S中酸性多肽链的条带逐渐变淡直至消失,说明酶处理使得SPI中7S、11S中的亚基解离以及重排;相比之下,7S组分亚基的解离与11S相比较为明显,可归结于11S亚基的连接主要是通过二硫键结合,二硫键的键合方式在一定程度上阻碍了APs对11S组分的水解[13]。
2.3 内源荧光光谱表征SPI的结构变化
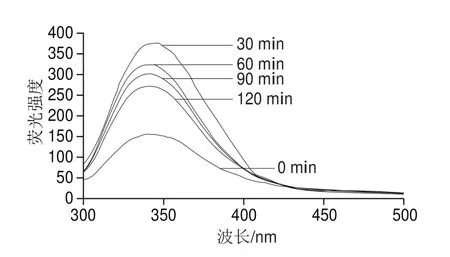
图3 SPI的内源荧光光谱变化Fig. 3 Change in intrinsic fl uorescence emission spectrum of SPI with different AP treatment times
SPI的内源荧光主要由分子内的色氨酸残基贡献,色氨酸残基所处环境的变化将会引起其荧光光谱的变化,因此,基于色氨酸残基的内源荧光光谱常被用于蛋白相对构象变化的表征[19]。由图2可知,APs酶处理组的SPI的荧光强度均高于对照(0 min),这是由于在天然状态下的SPI具有稳固的球形结构,由于疏水水合作用,色氨酸等疏水性基团被包裹在蛋白结构的内部,随着水解程度的增加,SPI相对构象发生变化,将色氨酸残基等疏水性基团暴露于外部的亲水环境中,从而导致了SPI荧光强度的变化。不仅如此,在酶处理过程中,SPI荧光强度随酶解时间(30~60 min)上升而下降并且伴随着峰位的轻微蓝移(344~340 nm),这种渐进的荧光淬灭现象可以归结于蛋白结构的部分恢复(或)及其聚集行为使暴露的色氨酸残基恢复到疏水环境中[20];此外,临近色氨酸蛋白分子间二硫键的形成也可以通过电子转移过程导致类似荧光淬灭现象[21]。因此,APs酶解处理可使SPI相对构象改变及其内部疏水基团暴露,蛋白疏水基团的暴露可导致更强烈、更广泛的疏水相互作用,从而诱导了SPI的聚集[22]。
2.4 圆二色光谱表征SPI二级结构变化
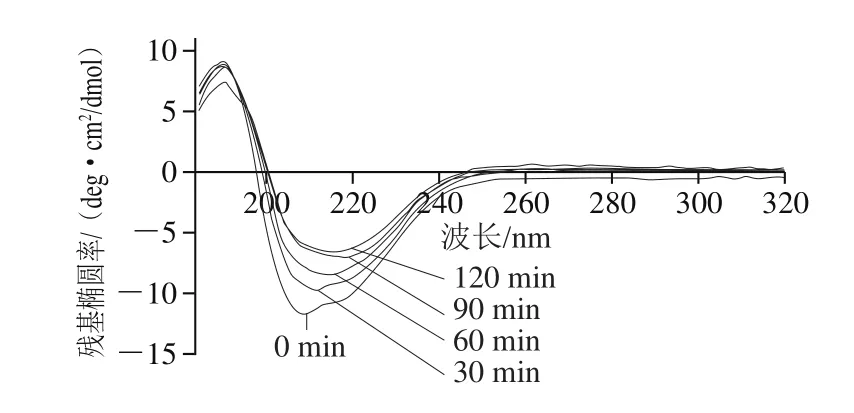
图4 SPI远紫外圆二色光谱的变化Fig. 4 Changes in far-UV CD spectrum of SPI with different AP treatment times
图4 显示,对照组(0 min)SPI的圆二色光谱在209 nm处显示出一个清晰的负峰,在190 nm处显示出一个正峰,这表明SPI具有高度有序的典型α+β结构[23],并且β-折叠结构含量占优势[24],APs酶解处理导致SPI二级结构显著性变化,随着酶解时间的延长,SPI的负峰向长波长方向逐渐偏移并且伴随着明显的荧光强度升高;SPI的正峰未发现明显偏移但其强度也有轻微下降。通过Applied Photophysics计算机软件分析光谱得到SPI酶处理过程中二级结构含量的变化,酶处理0、30、60、90、120 min的SPI的α-螺旋含量分别为:(7.0±0.12)%、(10.3±0.05)%、(12.5±0.13)%、(15.7±0.07)%、(16.4±0.09)%;β-折叠含量分别为:(51.9±0.08)%、(42.8±0.09)%、(4 0.3±0.0 7)%、(3 9.2±0.0 4)%、(38.4±0.16)%;无规卷曲结构含量变化不显著(P>0.05)。实验结果表明APs酶处理导致了SPI二级结构中α-螺旋含量的上升及β-折叠含量的下降,类似的结构变化现象也出现在SO2诱导的葡萄酒中类奇异果甜蛋白的聚集行为中[25],根据Kim等[26]的研究,具有相同氨基酸序列的α-螺旋结构相较于β-折叠结构具有更高的聚集倾向。因此,蛋白二级结构中α-螺旋含量的增加有助于提升蛋白的聚集特性,从而引发蛋白的聚集行为。
2.5 LSCM分析
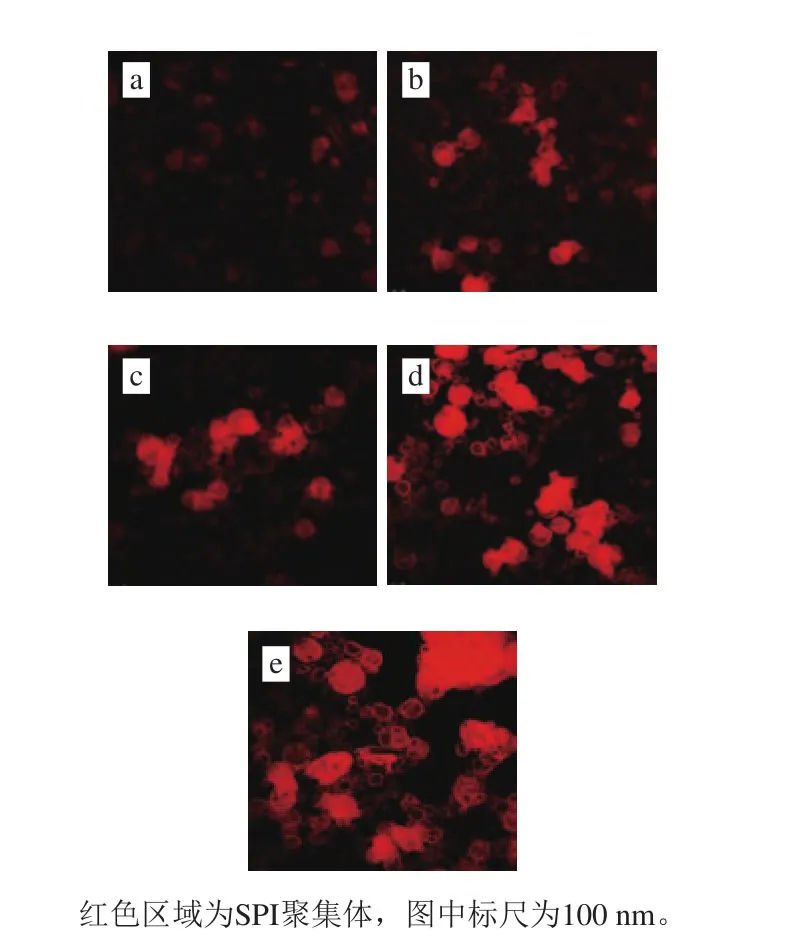
图5 SPI酶诱导聚集行为的LSCM图像Fig. 5 CLSM images of SPI aggregation behavior
如图5所示,天然状态下的SPI呈圆球状,通过静电相互作用与疏水作用稳定分散在溶液中,与Rhodamine B结合后荧光较弱。Rhodamine及其衍生物是属于咕吨类的碱性染料,第3芳环(简称底环)可通过活性基与蛋白质、核酸等生物大分子及组成单体分子中的—NH2、—OH、—SH等形成共价键[27-29],使其荧光特性发生变化;在天然SPI结构中,—NH2与—SH基团大部分被包埋在SPI结构的内部,从而导致图A中荧光强度较低;随着酶处理时间的延长,SPI结构的变化导致更多基团与Rhodamine B染料结合,使其荧光强度上升(图5B~E)。酶处理诱导了SPI的聚集行为,从图5可以直观地观察到,随着酶处理时间的延长,SPI形成了大小不均并且不连续的的聚集体,说明APs诱导的SPI聚集行为未能使SPI分子间产生足够的共价交联形成连续的凝胶体系,其聚集的主要驱动力还是由于SPI结构变化所导致的疏水相互作用以及静电作用力等非共价作用力[29-31]。
2.6 AFM分析
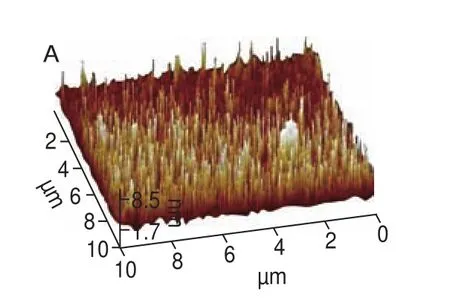
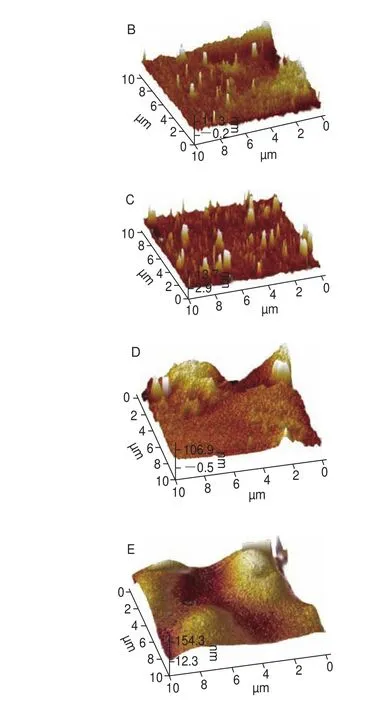
图6 SPI在不同酶处理时间下聚集体的AFM图像Fig. 6 AFM images of SPI aggregates with different enzyme treatment times
图6 显示了酶处理过程中由AFM观察到的SPI微观表面形态,未经酶处理的SPI主要以单体形式存在,简单地吸附在云母片表面。当酶处理时间在0~60 min时,SPI分子逐渐开始形成较小、较为分散的聚集体(图6B、C),此结果与LSCM观察的结果相一致,当酶解时间进一步从60 min延长至120 min时,SPI间的聚集程度明显增加,逐渐产生横向融合,形成如图6D、E的团状不连续的聚集体,并在云母片表面形成了不规则的堆积结构。利用Nanoscope analysis软件对SPI酶诱导聚集过程中的三维结构进行分析,不同酶处理时间下的SPI的平均表面粗糙度(Ra)分别为1.01、6.84、11.6、40.9、162 nm,Ra作为统计学的基本参数,能够反映样品表面粗糙程度的大小,即聚集程度的大小,Ra的增加说明SPI随着酶处理时间的延长,其宏观聚集程度增大,从而在云母片表面形成了不连续、不规则的SPI聚集体。
3 结 论
研究表明,APs处理可诱导SPI的聚集行为。SPI的水解度与浊度在酶处理过程中随处理时间的延长而增大,表明SPI的解离程度与聚集程度随酶处理时间的延长而增大;酶处理导致了SPI亚基的解离,将大分子质量SPI水解为具有较小分子质量的组分,其中7S组分较11S的解离程度较大。酶处理还导致SPI天然构象的改变,使埋藏在分子内部的疏水性基团及疏水性氨基酸暴露于更加亲水的外部环境中,造成了SPI分子间更强、更广泛的疏水相互作用;酶处理后的SPI结构中具有更高聚集倾向的α-螺旋含量增加,同时使SPI中对其二级结构稳定具有重要作用的β-折叠含量下降,增加了SPI分子的聚集倾向。APs诱导的SPI聚集行为并没有形成高度有序的、连续的三维凝胶结构,聚集体很大程度依赖于非共价作用力形成不规则的堆积结构,其微观结构表现为不连续、不规则的团状聚集体。
