槲皮素与β-乳球蛋白B的结合机制及其溶解性能
2019-09-06李晓雷郑丽丽艾斌凌郑晓燕杨劲松盛占武
李晓雷,郑丽丽,艾斌凌,郑晓燕,杨 旸,杨劲松*,盛占武,*
(1.中国热带农业科学院海口实验站,海南 海口 570102;2.海南大学食品科学与工程学院,海南 海口 570228;3.海口市香蕉生物学重点实验室,海南 海口 570102)
槲皮素是一种多羟基黄酮类化合物,其化学名为3,5,7,3’,4’-五羟黃酮,以糖苷的形式广泛存在于植物的花、叶和果实中[1]。槲皮素具有抑制肿瘤细胞、抗氧化、降血压、降血脂、止咳平喘等生理功能和药理作用[2]。也有实验表明槲皮素对以D-葡萄糖、DL-甘油醛[3]、甲基乙二醛、乙二醛[4]为底物的蛋白质非酶糖基化反应体系中晚期糖基化终末产物的生成具有明显抑制作用。也有体外实验表明槲皮素对二羰基化合物造成的DNA损伤有抑制作用[4]。但是由于槲皮素不溶于水,实验阶段一般用二甲亚砜和乙醇作为溶剂,在进行细胞实验时,这两种溶剂均具有细胞毒性[5-6]。实际应用中,水溶性差问题限制了槲皮素的应用范围,在生产槲皮素类药物时一般通过导入亲水性基团来增加其水溶性[7],如槲皮素氧乙酸赖氨酸盐。目前用于包埋槲皮素提高其水溶解性的主要材料是β-环糊精和丙基-β-环糊精[8],鲜见有用蛋白作为载体用于结合槲皮素以期提高其水溶性的报道。
β-乳球蛋白是牛奶中含量最丰富的乳清蛋白,是一种水溶性蛋白质,由于其营养和功能特性,常被用作食品添加剂[9]。β-乳球蛋白分子是一种高度结构化的球状蛋白质,含有9 条β-折叠和1 段较长的α-螺旋、4 段较短的α-螺旋,其中8 条反平行的β-折叠组成内包含花萼状疏水孔穴的β-桶型结构,有A、B、C三种不同的构象[10]。研究表明,β-乳球蛋白单体上含有多个可结合疏水性配体的空穴[11],因此常被用来作为一些疏水小分子的配体。已有研究表征了球状蛋白与多酚之间的非共价相互作用[12],该相互可用可能导致蛋白质解折叠和沉淀[13],并且影响蛋白结构的稳定性[14]。也有研究发现膳食多酚和乳蛋白相互作用降低了蛋白质对胃蛋白酶消化的敏感性[15]。Jia Jingjing等[16]的研究表明绿原酸、阿魏酸、表没食子儿茶素没食子酸酯与β-乳球蛋白结合可能会导致蛋白表面疏水性改变。但是关于β-乳球蛋白与多酚之间相互作用的潜在机制尚未完全阐明,且目前多见将β-乳球蛋白A用于载体的报道,鲜见有β-乳球蛋白B与多酚相互作用机制的报道。
许多疏水性多酚和黄酮类化合物虽然具有生理活性和药理作用,但是在应用过程中却存在水溶性差的问题。目前,已有研究表明在与水溶性蛋白质结合后它们的溶解度得到了显著提高。Tønnesen等[17]研究了姜黄素-大豆分离蛋白络合物的溶解度和化学性质,发现结合大豆分离蛋白后其水溶性得到显著的提高。Esmaili等[18]利用酪蛋白包埋姜黄素使其溶解度提高2 500 倍左右。此外,有研究表明酪蛋白和姜黄素结合后,二者的抗氧化活性均得到提高;β-乳球蛋白可以保护β-胡萝卜素和VA,降低它们热、光照和氧气降解的速度[19];Smoyamada等[20]研究了β-乳球蛋白和膳食多酚的相互作用,发现二者的亲和力和体系的抗氧化活性呈负相关。因此,水溶性蛋白质与疏水性活性成分的结合不仅可以提高其溶解度,还可以保护活性成分的活性。
本研究以提高槲皮素的水溶性为切入点,用β-乳球蛋白B作为槲皮素载体,利用荧光光谱、等温滴定量热法和分子对接等多种手段,研究槲皮素与该蛋白的结合机制,结合后蛋白的二级结构和槲皮素溶解度的变化,以期为槲皮素的应用研究提供帮助。
1 材料与方法
1.1 材料与试剂
β-乳球蛋白B(纯度≥90%)、乙腈(色谱纯)美国Sigma公司;槲皮素(纯度≥96.5%) 中国食品药品检定研究院;乙醇(分析纯)、Na2HPO4、NaH2PO4西陇化工股份有限公司;甲醇、甲酸(均为色谱纯)广州化学试剂厂。
1.2 仪器与设备
F-7000型荧光分光光度计 日本日立公司;Evolation 300型紫外-可见分光光度计 美国Thermo Fisher Scientific公司;Chirascan型圆二色性(circular dichroism,CD)光谱仪 英国Applied Photophysics公司;Nicolet 6700型傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪、Multifuge X1R台式冷冻离心机 美国Thermo Fisher Scientific公司;Nano ITC型等温滴定量热仪、Upic I-Class型超高效液相色谱仪 美国Waters公司;ML 204型电子天平、S20K型pH计 瑞士Mettler-Toledo公司;超声波清洗机 深圳洁盟清洗设备公司;SHA-CA型恒温水浴振荡器 常州普天仪器制造公司。
1.3 方法
1.3.1 蛋白溶液的配制及浓度确定
取适量β-乳球蛋白B置于离心管中,加入3 mL磷酸缓冲溶液(pH 7.4、50 mmol/L),轻轻转动使其充分溶解(尽量避免产生气泡),静置10 min后用紫外-可见分光光度计测定其200~800 nm波长范围内的吸光度。确定蛋白浓度:调节粗配好的溶液浓度,使其最大吸光度在1.76左右,然后另取一洁净的离心管,先加入1 600 µL磷酸缓冲液(pH 7.4、50 mmol/L),再加入400 µL蛋白母液(即将蛋白稀释5 倍),测吸光度,利用其摩尔吸光系数确定最终浓度[21],蛋白溶液现配现用。
1.3.2 分子荧光的测定
在离心管中加入磷酸缓冲液(pH 7.4、50 mmol/L),再加入一定体积的蛋白溶液,最后加入一定量的槲皮素溶液获得混合溶液,溶液充分混合后分别置于15、25、35 ℃的环境中1 h。最终获得的混合溶液中蛋白浓度为1 μmol/L,槲皮素浓度分别为0、2、4、6、8、10、12、14、16、18 μmol/L[22]。将每次配制好的样品取2 mL进行荧光扫描。荧光扫描条件:固定激发波长295 nm,发射波长305~460 nm,激发、发射的狭缝宽度均为2.5 nm,扫描速率12 000 nm/min[21]。
在25 ℃条件下,取浓度为1 μmol/L的蛋白溶液和浓度比1∶2(β-乳球蛋白B与槲皮素)的混合溶液分别测定三维荧光图谱。测定条件为:激发波长200~350 nm(采样间隔2 nm),发射波长200~500 nm(采样间隔2 nm)[22]。
在25 ℃条件下,分别收集激发波长在260~340 nm(Δλ=15 nm)和220~360 nm(Δλ=60 nm)的同步荧光光谱[22]。
1.3.3 分子荧光数据分析
荧光猝灭的机理用Stern-Volmer方程(1)分析[16]:

式中:F0和F分别为不含和含有槲皮素的蛋白溶液的荧光强度;[Q]为溶液中槲皮素浓度;KSV为Stern-Volmer猝灭常数;Kq为荧光猝灭速率常数;τ0为猝灭剂不存在时荧光物质的平均寿命,生物大分子的荧光平均寿命一般约为10-8s。
对于静态猝灭,猝灭剂和蛋白之间的结合常数和每个蛋白的结合位点数可用式(2)确定[23]:
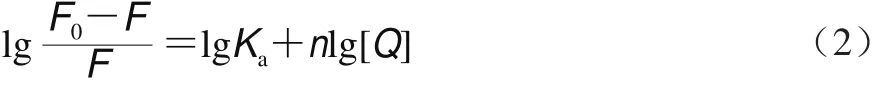
焓变(ΔH)、熵变(ΔS)和自由能(ΔG)变化根据Vant’s Hoff公式(3)和(4)确定[24]:
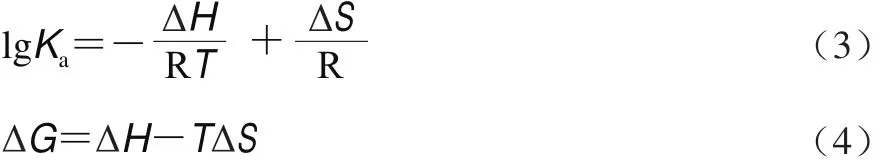
式中:R为气体常数(8.314 J/(mol•K));T为实验温度;Ka为猝灭剂和蛋白的结合常数。
1.3.4 紫外-可见吸收光谱分析
取3 mL β-乳球蛋白B和槲皮素的混合溶液(蛋白浓度10 μmol/L,蛋白-槲皮素浓度比1∶1)在195~450 nm波长范围内测定其吸光度,狭缝宽度为2.0 nm,取样间隔为1 nm,用10 μmol/L的β-乳球蛋白B溶液作对照,用pH 7.4(50 mmol/L)的磷酸缓冲液作空白对照。
1.3.5 等温滴定量热仪分析
用ITC进样器吸取30 μmol/L的蛋白溶液300 μL(注意排净气泡)注入1.7 mL的样品池中,用滴定注射器吸取600 μmol/L的槲皮素溶液50 μL,分20 次进行滴定,每次滴定量2.0 μL、滴定温度25 ℃、搅拌速率300 r/min、滴定时间间隔200 s,以获得反应热相对于时间变化的原始数据。用600 μmol/L的槲皮素溶液滴定磷酸缓冲液(pH 7.4、50 mmol/L)作为对照。然后用原始数据减去对照实验的数据以获得更正后的数据[21]。
1.3.6 CD光谱的测定
将蛋白母液和槲皮素溶液按照一定的比例混合,获得蛋白浓度20 μmol/L且蛋白-槲皮素浓度比1∶1的混合溶液,取混合溶液在185~260 nm的波长范围内测定CD光谱,数据采集间隔为0.5 nm,扫描速率100 nm/min,响应时间4 s。并在相同条件下测定浓度为20 μmol/L纯蛋白溶液的CD光谱。对于获得的数据,用CDpro软件分析各种二级结构的相对含量[25]。
1.3.7 FTIR分析
制备蛋白浓度为0.1 mmol/L且蛋白-槲皮素浓度比1∶1的混合溶液,在600~4 000 cm-1范围内测定其FTIR,信号采集模式为衰减全反射。在相同条件下测定浓度为0.1 mmol/L纯蛋白溶液的FTIR。用磷酸缓冲液(pH 7.4,50 mmol/L)作空白对照。所得图谱用Ominic软件选取1 600~1 700 cm-1范围内的酰胺I带分析蛋白的二级结构,用差谱消除技术消除水蒸气在1 600~1 700 cm-1波段的干扰。最后用PeakFit软件进行分峰和曲线拟合,并计算各种二级结构的相对含量[26]。
1.3.8 分子建模
用AutoDock软件模拟槲皮素和β-乳球蛋白B的结合状况。蛋白质(PDB ID: 1BEB)的3D结构从PDB网站获取,槲皮素的3D结构用ChemDraw软件绘制。采用拉马克遗传算法计算蛋白质和槲皮素结合的可能构象。后续分析选择对接结果中具有最低自由能的构象[27]。
1.3.9 溶剂蒸发技术测定槲皮素溶解度的变化
准确称取10 mg β-乳球蛋白B和12 mg槲皮素,溶于4 mL 150 mL/L的乙醇中,备用。40 ℃旋转蒸发,除去溶剂。然后加入5 mL磷酸缓冲液(pH 7.4、50 mmol/L),旋蒸5 min获得胶束溶液。将该溶液在37 ℃水浴中孵育过夜,然后10 000 r/min离心10 min[28]。取上清液,用甲醇稀释100 倍备用。
制备质量浓度梯度为30、15、7.5、3.75、1.9、0.95 μg/mL的槲皮素标准溶液,然后用高效液相色谱测定标准溶液和样品溶液,最终确定样品中槲皮素的溶解度。
色谱条件:色谱柱:Waters BEH C18(2.1 mm×50 mm,1.7 μm);流动相:乙腈-0.1%甲酸(45∶55,V/V);检测波长254 nm;流速0.3 mL/min;进样量10 μL。在上述条件下槲皮素的保留时间为0.45 min[29]。
1.4 数据分析
所有实验重复3 次,用Origin 8.5软件进行数据分析及作图处理,采用SPSS 19.0软件进行统计分析。
2 结果与分析
2.1 β-乳球蛋白B和槲皮素的相互作用
蛋白质中的酪氨酸、色氨酸(Trp)和苯丙氨酸残基可以发射荧光[30]。β-乳球蛋白B的19、61位为Trp残基,20、42、99、102位为酪氨酸残基[31]。因此,可以用β-乳球蛋白B中固有的Trp和酪氨酸残基的荧光猝灭研究槲皮素和β-乳球蛋白B之间的相互作用。本研究选用295 nm作为固定激发波长,在此波长下可认为β-乳球蛋白B的内源荧光全部来自于Trp残基[17]。
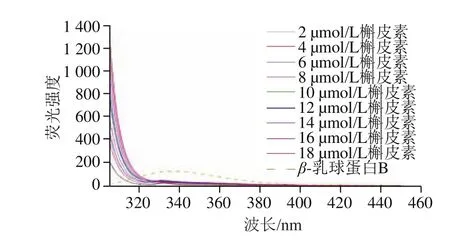
图1 β-乳球蛋白B溶液和不同浓度槲皮素溶液荧光曲线Fig. 1 Fluorescence spectra of β-lactoglobulin B solution and quercetin solutions of different concentrations
如图1所示,β-乳球蛋白B产生最大荧光强度的发射波长为338 nm,槲皮素的分子荧光强度随着浓度的升高而增强,但是不同浓度的槲皮素在338 nm波长处的荧光强度不随浓度的变化而变化且为0,因此槲皮素对β-乳球蛋白B的荧光光谱的测定不会产生影响。
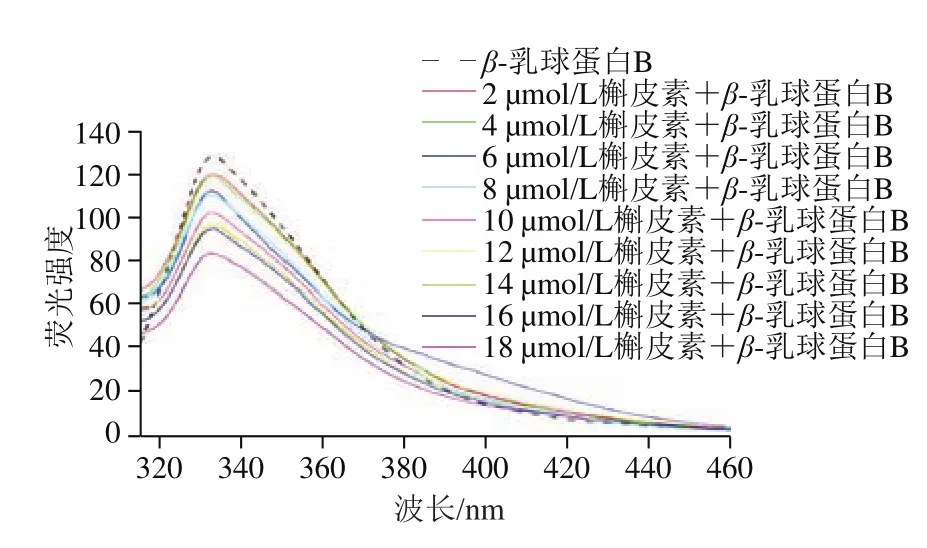
图2 β-乳球蛋白B和不同浓度槲皮素混合溶液荧光曲线Fig. 2 Fluorescence spectra of β-lactoglobulin B mixed with different concentrations of quercetin
如图2所示,没有加入槲皮素时β-乳球蛋白B产生最大荧光强度的发射波长为338 nm。加入槲皮素后,随着槲皮素浓度升高,蛋白的荧光强度逐渐降低,但荧光峰峰形保持不变且最大峰仍在338 nm波长处,当槲皮素浓度为18 μmol/L时蛋白的荧光强度约为原来的65.7%。这表明槲皮素与蛋白发生了结合,使得蛋白质的内源荧光发生了猝灭。
Jia Jingjing等[32]将β-乳球蛋白用于表没食子儿茶素没食子酸酯、绿原酸和阿魏酸3 种多酚的载体,3 种多酚均使蛋白的荧光出现了不同程度的猝灭;Zhang Jie等[33]用β-乳球蛋白包埋叶酸、α-生育酚和白藜芦醇的实验中也出现了同样的结果。Jia Jingjing[32]和Zhang Jie[33]等的实验结果均表明,在与多酚的结合过程中,β-乳球蛋白中能发射荧光的Trp残基、酪氨酸残基和苯丙氨酸残基所处的微环境发生变化,导致蛋白的内源荧光发生猝灭,并进一步证实多酚的结合改变了β-乳球蛋白改变了蛋白的二级结构。因此,槲皮素的结合导致β-乳球蛋白B的内源荧光发生猝灭的原因也可能是槲皮素改变了蛋白的二级结构,这在后面FTIR实验中得到了验证。
2.2 荧光猝灭机理
蛋白质的荧光猝灭可分为静态猝灭和动态猝灭[34]。对于静态猝灭,静态复合物的生成往往会导致荧光物质吸收光谱的改变,且静态复合物的猝灭常数随着温度的升高而降低。动态猝灭会影响到荧光物质的激发态,但并不改变荧光物质的吸收光谱[35]。
基于上述原理,通过Stern-Volmer方程在3 个不同温度(15、25、35 ℃)条件下分析β-乳球蛋白B的荧光猝灭数据,从图3和表1可以发现,β-乳球蛋白B的猝灭常数(KSV)随着温度的升高而降低,并且荧光猝灭速率常数(Kq)值高于最大扩散碰撞猝灭常数(2.0×1010L/(mol·s)),说明猝灭类型是典型的静态猝灭。同时,从图4可以看出,β-乳球蛋白B的吸收光谱在结合槲皮素后发生了明显的红移,说明β-乳球蛋白B的生色团所处的微环境发生了变化,同时也印证了与槲皮素的结合使β-乳球蛋白B发生了静态猝灭。
Bi Hongna等[36]用荧光共振能量转移技术研究了静态猝灭发生的机制,认为在β-乳球蛋白与多酚结合的过程中,二者发生了非辐射能量转移,即通过分子间的电偶极相互作用,将供体激发态能量转移到受体激发态的过程,造成供体荧光强度降低,而受体可以发射更强于本身的特征荧光(敏化荧光),也可以不发荧光(荧光猝灭),同时也伴随着荧光寿命的相应缩短或延长。将这个原理用于解释槲皮素使β-乳球蛋白B发生静态猝灭的原因同样行的通,在295 nm波长光激发下β-乳球蛋白B的激发态能量向槲皮素发生了非辐射能量转移,导致自身的荧光强度降低。

图3 不同温度下槲皮素结合β-乳球蛋白B的Stern-Volmer曲线Fig. 3 Stern-Volmer curves of quercetin binding to β-lactoglobulin B at different temperatures
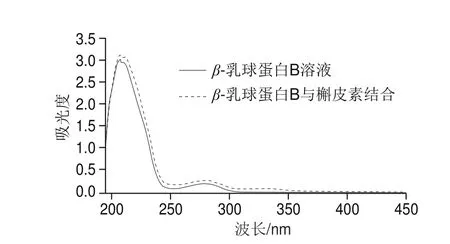
图4 β-乳球蛋白B溶液和β-乳球蛋白B与槲皮素结合后的紫外-可见吸收光谱曲线Fig. 4 UV-Vis absorption spectra of β-lactoglobulin B and its complex with quercetin
2.3 热力学参数分析
对于静态猝灭,结合常数和结合位点数可以基于Stern-Volmer方程求得,结果见表1。槲皮素与β-乳球蛋白B的结合位点数(n)趋于1,因此判断β-乳球蛋白B上只有一个槲皮素的结合位点。对于结合常数Ka,从表1可以看出其数值随着温度升高而减小,表明槲皮素结合到β-乳球蛋白B上的反应是放热过程,这一点从ΔH小于0也可以判断出来。
蛋白与小分子之间的相互作用力有4 种:静电相互作用、疏水作用、范德华力和氢键。根据研究,在结合过程中,当ΔH>0、ΔS>0时,疏水作用为主要作用力;当ΔH<0、ΔS<0时,氢键和范德华力为主要作用力;当ΔH<0、ΔS>0时,静电相互作用为主要作用力[37]。根据表1计算的数据表明,范德华力和氢键为槲皮素和β-乳球蛋白B结合的主要作用力,后续的分子对接模拟也验证了这一点。同时,该反应的ΔG<0,表明槲皮素和β-乳球蛋白B的结合是自发进行的[38]。
从图5可以看出,二者之间的结合为放热反应,且该反应熵变值小于0,同时其结合位点数也趋于1。该结果与基于荧光猝灭利用Stern-Volmer方程计算出来的结果虽然数值上存在差异,但是在定性分析上保持了一致性,即β-乳球蛋白B上只有1 个槲皮素的结合位点,范德华力和氢键是槲皮素和β-乳球蛋白B结合的主要作用力。
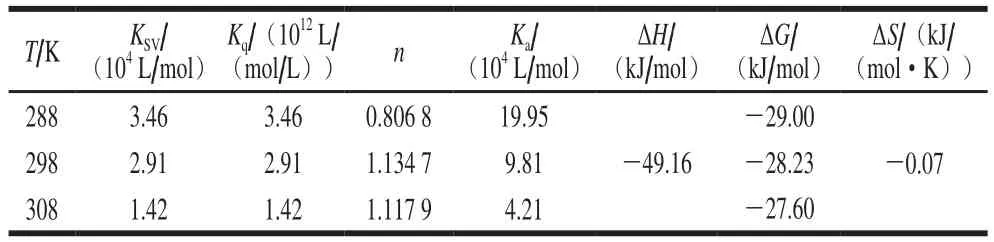
表1 β-乳球蛋白B与槲皮素在不同温度下相互作用的猝灭常数和热力学参数Table 1 Thermodynamic parameters of β-lactoglobulin B and quercetin interactions at different temperatures

图5 槲皮素与β-乳球蛋白B的等温滴定量热图Fig. 5 Isothermal titration calorimetry of quercetin and β-lactoglobulin B
2.4 同步荧光和三维荧光图谱分析
同步荧光光谱可以研究配体对蛋白质构象的影响,并提供有关荧光官能团附近的分子微环境的信息。这使得可以缩小光谱带并且同时检索单个荧光团上的信息而不是几个荧光团[31]。本实验分析不同扫描间隔下β-乳球蛋白B和槲皮素结合物的同步荧光特性。当波长间隔保持在15 nm或60 nm时,同步荧光提供了Trp残基的特征信息:槲皮素的存在改变了Trp残基附近的微环境,从而导致Trp的发射荧光减弱,使得β-乳球蛋白B出现了荧光猝灭[39]。因此推断槲皮素的结合位点在Trp残基附近,后续的分子对接结果验证了这一推测。
三维荧光光谱是监测蛋白质构象变化的详细信息的有效工具[36]。如图6所示,峰a与Trp残基的光谱特征有关;峰b主要揭示多肽骨架结构的荧光光谱行为,其强度与蛋白质二级结构相关;峰c是瑞利散射峰,另一峰是二阶瑞利散射峰[40]。从图6可以观察到,荧光峰a和b在加入槲皮素后发生了猝灭。此结果表明,槲皮素可能与β乳球蛋白相互作用并引起其构象和二级结构的一些变化。
Jia Jingjing等[32]利用三维荧光图谱分析β-乳球蛋白与多酚结合时的构象变化时发现,引起的a、b两峰的猝灭程度的大小依次为表没食子儿茶素没食子酸酯>阿魏酸>绿原酸,而三者含有的酚羟基的数目也是依次减少,推测a、b两峰的猝灭程度可能与多酚中酚羟基的数目有关。槲皮素中也含有较多的酚羟基(5 个),因此也引起β-乳球蛋白B的a、b两峰发生较大程度的猝灭,这与实验结果保持一致。推测,β-乳球蛋白与多酚结合后二级结构变化程度的大小与多酚中含有的酚羟基数目有关,酚羟基数目越多发生的变化越明显。但这需要进一步实验验证。
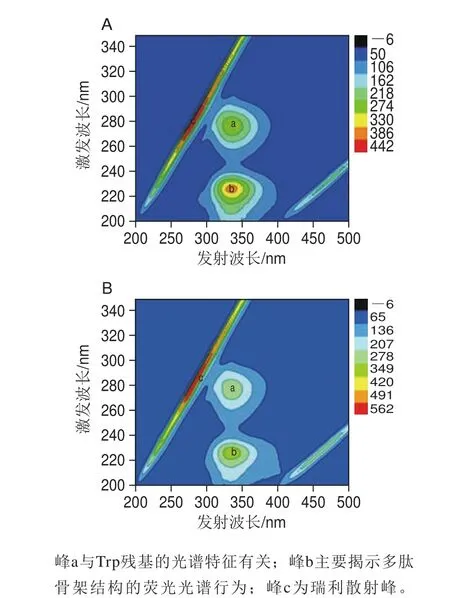
图6 β-乳球蛋白B(A)以及β-乳球蛋白B结合槲皮素之后(B)的三维荧光图谱Fig. 6 Excitation-emission matrix (EEM) fl uorescence spectra of β-lactoglobulin B (A) and its complex with quercetin (B)
2.5 结构变化分析
FTIR常用来测定蛋白质二级结构的变化,位于1 600~1 700 cm-1之间的酰胺I带,对于研究蛋白质的二级结构最有价值[41]。因此,本研究通过对酰胺I带的峰进行拟合推测β-乳球蛋白B二级结构的变化,通常情况下1 600~1 639 cm-1之间的峰为β-折叠的特征峰,1 640~1 650 cm-1为无规卷曲的特征峰,1 651~1 660 cm-1为α-螺旋的特征峰,1 661~1 700 cm-1为β-转角的特征峰[42]。从图7可以看出,在与槲皮素结合后,β-乳球蛋白B的拟合峰发生了明显变化。与结合前相比,位于1 600~1 639 cm-1范围内的峰明显增多,而位于1 651~1 660 cm-1范围内的峰则减少,这说明,结合槲皮素后β-乳球蛋白B中的α-螺旋含量降低,反之β-折叠含量增加,由表2可看出,α-螺旋减少了4.46%,β-折叠增加了3.59%。因此推测,槲皮素的结合使得部分α-螺旋解螺旋变为β-折叠。这与Jia Jingjing等[32]用β-乳球蛋白结合没表没食子儿茶素没食子酸酯、绿原酸和阿魏酸所得的结果相一致,即与多酚的结合诱导β-乳球蛋白中的α-螺旋解螺旋变为β-折叠。
由于FTIR峰值的拟合误差较大,因此进一步用CD光谱研究了β-乳球蛋白B二级结构的变化。蛋白质的远紫外(178~250 nm)CD光谱,反映了蛋白质主链的构象信息[43]。利用CDpro软件对未结合和结合了槲皮素的β-乳球蛋白B的远紫外CD光谱进行分析,获得了表2中蛋白质各种二级结构的相对含量信息,从表2可以看出,槲皮素的结合使得β-乳球蛋白B中的α-螺旋含量降低,β-折叠含量增大,与FTIR的结果一致。因此判断,槲皮素的结合诱导了β-乳球蛋白B中的α-螺旋向β-折叠转变。
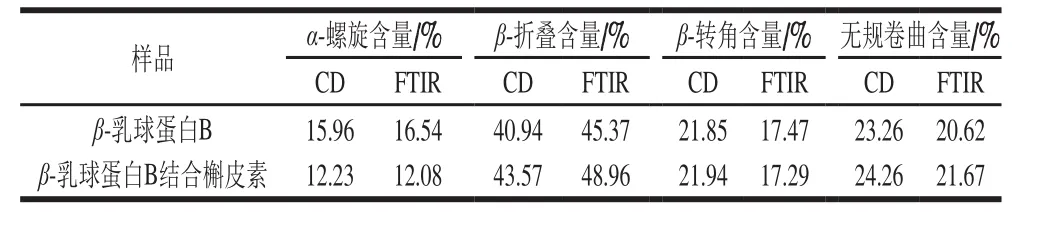
表2 未结合和结合槲皮素的β-乳球蛋白B的CD和FTIR光谱参数Table 2 CD and FTIR spectral parameters of β-lactoglobulin B and its complex with quercetin
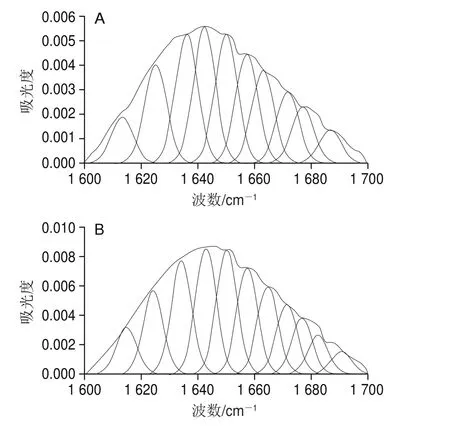
图7 β-乳球蛋白B(A)以及β-乳球蛋白B结合槲皮素之后(B)的FTIR光谱峰值拟合曲线Fig. 7 FTIR spectral peak fi tting of β-lactoglobulin B (A) and its complex with quercetin (B)
2.6 分子对接结果分析
使用Autodock软件模拟β-乳球蛋白B和槲皮素的精确结合位点,进一步验证了上述实验结果。将10 个可能的结合构象簇进行对比,选择其中自由能最低的构象进行分析,结果如图8、9所示。根据该对接结果,槲皮素结合在由一段α-螺旋和一段β-转角组成的空穴中,且该结合位点附近有一个Trp残基(Trp 19,图8中红色细线显示)存在。此构象中槲皮素和蛋白的结合能为4.54 MeV,氢键长度为2.019 Å。其中有8 个氨基酸残基(Lys100、Lys101、Val123、Arg124、Thr125、Glu127、Asp129)参与了槲皮素与β-乳球蛋白B的结合,其中苏氨酸残基(Thr125)与槲皮素的3号碳原子上的活性羟基氧之间形成了氢键(2.019 Å),其余的氨基酸残基则提供了范德华力。这一结果也解释了蛋白发生结构变化的原因,α-螺旋上的部分氨基酸参与了与槲皮素的结合,由于槲皮素具有疏水性,二者结合之后,在疏水作用下部分α-螺旋发生了变化。同时由于疏水作用导致Trp残基所处的微环境发生了变化,这也解释了荧光猝灭和紫外-可见吸收光谱吸收峰发生红移的原因。
根据Liang Li等[44]的报道,β-乳球蛋白上有5 个潜在的结合位点,分别为β-桶型结构内的疏水孔穴、α-螺旋和β-桶型结构间表面疏水袋、Trp19-Arg124附近的外表面、β-桶型结构的孔缝处以及二聚体的单体结合界面。由分子对接的结果可以看出,槲皮素与β-乳球蛋白B的结合位点正好是这5 个潜在位点中的一个,即Trp19-Arg124附近的外表面。这与Liang Li等[45]报道的白藜芦醇的结合位点相似,根据其报道结合在该位点的白藜芦醇的溶解性明显增加。因此推测,结合β-乳球蛋白B后槲皮素的溶解性能也会明显提升。
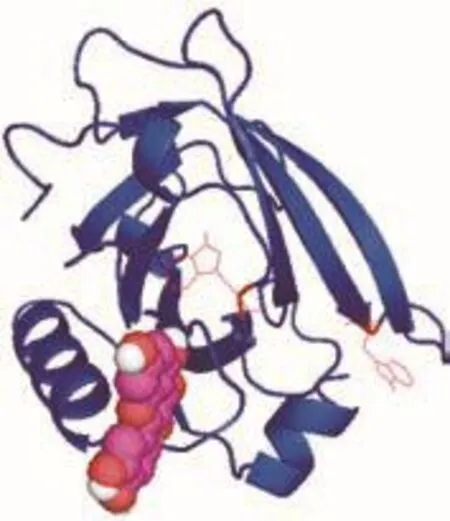
图8 槲皮素与β-乳球蛋白B结合位点图Fig. 8 Binding sites between quercetin and β-lactoglobulin B
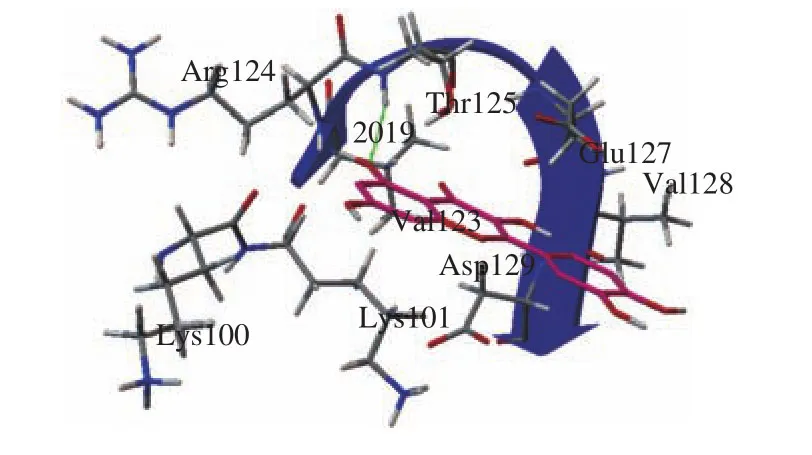
图9 氨基酸残基与槲皮素的相互作用Fig. 9 Interaction of amino acid residues with quercetin
2.7 溶解度变化分析
将3.75 μg/mL槲皮素标准品和稀释100 倍样品的液相色谱进行对比(图10),发现二者峰形和保留时间保持一致。以槲皮素质量浓度(μg/mL)为横坐标,以峰面积为纵坐标进行线性分析,得到方程:Y=1.33×105X+1.45×105,R2=0.999 8。同时进行3 次重复实验,结果表明,槲皮素在质量浓度为0.95~30 μg/mL范围内与峰面积呈现良好的线性关系。将稀释100 倍样品的峰面积值代入该公式,得到稀释后样品中槲皮素质量浓度为1.66 μg/mL,因此原样中槲皮素质量浓度为166 μg/mL。槲皮素在水溶液中的溶解度为0.09 μg/mL[23]。所以,β-乳球蛋白B的结合使槲皮素溶解度增大至原来的1 844 倍左右。

图10 槲皮素标准品(A)和结合β-乳球蛋白B后的槲皮素(样品)(B)的色谱峰Fig. 10 Chromatographic peaks of quercetin standard (A) and quercetin-β-lactoglobulin B complex (B)
目前用于包埋槲皮素提高其水溶解性的主要材料是β-环糊精和羟丙基-β-环糊精。根据库尔班江·巴拉提[46]的报道,β-环糊精包埋后槲皮素的溶解度为26.94 μg/mL,羟丙基-β-环糊精包埋后槲皮素的溶解度为2 224.21 μg/mL。通过对比可知,β-乳球蛋白B对槲皮素的增溶作用高于β-环糊精,低于由β-环糊精改性获得的羟丙基-β-环糊精。这也提供了一个新思路,如果将β-乳球蛋白B进行改性,其对槲皮素的增溶作用是否会发生大幅度地提高,有待进一步验证。
3 结论与讨论
结果表明,槲皮素可在氢键和范德华力的共同作用下牢固地结合到β-乳球蛋白B中的潜在结合位点Trp19-Arg124附近的外表面上。在结合的过程中,由于槲皮素的疏水性,以及它与蛋白之间的相互作用,导致结合位点附近的蛋白二级结构和微环境发生了变化,诱导结合位点处部分的α-螺旋转变为β-折叠,并且使得结合位点暴露在一个更加疏水的微环境中。在与β-乳球蛋白B结合之后,槲皮素的水溶性得到了很大的提升,增大至原来的1 844 倍左右,其原因是β-乳球蛋白B的包埋使得槲皮素在水溶液中受到的疏水作用减小,因此β-乳球蛋白B可作为槲皮素的载体用于增大槲皮素的水溶性,这为研究槲皮素抑制晚期糖基化终末产物机理提供参考依据。
本研究虽然发现了槲皮素与β-乳球蛋白B的结合机制,但是并未对结合β-乳球蛋白B后槲皮素的生理活性做进一步研究。目前在一些细胞和动物实验中发现,β-乳球蛋白的水解产物具有降低胆固醇和抗氧化等生理活性[47],槲皮素也具有抗氧化、降血脂、抑制AGEs[2]等一系列生理活性,而槲皮素在与β-乳球蛋白B的结合过程中只损失了一个羟基,其余活性的羟基并未受影响,因此推测在与β-乳球蛋白B结合后槲皮素的抗氧化活性、抑制AGEs的活性并未受降低,反而是得到了β-乳球蛋白B的保护,并且二者的结合物同时具有降血脂和降低胆固醇的生理活性。这需要进一步的实验验证,同时也为后续的研究提供了一个切入点。
