规整有机分子自聚集体对铜的高效缓蚀的研究
2020-10-27罗雪荆川黄海军李红茹王治永王震强高放张胜涛
罗雪,荆川,黄海军,李红茹,王治永,王震强,2,高放,张胜涛
(1 重庆大学化学化工学院,重庆400044; 2 重庆师范大学化学学院,重庆,401331)
引 言
铜及其合金具有优异的导电性、导热性和机械加工性以及对大气和化学试剂的化学惰性等优越性能,在许多工业领域得到了广泛的应用[1−2]。另一方面,铜及其合金暴露在强侵略性环境中可能受到严重腐蚀[3],如在高浓度的盐溶液环境中易被腐蚀。由于水资源短缺,海水通常直接代替淡水用于工业制造。因此,在高盐水溶液中实现铜的高效腐蚀抑制对于海洋资源、能源、生态、环境和国防力量等都有至关重要意义。
一般认为,当铜在高浓度的腐蚀性无机盐介质中一旦发生腐蚀,金属就可能与一些携带杂原子的有机分子(如含氮、氧、硫、磷原子的有机分子)形成一价铜螯合物的保护层[4−5]。由于含有孤对电子的杂原子电子云密度较大,保证了有机分子与金属铜原子的空d 轨道的化学配位,形成的有机保护膜能有效地抑制金属在侵略性氯化物水溶液中被腐蚀[4−5]。特别是含有N−杂环的有机分子,比如苯并三氮唑[6]、唑类[7]、吡啶衍生物[8]以及苯并咪唑衍生物[9]常被用作铜在氯化钠水溶液中的有机缓蚀剂。研究表明,含单N−杂环的有机缓蚀剂分子可能由于配位原子数目的缺乏,在铜表面通常不易发生强烈的化学吸附,所以不易迅速形成坚固的保护层,在较低缓蚀浓度下,难以获得优异的缓蚀效应。
因此,必须对铜在高浓度NaCl溶液中的缓蚀策略进行深入研究。为此,本文提出了制备含有氮、氧杂原子基团的有机分子的纳−微米自聚集体作为缓蚀材料。有机缓蚀分子的自聚集体包含数目众多的杂原子片段,将大大激励有机缓蚀分子自聚集体与金属铜离子之间的化学螯合作用,从而在铜表面上可能产生强烈的化学吸附作用而形成坚韧的自组装膜即有机保护层。
众所周知,由亲水和疏水链段组成的有机分子,在水介质中可能存在强大的分子内和/或分子间相互作用力,可以形成由疏水核和亲水核组成的纳−微米自聚集体[10−11]。由此,本文提出合成新的两亲性共轭分子,4,4'−{苯−1,3−二基二[(1E)−3−羰基丙−1−烯−1,3−二基]}二[2−(2H−苯并三唑−2−基)苯醇酸]二钾,BDBD,4,4'−{benzene−1,3−diylbis[(1E)−3−oxoprop−1−ene−1,3−diyl]}bis[2−(2H−benzotriazol−2−yl)phenolate] dipotassiu,图1),其分子骨架中的共轭疏水π 骨架和亲水性钾离子将有利于目标分子BDBD形成自聚集体。

图1 目标分子BDBD的化学结构和合成路线Fig.1 Chemical structure and synthesis route of the target molecule BDBD

图2 目标分子BDBD形成自聚集体并有效吸附在铜表面示意图Fig.2 Schematic diagram of the formation of the target molecular BDBD aggregates efficiently adsorbed on copper surface
首先在3.5%NaCl/ DMSO(二甲基亚砜) (40/60,体积比;NaCl 质量分数为3.5%)水溶液中制备了目标分子BDBD 自聚集体,然后将金属铜浸没于BDBD 自聚集体溶液中。当形成的稳定有机自聚集体在铜表面吸附完成后,在铜片表面形成自组装膜,将铜片取出,进行下一步在3.5%NaCl 水溶液中的电化学缓蚀研究,实验示意图如图2所示。
利用扫描电子显微镜(SEM) 对形成目标分子BDBD 自聚集体的形貌与尺寸进行表征。通过傅里叶变换红外光谱(FT−IR)、拉曼光谱(Raman)和X 射线光电子光谱(XPS)进一步研究目标分子的自聚集体对铜样品上的化学吸附机理。基于不同测试方法包括动电位极化曲线和交流阻抗谱(EIS)研究稳定BDBD 自聚集体吸附于铜表面后,形成自组装膜,在3.5% NaCl 溶液中对铜的缓蚀效率,并利用吸附等温线深入分析目标分子BDBD 自聚集体在铜表面的吸附机理,并结合实验和分子模拟结果对化学吸附进行探讨。
1 实验材料和方法
1.1 材料
如图1 所示,通过多步反应路线制备目标分子BDBD,所需原料由Sigma−Aldrich 化学公司提供。本研究使用的有机溶剂均为分析纯(99.5%),由Acros 化学公司提供。目标分子的合成与表征见附录及图A1。
选用纯铜(99.99%,质量分数) 制备工作电极,将铜电极预先加工成直径0.01 m、厚度为0.002 m 的圆柱形电极。除0.25π cm2面积外,金属电极的其余部分用环氧树脂包裹。然后,将铜电极分别用400、800、1200、2000、3000 目(粒径分别对应38、19、12、6.5、5 μm)碳化硅砂纸逐级打磨,再分别浸入丙酮和乙醇中超声清洗,最后在室温下烘干。
1.2 目标分子BDBD 在NaCl/DMSO 水溶液中自聚集体的形成
利用再沉淀法制备了目标化合物BDBD 的纳−微米自聚集体。在298 K 下,将含有目标分子BDBD (1×10−3mol/L) 的DMSO 溶 液 迅 速 转 移 到0.005 L NaCl/DMSO 溶液中(水体积分数为10%~90%,NaCl 质量分数为3.5%),并超声使溶液混合均匀。由于溶剂极性的急剧改变,从而形成了BDBD自组装体,样品浓度为1×10−4~7×10−4mol/L。用扫描电子显微镜(SEM)对自聚集体的形成过程进行了表征。在测定前,将含有BDBD 自聚集体的3.5%NaCl/DMSO 溶液滴在硅单抛面片上,放在真空干燥箱中快速干燥。在制备好的含有BDBD 自聚集体的单抛面片上用真空镀膜法喷一层金以增加导电性。然后在加速电压为5×103V 的条件下, 采用扫描电镜(Jeol−JSM−3.5 CF−Japan)对所制备的BDBD 自聚集体的形貌和尺寸进行表征。
1.3 稳定的BDBD自聚集体在铜表面的吸附
将铜电极在7 mol/L HNO3溶液中处理10 s 后获得无氧化物的清洁表面[12]。然后立即用蒸馏水和无水乙醇冲洗,并立即浸入含有稳定的目标分子BDBD 自聚集体的NaCl/DMSO 溶液中浸泡一定时间。待形成有机自组装膜后,取出电极,用无水乙醇冲洗并在氮气中干燥。在测量之前,吸附了BDBD 自聚集体的铜电极保存在真空干燥环境中。
1.4 电化学测试金属铜的缓蚀效率
在振幅为5 ×10−3V、扫描频率范围为1×105~0.01 Hz 的开路电位(OCP) 下进行电化学阻抗谱(EIS) 测试。将吸附了目标分子BDBD 自聚集体的铜电极在3.5%NaCl溶液中浸泡1800 s,使电极的腐蚀电位达到稳定值。通过ZSimpWin 软件对阻抗数据使用相应的等效电路图进行拟合分析,并得到等效电路中各元件的值。在电势范围± 0.25 V(相对OCP),扫描速度1×10−3V/s 下进行动电位极化曲线测试。所有电化学测试均在298 K 下测试。本文所有的电势值是相对于ESCE(饱和甘汞电极的标准电势)。
根据极化曲线和电化学阻抗定义的BDBD 自聚集体的缓蚀效率可分别按式(1)和式(2)计算[13]:

式中,jcorr,0和jcorr分别为未吸附和吸附了稳定的BDBD 自聚集体下的腐蚀电流密度;Rct,0和Rct分别为未吸附和吸附了稳定的BDBD 自聚集体下的电荷转移电阻。
1.5 铜电极的表面表征
对分别浸泡在含有稳定的BDBD 自聚集体和不含有缓蚀剂的3.5%NaCl 溶液中的铜电极进行了表面形貌分析,以及对吸附稳定的BDBD 自聚集体的铜在3.5%NaCl 溶液中浸泡14 d 后的金属表面进行表征。采用型号为Nicolet iS50 (Thermal Fisher,USA) 傅里叶变换红外光谱(FT−IR),扫描范围为500~4000 cm−1,并用拉曼光谱仪(Renishaw, UK) 对吸附了稳定的BDBD 自聚集体的铜电极的表面进行分析。利用514.5 nm 的氩离子激光束,在1.7 ×10−3W 下对金属表面进行聚焦。以拉曼位移在519 cm−1的硅为基准进行校准。在298 K 下,使用单色Al Kα源 和 电 荷 中 和 剂 的K−Alpha XPS 系 统(Thermal Fisher, USA) 进行XPS 测定。所研究原子的结合能以脂肪族碳污染C 1s XPS 谱图(284.8 eV)为基准。
2 实验结果与讨论
2.1 目标分子BDBD 在3.5% NaCl/DMSO 溶液中自聚集体的形成
通过SEM确定了目标分子BDBD在发生一定的自聚集时间内,形成自聚集体的混合溶液(3.5%NaCl/DMSO 溶液)的最佳有机溶剂的体积比。图3为通过扫描电镜观测浓度为5×10−4mol/L 的BDBD自聚集体在3.5% NaCl/DMSO 溶液中的形成过程。结果表明,目标分子BDBD 在DMSO 和H2O 体积比为40∶60的条件下,随着自聚集时间延长,目标分子发生了有序的分子堆积。
图3(a)为目标分子BDBD 聚集20 min 后的自聚集体的SEM 图。可以看出,在20 min 自组装时间内没有形成规则的自聚集体。随着自聚集时间延长到1 h,所得到的自聚集体形状更加规则且尺寸也随之增大[图3(b)]。并且在自组装时间2 h 后,得到了尺寸4~5 μm 的较厚的立方体的BDBD 自聚集体[图(3c)]。进一步发现,随着自聚集时间延长到6 h 时,BDBD 自聚集体的尺寸和形貌随着自聚集时间的增加没有发生显著的变化(附录中图A2),这表明目标分子BDBD 在温度为298 K 时,2 h 自聚集时间内达到稳定的自聚集状态。

图3 目标分子BDBD自聚集体在浓度为5×10−4 mol/L条件下,在混合溶剂3.5%NaCl/DMSO溶液中(DMSO体积含量40%)聚集20 min后的扫描电镜图像(a);1 h后的扫描电镜图像(b);2 h后的扫描电镜图像(c)Fig.3 SEM images of BDBD aggregates at 5×10−4 mol/L in the mixed 3.5%NaCl solution/DMSO(40%volume ratio of DMSO)at aggregation time course of 20 min(a),1 h(b),2 h(c),respectively
图4 为不同浓度(1.0×10−4~7.0×10−4mol/L)的目标分子BDBD 在3.5% NaCl/DMSO 溶液中(DMSO/H2O, 体积比, 40/60)自聚集2 h 后的SEM 图。从图中可以看出,BDBD 自聚集体的尺寸和形状与浓度有关。随着BDBD 浓度的增加,BDBD 自聚集体的形状从颗粒状(1.0×10−4mol/L)生长为规则的立方体(5.0×10−4mol/L)。然而,当BDBD 的浓度进一步增加到7.0×10−4mol/L 时,产生了不规则自聚集体[图4(d)]。这可能是由于在较大浓度下,BDBD 分子发生团聚作用发生无序堆积。结果表明,BDBD 在3.5%NaCl/DMSO 溶液中自聚集2 h,且浓度5.0×10−4mol/L时为最佳自聚集条件。
2.2 吸附了稳定的BDBD 自聚集体后的铜表面的SEM图
利用扫描电子显微镜研究了在298 K 下,铜片浸泡在含有不同浓度的稳定的BDBD 自聚集体的3.5% NaCl/DMSO 混合水溶液中3 h 后的表面形貌。打磨好的铜片呈现出平坦而光滑的表面[图5(a)]。将铜片浸入含有稳定的BDBD 自聚集体的NaCl/DMSO 水溶液中时,铜片表面被BDBD 自聚集体覆盖,形成自组装膜[图5(b)~(d)]。
从图5 中可以看出,在BDBD 自聚集体浓度为5.0×10−4mol/L 时,铜表面形成的自组装膜更加致密[图5(c)]。虽然在浓度为3.0×10−4mol/L 时,BDBD 自聚集体也可以吸附于铜表面形成自组装膜,但其表面的打磨痕迹仍然清晰可见[图5(b)]。此外,从图5(d)可以看出,浓度为7.0×10−4mol/L 的BDBD 自聚集体未能有效地吸附于铜表面,这可能因为浓度过大时产生的不规则自聚集体对金属表面的吸附能力较弱,且大浓度下产生的空间位阻效应不利于缓蚀分子自聚集体有效地吸附于铜表面。结果表明,在浓 度 为5.0×10−4mol/L 时 形 成 的 形 状 更 为 规 则 的BDBD自聚集体能更有效地吸附在铜表面。
根据上面实验结果,进一步以最佳吸附浓度为例,图6 为铜试样在5.0×10−4mol/L BDBD 自聚集体3.5% NaCl/DMSO 溶液浸泡3 h 后取出,然后将金属浸泡于3.5% NaCl 溶液14 d 的表面形貌图。从图6中可以看出,与图5(c) 相比,金属铜表面虽有一定的腐蚀,但总体并不明显,有机缓蚀剂自聚集体仍在铜表面呈现出致密的吸附保护层,再次证明该有机缓蚀剂自聚集体与铜表面能够产生强烈的吸附作用,形成优异的有机保护膜。进一步研究发现没有覆盖BDBD 自聚集体保护层的空白铜试样,在3.5% NaCl 溶液14 d 的表面形貌完全被腐蚀(附录中图A3)。

图4 自聚集时间2 h,在3.5%NaCl/DMSO混合水溶液(DMSO体积比为40%)中,BDBD自聚集体浓度分别为1.0×10−4 mol/L(a)、3.0×10−4 mol/L(b)、5.0×10−4mol/L(c)、7.0×10−4mol/L(d)时,样品的扫描电镜图Fig.4 SEM images of the BDBD aggregates in the mixed 3.5%NaCl DMSO aqueous solution(40%DMSO volume ratio)at 2 h evolving time with diflerent BDBD concentration:1.0×10−4 mol/L(a),3.0×10−4 mol/L(b),5.0×10−4mol/L(c),7.0×10−4mol/L(d)

图5 铜表面的SEM表面形貌分析:打磨好的铜试样的表面形貌(a);铜试样在3.0×10−4mol/L(b)、5.0×10−4mol/L(c)和7.0×10−4mol/L(d)的BDBD自聚集体、3.5%NaCl/DMSO溶液浸泡3 h后的表面形貌Fig.5 SEM micrographs of the studied Cu specimen surfaces:before the immersion in the 3.5%NaCl/DMSO aqueous solution containing the stable BDBD aggregates(a);after the immersion in the 3.5%NaCl/DMSO aqueous solution with 3.0×10−4mol/L of the stable BDBD aggregates for 3 h(b);after the immersion in the 3.5%NaCl/DMSO aqueous solution with 5.0×10−4mol/L of the stable BDBD aggregates for 3 h(c);after the immersion in the 3.5%NaCl/DMSO aqueous solution with 7.0×10−4mol/L of the stable BDBD aggregates for 3 h(d)

图6 铜试样在5.0×10−4mol/L稳定的BDBD自聚集体的3.5%NaCl/DMSO溶液浸泡3 h后,取出浸泡于3.5%NaCl溶液14 d后的表面形貌图Fig.6 SEM micrographs of the studied Cu specimen surface absorbed with 5.0×10−4mol/L of the stable BDBD aggregates for 3 h in 3.5%NaCl/DMSO,which was take out and immersed in the 3.5%NaCl for 14 d
2.3 稳定的BDBD 自聚集体吸附在铜表面的光谱测试
2.3.1 傅里叶变换红外光谱(FT−IR)和拉曼(Raman)光谱分析 利用FT−IR和拉曼光谱对在含有5.0×10−4mol/L 的稳定的BDBD 自聚集体的3.5%NaCl/ DMSO 溶液中浸泡3 h 后的铜片表面和纯的BDBD固体粉末进行了测试。
从图7(a)、(b)可以看出,在3100~3500 cm−1左右的宽峰是水峰和目标化合物BDBD 中C—H 键基团的振动造成的。在 图7(a) 中,1650 cm−1处的峰是C N 键的伸缩振动峰[14]。然而,在图7(b)中没有发现此峰。而且 图7(a) 中,大约在1520 cm−1和1700 cm−1处为C—N 和C O 的振动峰,在 图7(b)中同样没有这两个峰出现。结果表明,稳定的BDBD 自聚集体通过C—N 或C N 键与铜离子之间的化学配位键吸附在金属表面上。此外,在拉曼光谱图中1100 cm−1处出现了Cu−N 振动峰[图7(c)],而没有出现目标分子BDBD 含有的C N 或C—N 振动峰,这进一步证明了这些基团可能与金属离子发生了化学螯合作用。
2.3.2 X 射线能级谱图分析(XPS) 利用XPS 进一步分析了稳定的目标分子BDBD 自聚集体在铜表面上的化学吸附。图8 为在不含缓蚀剂的3.5%NaCl/DMSO 溶液中浸泡3 h后的铜表面的Cu、C 和O 元素的XPS 图谱。从图8(a)、(b)可以看出,在952.3 eV 和932.4 eV 处分别为Cu 2p1/2和Cu 2p3/2的结合能。而将铜放入3.5% NaCl 溶液中,会形成Cu(I) 络合物。同时,由于在大约943 eV 和963 eV 处没有能级峰,表明在铜表面上没有Cu(II)的存在[15]。图8(c)为空白溶液的C 1s 能级谱图,图中含有C—C 和C—O 基团的特征能级峰,这是由于碳污染及空气中二氧化碳所致。
如图9(a) 所示,大约在932.51 eV 处出现了Cu 2p3/2峰,是Cu (0)和Cu(Ⅰ)的特征峰。但是,在933~945 eV 范围内没有出现Cu(Ⅱ)的特征峰[16]。图9(b)中281~289 eV 是C 1s XPS图谱。图中表明了BDBD分子中含有许多不同的含碳基团,包括C C(283.80 eV), C—C (284.80 eV),C N (285.70 eV),C O/C—O(2287.60 eV)[17]。
上述C 1s 峰表明,铜表面存在不溶性BDBD 自聚集体的有机自组装吸附层。图9(c)为铜表面的O 1s 的能级谱图。腐蚀产物Cu2O 和CO2污染的能级峰分别为530.19 eV、531.85 eV[18]。结果表明,在氯化钠水介质中,铜的腐蚀过程到了生成亚铜离子阶段。此外,分析了N 1s XPS 图谱中394~404 eV的去卷积峰[图9(d)],表明BDBD 分子中的氮原子可能存在两种不同的化学状态,并在401.28 eV 处出现了Cu∶N 的特征峰[19],暗示BDBD 自组装体是通过N−杂环和Cu(I) 发生化学络合反应从而吸附在铜表面。
2.4 吸附了BDBD 自聚集体的铜在3.5% NaCl 溶液中的缓蚀性能
2.4.1 铜电极的动电位极化曲线 图10 表明铜电极在3.5% NaCl 溶液中的阳极分支包含三个区域。随着稳定的BDBD 自聚集体浓度的增加,电位值越负。此外,吸附稳定的BDBD 自聚集体的金属电极的腐蚀电位较空白曲线腐蚀电位偏移值小于0.085 V,这表明BDBD 自聚集体可能是混合型腐蚀抑制剂[20−21]。金属电极的腐蚀电位值被认为会受到阴极和阳极反应的抑制影响[22]。因此,吸附了稳定的BDBD 自聚集体的金属电极的腐蚀电流密度值降低。腐蚀电流密度的变化是因为稳定状态下的BDBD 自聚集体吸附在铜表面并形成坚固的自组装保护层。此外,稳定的BDBD 自聚集体对金属电极表面的覆盖抑制了阳极和阴极反应。

图7 BDBD粉末的FT−IR光谱图(a);稳定的BDBD自聚集体吸附在铜表面后的FT−IR光谱图(b);稳定的BDBD自聚集体吸附在铜表面后的拉曼光谱图(c)Fig.7 FT−IR spectrum of the BDBD powder(a);FT−IR spectrum of the stable BDBD aggregates adsorbed on the studied copper specimen surfaces(b);Raman spectra of stable BDBD aggregates adsorbed on the studied copper specimen surfaces(c)
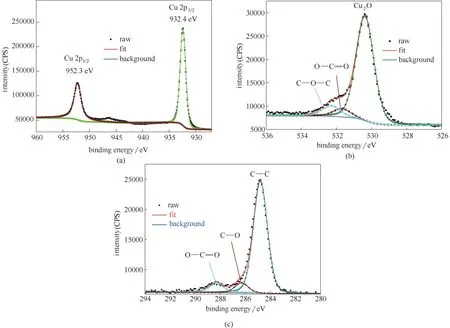
图8 在3.5%NaCl/DMSO(DMSO/H2O,体积比40/60)混合溶液中浸泡3 h后铜表面的Cu 2p(a);O 1s(b);C 1s(c)XPS谱图Fig.8 Cu 2p(a),O 1s(b),C 1s(c)XPS spectra and the fitted curves measured on the studied copper specimens that were immersion in the mixed 3.5%NaCl DMSO aqueous solution for 3 h(DMSO/H2O:40/60,volume ratio)
铜电极在3.5%NaCl 溶液中的相应电化学参数腐蚀电位(Ecorr)、腐蚀电流密度(jcorr)、阳极(βa)和阴极(βc)Tafel 斜率以及缓蚀效率(ηj),如表1 所示。由所给出的数据可知,βa和βc值随稳定的BDBD 自聚集体浓度的变化而变化(例如,βa:空白为0.04305 V/dec;稳定的BDBD 自聚集体浓度为3.0×10−4mol/L 时为0.1192 V/dec;浓度为5.0×10−4mol/L 时为0.2025 V/dec)。因此,可以认为铜表面吸附了稳定的缓蚀剂自聚集体,使得阴极和阳极反应都受到了抑制[7,23]。此外,稳定的BDBD 自聚集体的吸附抑制了阳极和阴极反应从而降低了金属铜的腐蚀速率。所以在金属电极表面形成的坚固的BDBD 自组装膜可以减缓氯离子对铜表面的侵蚀。当稳定的BDBD自聚集体的浓度为5.0×10−4mol/L 时形成了最为坚固的自组装保护膜,缓蚀效率达到最大值。
张景玲[24]的研究表明,在3%NaCl 溶液中,苯并三氮唑(BTA)分子在1.0×10−3mol/L 下缓蚀效率为60%左右,而在9.0×10−3mol/L 下的缓蚀效率约为78%。而本文所研究的稳定的BDBD 自聚集体在3.0×10−4mol/L时,即可获得74%左右的缓蚀效率,而在5.0×10−4mol/L时缓蚀效率能达到95%以上。
2.4.2 交流阻抗谱测试 为进一步研究电极的动力学过程以及电化学体系的表面特性,测试了交流阻抗谱。图11 显示了空白铜电极和吸附了不同浓度的稳定的BDBD 自聚集体在3.5% NaCl 溶液中的Nyquist 图。Nyquist 曲线在高频区呈现出明显的阻抗弧,低频区呈现直线。轻微凹陷的阻抗弧表明铜电极表面粗糙且不均匀[25]。由于Warburg 阻抗而产生的直线表明了可溶性物质CuCl2−从铜电极表面转移到溶液中以及溶液中溶解的氧侵入铜电极表面的过程[26]。结果证明了在含氯化物溶液中铜在阳极溶解和氧在阴极还原的过程受腐蚀介质的扩散所控制。
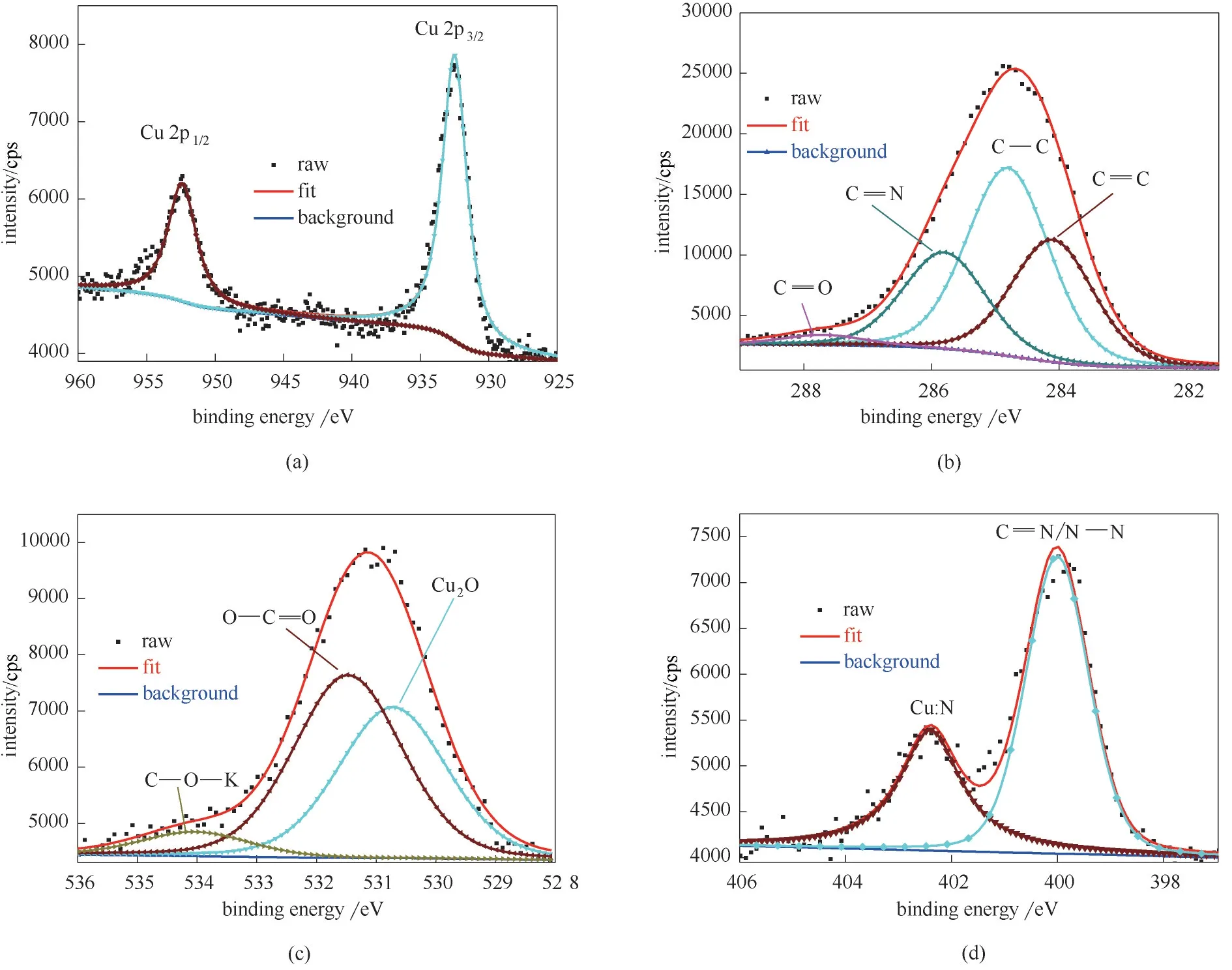
图9 铜片在含有浓度为5.0×10−4 mol/L稳定的BDBD自聚集体的3.5%NaCl/DMSO溶液(DMSO/H2O,体积比40/60)中浸泡3 h后的铜表面的Cu 2p(a);C 1s(b);O 1s(c)和N 1s(d)XPS谱图Fig.9 Cu 2p(a),C 1s(b);O 1s(c),N 1s(d)XPS spectra and the fitted curves measured on the studied copper specimens after 3 h of immersion in the mixed 3.5%NaCl DMSO aqueous solution(DMSO/H2O:40/60,volume ratio)containing the stable BDBD aggregates of 5.0×10−4mol/L

表1 空白铜和吸附了不同浓度的稳定的BDBD自组装体的铜在3.5%NaCl溶液中的极化曲线参数Table 1 Polarization parameters for the studied copper specimens covered without and with the stable BDBD aggregates of different concentrations in 3.5%NaCl solution
根据等效电路图[图12(a)为空白铜电极,图12(b)为吸附了稳定的BDBD 自聚集体的铜电极],由ZSimpWin 软件分析所得的交流阻抗数据见表2。在上述电路图中,Rs代表溶液电阻,Rf为膜电阻,Rct是与铜/溶液界面的腐蚀反应相对应的电荷转移电阻,W 是Warburg 阻抗,CPEdl表示恒定相元素(CPE)。作为双层电容(Cdl)的替代物,因为吸附有稳定的BDBD 自聚集体的铜电极不是纯电容,CPE 的阻抗值可由式(3)得到[27]。
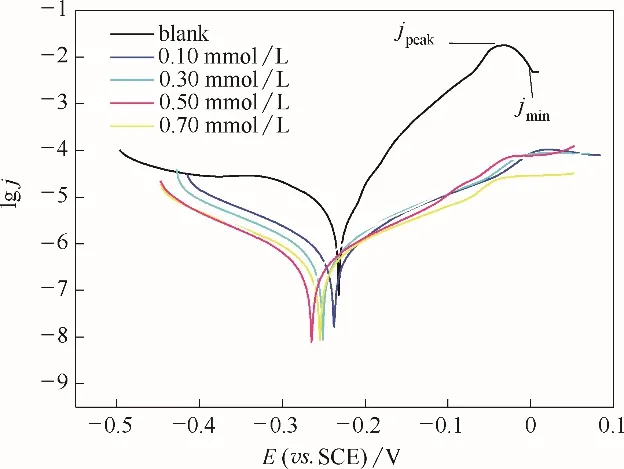
图10 空白铜片和吸附了不同浓度的稳定BDBD自聚集体的铜片在3.5%NaCl溶液中的动电位极化曲线Fig.10 Potentiodynamic polarization curves in 3.5%NaCl solution for the studied naked copper electrodes,and for the studied stable BDBD−aggregates of different concentrations covered copper electrodes

式中,Y 表示平衡因子;ω 表示角频率;n 表示偏差参数;j 表示虚根。如果n=0,则CPE 为纯电阻;如果n=1,则CPE 为纯电容。此外,根据式(4),可由CPE参数值Y和n计算Cdl的电容值[28]。

在吸附了稳定的BDBD 自聚集体的铜电极的Nyquist图中,Warburg 阻抗消失。结果表明,稳定的BDBD 自聚集体所形成的坚固的自组装膜能够防止腐蚀产物的扩散。因此,阻抗数据可以由等效电路表示[图12(b)],其中Rs、Rf、Rct和CPEdl与图12(a)中元素的含义相同。在吸附了稳定的BDBD 自聚集体的铜电极的Nyquist 图中,当稳定的BDBD 自聚集体浓度达到5.0×10−4mol/L 时,阻抗弧的直径增大到最大值,缓蚀效率达到最大值为96.11%。

图11 空白铜片和吸附了不同浓度的稳定的BDBD自聚集体的铜片在3.5%NaCl溶液中的Nyquist图Fig.11 Nyquist plots for the studied naked copper electrodes and the stable BDBD aggregates of different concentrations covered copper electrodes in 3.5%NaCl solution
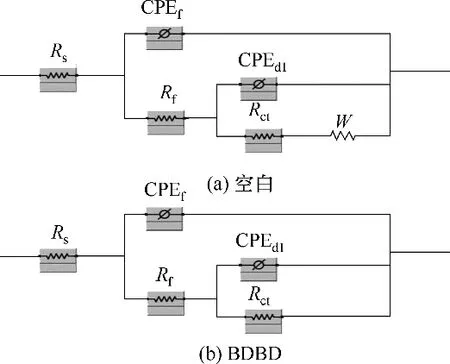
图12 在3.5%NaCl溶液中拟合EIS实验数据的等效电路图Fig.12 Equivalent circuit models fitting the EIS experimental data in 3.5%NaCl solution

表2 空白铜和吸附了不同浓度的稳定的BDBD自组装体的铜在3.5%NaCl溶液中的交流阻抗参数Table 2 Impedance parameters calculated from the EIS measurements for the studied copper electrodes without and with the stable BDBD aggregates of different concentrations in 3.5%NaCl solution
2.5 稳定的BDBD 自聚集体对金属铜表面的等温吸附线
吸附等温线可分析有机缓蚀剂分子在铜表面的吸附。不同缓蚀剂浓度下的表面覆盖度(θ)可由式(5)得到[29]:

因此,Langmuir 吸附等温线由方程式(6)[30]进一步得到:

式中,Kads为吸附平衡常数;c 为缓蚀剂浓度。Langmuir 吸 附 等 温 线 由c/θ 与c 的 线 性 回 归 曲 线 解释。相关系数(R2) 和斜率非常接近1.00(RE2=0.9899,RP2=0.9865,附录中图A4),这意味着稳定的BDBD 自聚集体在铜−溶液界面的吸附遵循Langmuir吸附模型。
Kads与吸附能ΔG有关,关系式如下[31]:
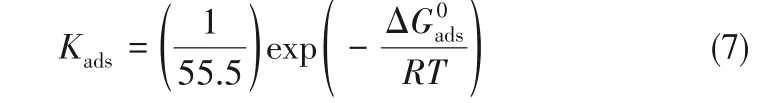
式中,R为气体摩尔常数;T是热力学温度。

表3 在298 K下,稳定的BDBD自聚集体于3.5%NaCl溶液中的吸附热力学参数Table 3 Thermodynamic parameters for the adsorption of stable BDBD aggregates in 3.5%NaCl solution at 298 K
2.6 目标分子的模拟与化学配位机制探讨
图A5(附录)所示 为优化后BDBD 分子构型、HOMO 和LUMO 前线轨道的电子云分布以及Mulliken 电荷分布。在HOMO 前线轨道中,电子云主要集中在分子右侧N原子及其周围的苯环和氧原子上。在LUMO 前线轨道中,电子云主要集中在左侧氧原子、右侧N原子及其周围的苯环和氧原子上。从Mulliken 电荷分布图可以看出,BDBD 分子中的N原子及氧原子具有较强的电负性(红色),因此较容易给出电子[32]。上述结果表明,N 杂环及氧原子在BDBD 分子自聚集体与铜表面化学络合过程中可能起着重要作用。此外,随着EHOMO能量的升高以及ΔE能量的减小,有机分子较为容易提供电子并与铜表面形成化学键,进而对铜表面起到良好的保护作用[33]。目标分子BDBD 的HOMO 轨道能量值为−6.57 eV,LUMO 轨道能量值为−0.22 eV,两者之间能量差即能隙间距ΔE = (ELUMO−EHOMO)值为6.35 eV。这样小的前线轨道能量差值有利于其与金属离子发生化学配位作用。因此,BDBD 分子自聚集体具有较强的供电子能力,能够与铜表面形成稳固的化学络合键,从而有效保护铜表面。
结合实验结果和分子模拟,推测目标分子BDBD 可能的化学络合机制如图A6(附录)所示,由于BDBD 中的苯环和C C 基团是可旋转的,因此为适应化学配位反应的发生,BDBD 分子将从最优化的分子构型(BDBD 构型Ⅰ,图A6)转变为最适宜络合的BDBD 构型Ⅱ,而BDBD 构型Ⅱ的C C 进一步旋转后发生化学络和作用,形成有机金属配位分子Ⅲ。因此,分子Ⅲ中邻近的N、O原子可与Cu原子可能存在配位键,这种化学络合机制可称为“一对一络合”(one to one coordination);而BDBD 构型Ⅱ也可以直接与Cu原子发生络合反应,得到有机金属化合物Ⅳ,这种化学络合方式可称为“二对二络合”(two to two coordination)。从分子构型的转变难易程度来说,“二对二络合”意味可直接发生化学配位作用,极有可能为目标分子BDBD 自聚集体与金属离子发生的主要化学配位方式。
3 结 论
本研究用多步法合成了离子型含双苯并三氮唑环的目标分子BDBD,并且在NaCl/DMSO 混合溶液(体积比,40/60)中,BDBD 能够发生有序的分子间堆积,形成规则的自聚集体。在3.5%NaCl 溶液中,形成的稳定的BDBD 自聚集体能够有效地吸附在铜表面,并进一步形成致密浓厚的自组装膜保护铜不受侵略性离子腐蚀。进一步研究了BDBD 自聚集体的缓蚀性能和缓蚀机理,得出以下结论。
(1) FT−IR 光谱、拉曼光谱和XPS 能谱分析表明,稳定的BDBD 自聚集体可能通过C N 和C—N键与亚铜离子之间发生强烈化学配位作用吸附在铜表面,形成自组装膜。
(2)铜电极在3.5%NaCl溶液中的缓蚀性能随吸附稳定的BDBD 自聚集体的浓度的变化规律为:1×10−4mol/L<3×10−4mol/L<5×10−4mol/L >7×10−4mol/L,研究证明了形貌更为规则的稳定的BDBD自聚集体,对金属铜在侵略性的氯化钠溶液中,表现出更为高效的缓蚀性能。BDBD 自聚集体在氯化钠溶液中对铜的缓蚀作用是通过抑制阴极和阳极反应得以实现。
(3) BDBD 自聚集体在铜表面的吸附行为符合Langmuir吸附方程。
(4) 通过目标分子BDBD 的模拟与化学配位机制探讨得到BDBD 分子自聚集体具有较强的供电子能力,能够与铜表面形成稳固的化学络合键,从而有效保护铜表面。
本文研究结果将有助于进一步开发新型有机分子的自聚集体作为缓蚀材料,实现在侵略性介质中对金属的高效缓蚀作用。
