基于TRPV1和P2X3交互作用的大鼠外周痛感觉调控机制
2019-09-03杜俊英房军帆项璇儿徐子童方剑乔
杜俊英,房军帆,项璇儿,徐子童,方剑乔
(浙江中医药大学第三临床医学院, 浙江省针灸神经病学研究重点实验室,杭州 310053)
背根神经节(dorsal root ganglion, DRG)是感觉传入的初级神经元,是感觉冲动从外周传到中枢的第一站,具有传输、传导机体感觉和伤害性感觉的功能[1]。大量的离子通道和受体在DRG中表达,如辣椒素受体(transient receptor potential vanilloid type 1, TRPV1)和P2X嘌呤受体3(purinergic P2X3 receptor, P2X3)。TRPV1和P2X3均为重要的疼痛相关受体,高度表达于DRG的中小直径神经元细胞中,参与不同类型疼痛的信号转导过程。已有研究报道,TRPV1和P2X3在DRG水平有共表达[2]。在病理状态下,动物模型和药理实验研究均发现,TRPV1和P2X3存在相关作用,且不同病理状态的相互作用关系不同[3]。在生理状态下,已有研究采用DRG神经元及转染细胞HEK293,观察到TRPV1和P2X3存在相互抑制作用[4-5]。但未在正常大鼠中观察DRG水平TRPV1与P2X3的相关作用关系。本研究拟通过足底注射TRPV1激动剂和(或)P2X3激动剂/抑制剂、P2X3激动剂和(或)TRPV1激动剂/抑制剂,观察其痛行为学、DRG水平TRPV1和P2X3阳性细胞面积、TRPV1和P2X3的共表达及相关关系,部分阐明基于TRPV1和P2X3交互作用的外周痛感觉调控机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
6周龄雄性清洁级SD大鼠72只,体重180~200 g,由中国科学院上海实验动物中心提供【SCXK(沪)2013-0016】,浙江中医药大学实验动物中心【SYXK(浙)2013-0184】饲养及完成部分实验内容。饲养期间给予啮齿类动物标准颗粒饲料及自由饮水,控制温度和湿度(23±2℃,60%),12 h循环灯光。实验过程中对动物的处置符合2006年科技部发布的《关于善待实验动物的指导性意见》,所有操作均符合实验动物伦理学要求(伦理审批号:ZSLL-2015-022)。
1.1.2 实验试剂
Capsaicin(Sigma, 美国),capsazepine(Sigma,美国),αβ-methylene ATP(Sigma,美国),TNP-ATP(Sigma,美国),兔抗大鼠TRPV1(Abcam,美国),豚鼠抗大鼠P2X3(Abcam,美国),兔抗大鼠P2X3(Abcam,美国),Alexa FluorR488标记驴抗兔二抗(Invetrogen,英国),Alexa FluorR647标记驴抗豚鼠二抗(Invetrogen,英国),GAPDH(SCT,美国),琼脂糖珠(Santa Cruz,美国),ECL试剂盒(碧云天,中国)。
1.1.3 实验仪器
荧光显微镜(Nikon,日本),冰冻切片机(Thermo,美国),抗荧光淬灭封片液(碧云天,中国),全波长分光光度仪(Molecular Devices,美国),电泳仪(Bio-Rad美国),半干转印仪(Bio-Rad,美国),Image Quant LAS 4000凝胶成像系统(GE,美国)。
1.2 方法
1.2.1 实验分组
所有大鼠完全随机分为空白对照组、TRPV1激动剂组、P2X3激动剂组、TRPV1激动剂+P2X3激动剂组、TPRV1激动剂+P2X3抑制剂组、P2X3激动剂+TRPV1抑制剂组6组,每组各12只。
1.2.2 药物处理
①TRPV1激动剂组:足底皮下注射capsaicin100 μg,体积50 μL;②P2X3激动剂组:足底皮下注射αβ-methyline ATP600 nmol,体积50 μL;③TRPV1激动剂+P2X3激动剂组:足底皮下同时注射capsaicin 100 μg,αβ-methyline ATP600 nmol,体积50 μL;④TPRV1激动剂+P2X3抑制剂组:足底皮下同时注射capsaicin100 μg,TNP-ATP 300 nmol,体积50 μL。⑤P2X3激动剂+TRPV1抑制剂组:足底皮下同时注射αβ-methyline ATP600 nmol,capsazepine 200 μg,体积50 μL。
空白对照组:注射相同剂量的生理盐水。
1.2.3 痛行为学观察
实验前,将大鼠置于铁丝网上塑料盒内1 h以适应环境,持续适应5 d。实验时,先将大鼠置于铁丝网上塑料盒内30 min适应环境,在此过程中,采用胰岛素注射针头足底皮下注射相应药物,观察大鼠每2 min内的缩足次数、抬腿/舔足持续时间,持续观察20 min。
1.2.4 免疫荧光方法观察L4DRG水平TRPV1和P2X3阳性面积表达
观察完行为学后,每组取5只大鼠戊巴比妥(40 mg/kg,bw)腹腔注射麻醉,经心主动脉生理盐水(4℃预冷)灌注至大鼠肝变白,接着缓慢推注4%多聚甲醛150 mL。快速取出注射侧L4 DRG,置4%多聚甲醛溶液中后固定3 h。然后分别置于15%、30%蔗糖溶液梯度脱水后,经液氮速冻后,置入-80℃冰箱保存备用。
行冰冻切片(厚度12 μm),TBST清洗5 min×3次,5%正常驴血清37℃封闭1 h洗,兔抗大鼠TRPV1(ab63104)或P2X3(ab10269)一抗4℃孵育过夜(含5%正常驴血清TBST稀释),Alexa FluorR488标记驴抗兔二抗37℃孵育1 h(含5%正常驴血清TBST稀释),风干,抗荧光淬灭封片液封片。荧光显微镜拍摄L4DRG处TRPV1或P2X3表达。以上步骤均避光完成。Image Pro Plus 5.0软件分析。
1.2.5 免疫荧光方法观察L4 DRG水平TRPV1和P2X3共表达
除采用兔抗大鼠TRPV1(ab63104)和豚鼠抗大鼠P2X3(ab10267)一抗4℃孵育过夜,Alexa FluoR488标记驴抗兔二抗和Alexa FluorR647标记驴抗豚鼠二抗37℃孵育1 h外,其余方法1.2.4。
1.2.6 免疫共沉淀法观察L4 DRG水平TRPV1和P2X3相互作用
观察完行为学后,每组取7只大鼠戊巴比妥[40 mg/(kg·bw)]腹腔注射麻醉大鼠,用4℃生理盐水快速灌注,直至流出液为澄清液体。快速取出注射侧L4 DRG,入预冷的EP管中,置入-80℃冰箱中保存。取L4 DRG,加Western及IP细胞裂解液(碧云天)超声粉碎,BCA蛋白定量,取200 μg蛋白混合液,加入1 μg兔抗大鼠TRPV1或1 μg兔抗大鼠P2X3,4℃缓慢摇动孵育过夜,加入平衡好的琼脂糖珠4℃摇动孵育3 h,离心去上清,裂解液清洗后加2× 上样缓冲液,95℃变性5 min,SDS-PAGE凝胶分离蛋白,半干转印至PVDF膜,5%脱脂奶粉封闭,分别加入兔抗大鼠P2X3(ab10269)或兔抗大鼠TRPV1(ab63104)4℃孵育过夜;TBST摇洗3次后加入辣根过氧化物酶标记山羊抗兔IgG(1∶10000, 美国 Santa Cruz Biotechnology公司),室温孵育2 h,TBST摇洗3次;ECL试剂盒显色,Image Quant LAS4000系统拍照。采用非沉淀蛋白做对照。
1.3 统计学方法
2 结果
2.1 生理状态下外周P2X3对TRPV1诱发的痛行为的影响
2.1.1 各组大鼠缩足、抬腿持续时间
我们观察各组大鼠药物注射后每2 min内的缩足、抬腿持续时间,共观察了20 min,结果如图1A、B所示。TRPV1激动剂组在观察的20 min内,其缩足、抬腿持续时间均显著多于正常对照组,其中在药物注射后2 min时达最高值,之后缩足、抬腿持续时间缓慢下降。TRPV1激动剂+P2X3激动剂组大鼠于药物注射后8 min,其缩足、抬腿持续时间与空白对照组比较无差异,而在药物注射后14、18、20 min时,与空白对照组比较其缩足、抬腿持续时间增多。TRPV1激动剂+P2X3抑制剂组大鼠于药物注射后6 min开始至整个实验结束,其缩足、抬腿持续时间与空白对照组比较无差异。从各组大鼠缩足、抬腿总持续时间实验观察,结果发现,TRPV1激动剂组、TRPV1激动剂+P2X3激动剂组、TRPV1激动剂+P2X3抑制剂组均能有效增加正常大鼠缩足、抬腿总持续时间;其中TRPV1激动剂+P2X3抑制剂组缩足、抬腿总持续时间显著少于TRPV1激动剂组。
2.1.2 各组大鼠缩足、抬腿次数
我们观察各组大鼠药物注射后每2 min内的缩足、抬腿次数,结果与缩足、抬腿次数相似,结果如图1C、D所示。TRPV1激动剂组在观察的20 min内,其缩足、抬腿次数均显著多于正常对照组,其中在药物注射后2 min时达最高值,之后缩足、抬腿次数缓慢下降。TRPV1激动剂+P2X3激动剂组大鼠于药物注射后8 min缩足、抬腿次数降至最低值,与空白对照组比较无差异,而后又开始增多,于药物注射后12、16、18、20 min时其缩足、抬腿次数明显多于空白对照组。TRPV1激动剂+P2X3抑制剂组大鼠于药物注射后6 min开始至整个实验结束,其缩足、抬腿次数与空白对照组比较无差异。从各组大鼠缩足、抬腿总次数实验观察,结果发现,TRPV1激动剂组、TRPV1激动剂 + P2X3激动剂组、TRPV1激动剂 + P2X3抑制剂组均能有效增加正常大鼠缩足、抬腿总次数;其中TRPV1激动剂 + P2X3抑制剂组缩足、抬腿总次数显著少于TRPV1激动剂组和TRPV1激动剂 + P2X3激动剂组。
2.2 生理状态下外周TRPV1对P2X3诱发的痛行为的影响
2.2.1 各组大鼠缩足、抬腿持续时间
我们观察各组大鼠药物注射后每2 min内的缩足、抬腿持续时间,共观察了20 min,结果如图2A、B所示。P2X3激动剂组在药物仅注射后8、10 min两个时间点其缩足、抬腿持续时间明显多于空白对照组。P2X3激动剂+TRPV1激动剂组在药物注射后2 min时其缩足、抬腿持续时间达最高值,而后逐渐下降,于药物注射后8 min降至最低,药物注射后12 min以后每2 min,其缩足、抬腿持续时间多于空白对照组。P2X3激动剂 + TRPV1抑制剂组在造模后2、4、6 min,其缩足、抬腿持续时间显著多于空白对照组,其他时间点与空白组比较无差异。从各组大鼠缩足、抬腿总持续时间实验观察,结果发现,P2X3激动剂组、P2X3激动剂 + TRPV1激动剂组、P2X3激动剂 + TRPV1抑制剂组均能有效增加正常大鼠缩足、抬腿总持续时间;其中P2X3激动剂 + TRPV1抑制剂组缩足、抬腿总持续时间显著少于P2X3激动剂 + TRPV1激动剂组。
2.2.2 各组大鼠缩足、抬腿次数
我们观察各组大鼠药物注射后每2 min内的缩足、抬腿次数,共观察了20 min,结果如图2C、D所示。与空白对照组比较,P2X3激动剂组药物注射后18 min内的每2 min其缩足、抬腿次数均增多;P2X3激动剂 + TRPV1抑制剂组于药物注射后2 min其缩足、抬腿次数最多,其后逐渐减少,于药物注射后8 min达最低值与空白对照组比较无差异,而后10、12、14、16、18、20 min其缩足、抬腿次数亦明显多于空白对照组;P2X3激动剂 + TRPV1抑制剂组仅于药物注射后2、4、6、8 min缩足、抬腿次数多于空白对照组。从各组大鼠缩足、抬腿总次数实验观察,结果发现,P2X3激动剂组、P2X3激动剂 + TRPV1激动剂组、P2X3激动剂 + TRPV1抑制剂组均能有效增加正常大鼠缩足、抬腿次数;其中P2X3激动剂 + TRPV1抑制剂组缩足、抬腿总持续时间显著少于P2X3激动剂 + TRPV1激动剂组。
2.3 生理状态下外周P2X3对TRPV1阳性面积表达的影响
我们采用免疫荧光单标法观察各组大鼠L4DRG水平TRPV1阳性面积表达,结果如图3所示。如图3B所示,L4DRG水平TRPV1激动剂 + P2X3激动剂组TRPV1阳性细胞面积表达明显多于空白对照组、TRPV1激动剂组和TRPV1激动剂+P2X3抑制剂组。
2.4 生理状态下外周TRPV1对P2X3阳性面积表达的影响
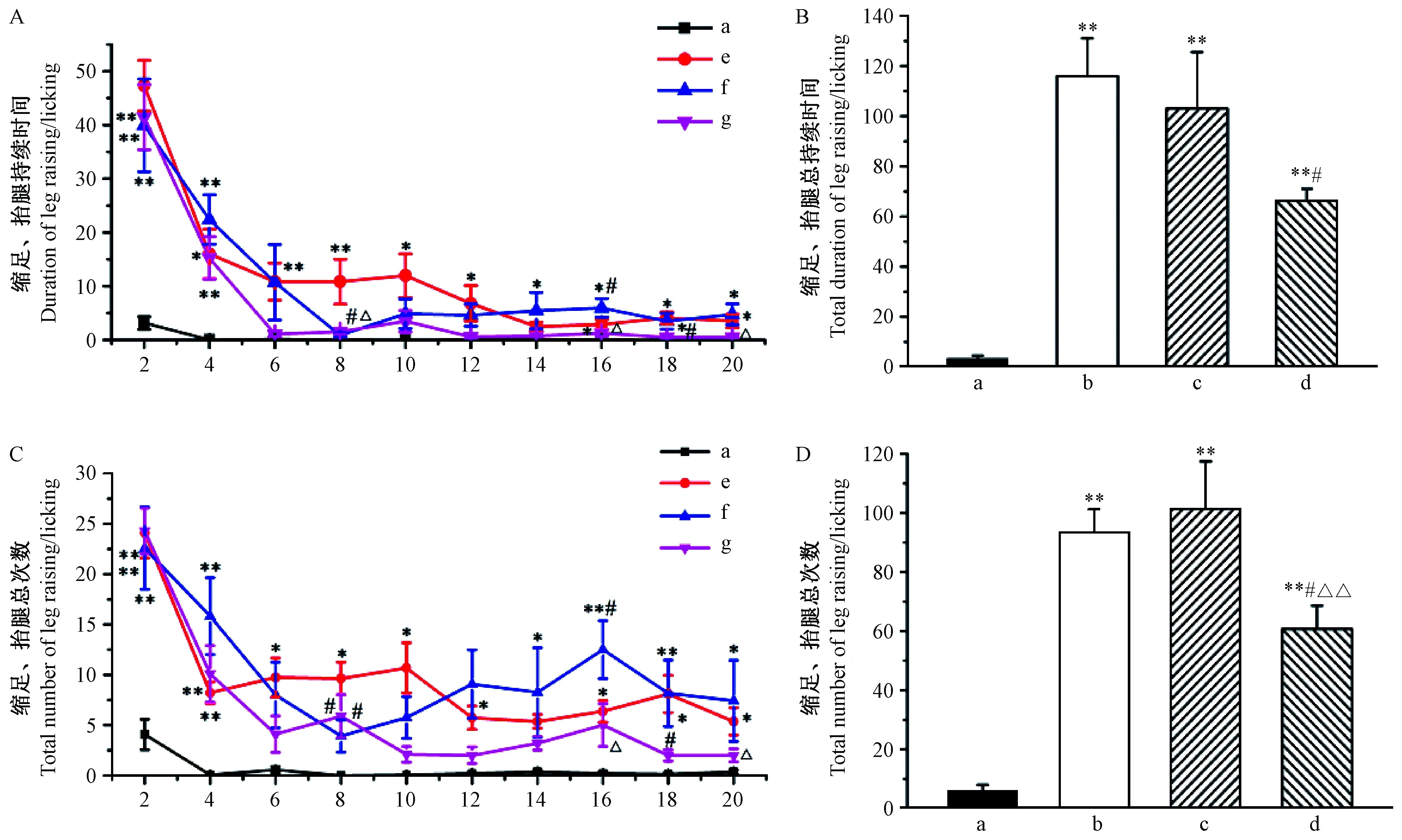
注:a:空白对照组;b:TRPV1激动剂组;c:TRPV1激动剂+P2X3激动剂组;d:TPRV1激动剂+P2X3抑制剂组;e:P2X3激动剂组;f:P2X3激动剂+TRPV1激动剂组;g:P2X3激动剂+TRPV1抑制剂组。(下图同)与空白对照组比较,*P< 0.05,**P< 0.01;与TRPV1激动剂组比较,#P< 0.05,##P< 0.01;与TRPV1激动剂+P2X3激动剂组比较,△P< 0.05,△△P< 0.01。图1 外周P2X3对TRPV1诱发的痛行为影响Note. a,control group.b,TRPV1 agonist group.c,TRPV1 agonist + P2X3 agonist group.d,TRPV1 agonist +P2X3 inhibitor group.e,P2X3 agonist group.f,P2X3 agonist +TRPV1 agonist group.g,P2X3 agonist+TRPV1 inhibitor group.(The same in the following figures)Compared with the control group,*P< 0.05,**P< 0.01. Compared with the TRPV1 agonist group,# P < 0.05,## P < 0.01. Compared with the TRPV1 agonist + P2X3 agonist group,△P< 0.05,△△P< 0.01.Figure 1 Effect of peripheral P2X3 on TRPV1-induced pain behavior

注:与空白对照组比较,*P< 0.05,**P< 0.01; 与P2X3激动剂组比较,●P< 0.05,●●P< 0.01;与P2X3激动剂+TRPV1激动剂组比较,△P< 0.05,△△P< 0.01。图2 外周TRPV1对P2X3诱发的痛行为影响Note. Compared with the control group,*P< 0.05,**P< 0.01. Compared with the P2X3 agonist group,●P< 0.05,●●P< 0.01. Compared with the P2X3 agonist group + TRPV1 agonist,△P< 0.05,△△P< 0.01.Figure 2 Effect of peripheral TRPV1 on P2X3-induced pain behavior
我们采用免疫荧光单标法观察各组大鼠L4DRG水平P2X3阳性细胞表达,结果如图4所示。如图4B所示,L4DRG水平,P2X3激动剂+TRPV1激动剂组P2X3阳性面积表达显著多于空白对照组、P2X3激动剂组、P2X3激动剂+TRPV1抑制剂组。
2.5 生理状态下外周TRPV1与P2X3的共变达及相互关系
我们采用荧光双标法和免疫共沉淀法观察L4DRG水平TRPV1和P2X3的相关关系。结果如图5所示,荧光双标法结果提示TRPV1和P2X3在DRG水平共表达于中小神经元细胞;免疫共沉淀结果提示TRPV1和P2X3之间有相关作用关系。
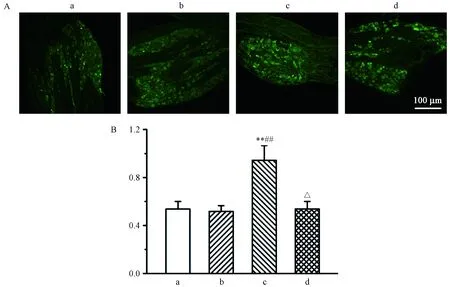
图3 各组大鼠L4DRG水平TRPV1阳性面积表达情况Figure 3 Expression of TRPV1 positive area at L4 DRG levels of the rats in each group
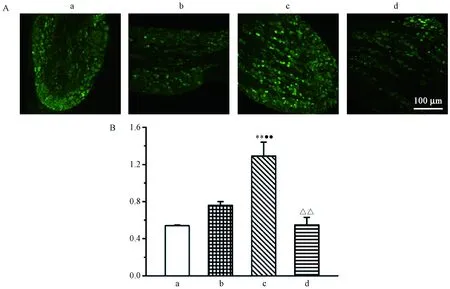
图4 各组大鼠L4DRG水平P2X3阳性面积表达情况Figure 4 Expression of P2X3 positive area at L4 DRG levels of rats in each group
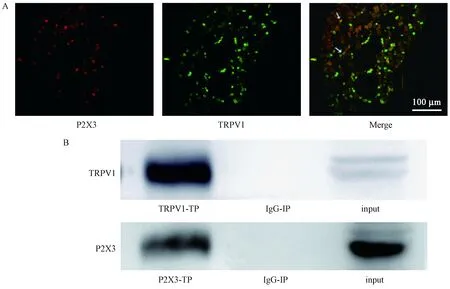
注:A. P2X3和TRPV1免疫荧光单标及双标图。B. TRPV1和P2X3免疫共沉淀图。图5 各组大鼠L4DRG水平TRPV1和P2X3共表达及共沉淀情况Note. A. P2X3 and TRPV1 immunofluorescence diagram and double-labelling immunofluorescence diagram. B. TRPV1 and P2X3 co-immunoprecipitation diagram.Figure 5 Co-expression and co-immunoprecipitation of TRPV1 and P2X3 expressions at L4DRG levels of the rats in each group
3 讨论
TRPV1和P2X3均是典型的配体门控非选择性阳离子通道。在被激活的情况下,能快速诱导神经元产生冲动,发放动作电位[6]。研究表明,P2X3在自然界的主要配体是三磷酸腺苷(ATP)[7],而TRPV1的天然配体为辣椒素。但与P2X3不同的是,TRPV1对辣椒素的敏感性受到pH值和温度的直接影响[8]。在酸性环境和高温下,TRPV1的敏感性明显提升,仅需要小剂量的辣椒素即刻激活TRPV1。已有大量动物和人体研究表明,外周神经元上的TRPV1和P2X3是生物体感受外界伤害性刺激的主要受体之一[9-11]。二者的活化参与了从生理性疼痛到病理性疼痛,从炎性痛到神经病理痛等多种疼痛的产生和维持。已有大量研究者将二者视作镇痛治疗的主要外周靶点[12-13]。已有离体实验报道,两者在外周神经元上可能存在相互作用[4-5]。但是,尚未有研究在在体正常动物系统探讨两者之间的相互作用,及其是否会否影响机体对疼痛的感觉。
在本研究中,我们发现激动TRPV1或P2X3能明显提升P2X3或TRPV1的表达水平。但在痛觉表现上,TRPV1激活会明显提升αβ-meATP诱导的自发痛,而P2X3对于capsaicin诱导的自发痛则无明显改变。课题组认为,这种变化可能与不同受体对细胞兴奋性影响的差异有关。虽然,TRPV1和P2X3均为非选择性的阳离子通道。但是,两者对细胞兴奋性的影响明显不同。大量研究报道,使用αβ-meATP激活DRG中小神经元表达的P2X3,最大内向电流均在1000 nA左右,即nA级别内向电流[14]。相应的,激活DRG中小神经元上的TRPV1,即使不使用最大剂量,也可以轻易获得pA级别的电流[15]。在电流钳模式下,以中间浓度激活P2X3获得3次动作电位[16],而激活TRPV1可以获得7次动作电位[17]。即使考虑注射药物剂量和浓度的差异,TRPV1也可以诱导远超过P2X3的外周神经兴奋。因此,课题组认为,虽然P2X3可以促进TRPV1的表达,但激活正常表达水平的TRPV1已可诱导出外周神经的最大兴奋性。虽然TRPV1的表达量明显增加,但外周神经的兴奋性已饱和,因此无法观察到自发疼痛的明显增强。而P2X3则正好相反,激活正常表达量的P2X3尚不足以诱导外周神经兴奋性饱和。因此,自发痛行为随着P2X3表达的增多发生变化。至今,尚未有研究系统比较两者激活后对神经元兴奋性的影响,课题组将会继续进行深入的研究。
本研究还发现,即使选择高度特异性的抑制剂,capsazepine和TNP-ATP能部分抑制P2X3和TRPV1诱导的疼痛。这种作用可能源于两种抑制剂通过对相应受体功能的抑制降低了外周神经的整体兴奋性。也可能是两种受体之间存在一定的相互关系,因而表现出这种特异性抑制剂的非特异性抑制作用。课题组通过免疫沉淀证实,两种受体在分子水平存在一定的相互结合作用,提示两者可能在功能水平存在交互作用,但需要更直接的证据。
综上所述,本研究发现在外周神经元水平,TRPV1和P2X3之间存在一定的相互作用。两者可以相互促进对方的表达。当其中一方受到抑制时,另一方的功能也会相应的降低。以上结果提示,在疼痛,特别是慢性痛的产生和维持过程中,外周神经元水平的相关受体可能存在相互作用。本研究结果,为进一步研究外周神经在疼痛的作用提供了一种新的角度。
