CA16感染树鼩肺成纤维细胞模型的建立及其受体SCARB2的表达
2019-09-03王文广匡德宣李娜陆彩霞罕园园仝品芬孙晓梅代解杰
王文广,匡德宣,李娜,陆彩霞,罕园园,仝品芬,孙晓梅,代解杰
(中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心云南省重大传染病疫苗研发重点实验室;中国医学科学院医学生物学研究所实验树鼩标准化与应用研究省创新团队,昆明 650118)
肠道病毒EV71(enterovirus 71,EV71)和CA16(coxsackie virus A16,CA16)是引起手足口病的主要病原体,随着EV71疫苗的上市和对EV71型手足口病的有效控制,人们不得不将焦点转向CA16,因为单价EV71疫苗尚不能交叉保护抗 CA16感染,而针对CA16研究的相对滞后使得全面控制手足口病流行的计划受阻。实际上,CA16早先就曾在世界范围内引发手足口病的大规模流行[1-4]。我国的一些流行病学调查显示,在近年来日益增加的手足口病致死病例和爆发事件中,多半是由肠道病毒71型和 CA16型交替传播或同时传播引起的[5-11],并且有证据表明,CA16感染也可以导致严重的中枢神经系统并发症和死亡[12]。
因此,加快CA16的基础研究和药物疫苗开发是已经成为当前手足口病防控工作的新重心,而合适的动物模型是支撑研发工作的关键。现已报道的CA16动物模型中[13-15],啮齿类的乳鼠和新生小鼠等因其感染年龄偏低、发病周期过短等不足限制其深入应用,非人灵长类的婴猴模型虽然病程和病症较为理想,但其实验成本过高而无法广为应用,尚需开发更为合适的动物模型。另有研究发现CA16可经呼吸道感染2月龄树鼩,使之表现出一系列与人相似的症状,并可检测到病毒血症和病理变化[16]。在此基础上,本研究拟通过CA16对树鼩肺成纤维细胞(tree shrew lung fibroblasts,TSLF)的感染实验,就其感染特性进行定性与定量研究,结合CA16受体SCARB2的表达情况和基因同源性分析结果,探讨建立其细胞感染模型的可行性,以期为CA16感染机制研究或者药物筛选提供一种新的细胞平台和技术支持。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒
TSLF,人胚肺二倍体成纤维细胞(KMB-17),柯萨奇病毒A组16型(CA16)均来自中国医学科学院医学生物学研究所树鼩种质资源中心,其中TSLF由本实验室分离保存,CA16病毒由KMB-17细胞培养获得,滴度为8.5×106TCID50/mL。
1.1.2 主要试剂及仪器
DMEM培养基(HyClone,美国),胎牛血清(BI,美国),0.25%胰蛋白酶溶液(HyClone,美国),双抗(HyClone,美国), 抗CA16 抗体(Millipore,美国),山羊抗小鼠IgG H&L-Alexa Fluor® 647(Abcam,英国),抗Scarb2 抗体(GeneTex,美国),山羊抗兔IgG H&L -Alexa Fluor® 488(Abcam,英国),RNAiso Plus(Takara,日本),One Step PrimeScriptTMRT-PCR Kit (RR064 A,Takara,日本),One Step TB GreenTMPrimeScriptTMPLUS RT-PCR Kit(RR096 A,Takara,日本)。
CFX 96实时荧光定量PCR仪(Bio-Rad,美国),Eclipse倒置荧光显微镜(Nikon,日本),二氧化碳培养箱(Thermo,美国)。
1.2 方法
1.2.1 感染实验
将状态良好的TSLF制成密度为5×104/mL的细胞悬液,按照2 mL/孔的量进行六孔板布板,待基本形成细胞单层(90%左右长满),吸弃培养液,PBS冲洗细胞单层1次,每孔加100 TCID50的CA16病毒液1 mL,孵育1 h,吸弃病毒液,添加无血清的DMEM培养液2 mL,以KMB-17细胞作对照进行同样处理,持续培养并定期观察细胞病变情况。
1.2.2 CA16病毒蛋白和受体SCARB2蛋白的免疫荧光检测
为同时观察病毒蛋白和相关受体的表达情况,间接免疫荧光鉴定实验设计为双染,即其中CA16 抗体和其二抗均为鼠源,且二抗为红色荧光标记;受体SCARB2抗体和其二抗均为兔源,且二抗为绿色荧光标记。具体操作如下:使用4%(质量体积比)的多聚甲醛溶液固定细胞20 min;加PBS 置于水平摇床上清洗2 min,反复3次;0.5%(质量体积比)的Triton-X100穿孔15 min;同上操作PBS 清洗3次,山羊血清封闭液封闭30 min;PBS 清洗3次,双染组同时加入1%BSA(质量体积比)稀释的抗CA16一抗(1∶500)和抗SCARB2一抗(1∶200),设各自单染对照,4℃过夜;PBS 清洗3次,分别加入用PBS按1∶500稀释的羊抗鼠(红色荧光)和羊抗兔二抗(绿色荧光),37℃避光孵育1 h;暗光环境中,PBS 清洗3次,滴加DAPI染核,避光孵育2 min;PBS清洗3次,在荧光显微镜下进行观察。
1.2.3 病毒载量的检测
将TSLF按5×104/孔布置24孔板,待细胞贴壁基本形成单层,以PBS冲洗后按100 TCID50每孔接种CA16病毒0.05 mL,无血清DMEM培养,实验组按照时间点2、4、6、8、10、12、18、24、48、72 h收样,每个时间点样品均设置复孔,设置空白对照。用RNAiso Plus提取RNA,按One Step PrimeScriptTMRT-PCR Kit(RR064 A)试剂盒说明进行real-time RT-PCR操作,根据不同时间点病毒的载量绘制增殖曲线。定量标准品稀释梯度为108、107、106、105、104拷贝/μL,引物探针根据CA16基因序列保守区设计:

注:A:KMB-17细胞对照;B:CA16感染KMB-17(24 h);C:TSLF细胞对照;D: CA16感染TSLF(24 h)。图1 TSLF感染CA16后24 h的形态Note. A, KMB-17 control. B, KMB-17 infected with CA16(24 h). C,TSLF control. D, TSLF infected with CA16(24 h).Figure 1 Morphology of TSLF after 24 hours of infection with CA16
CA16-F:5’-GTGACAAGAACCTCATTG-3’
CA16-R:5’-GAGCATATCCCATCAAATC-3’
CA16-P:5’-(FAM)TGTTGAACCATCACTCC ACGC(BHQ1)-3’。
1.2.4 受体SCARB2基因相对表达量的检测
以1.2.3中各个时间点样品所提取的RNA为模板,以树鼩β-actin作为内参,按照One Step TB GreenTMPrimeScriptTMPLUS RT-PCR Kit(RR096 A)说明进行real-time RT-PCR操作,均一化后的基因表达水平以2-ΔΔCq计。反应中所使用的引物根据NCBI上公布的树鼩β-actin和SCARB2相关序列设计如下:
β-actin-F:5’-CGGGAAATTGTGCGTGACAT-3’
β-actin-R:5’-AGATTCCATGCCCAGGAAAGA-3’
SCARB2-F:5’-CCCTACATCATCATGGCGCT -3’
SCARB2-R:5’-CAGGCGATGGTTAGGTTCGT-3’
1.2.5SCARB2基因序列同源性分析
利用NCBI的BLAST工具对树鼩SCARB2基因进行同源性分析,利用MEGA7软件构建相关物种的系统进化树。
2 结果
2.1 CA16感染TSLF的显微镜观察
CA16病毒接种TSLF后,定期进行显微镜观察,在感染后12 h,可见部分细胞变圆脱落;24 h后,普遍可见细胞解体,游离或成团(见图1);48 h后半数以上面积细胞死亡,72 h后完整形态的细胞仅有少数可见。TSLF感染CA16的细胞病变情况与KMB-17相似,初步观察结果表明CA16可感染TSLF。
2.2 CA16蛋白和受体SCARB2蛋白的免疫荧光观察
在初步观察到CA16可引起TSLF细胞病变的基础上,通过间接免疫荧光实验对病毒蛋白进行再确认,同时也对感染相关受体SCARB2蛋白的表达情况进行检测,其中双染实验对CA16蛋白进行红色荧光标记,对SCARB2蛋白进行绿色荧光标记。在荧光显微镜下观察CA16感染细胞24 h的结果如图2所示,红色荧光区域代表CA16病毒蛋白,主要存在于细胞质中,少量分布于细胞外,这就再次确认CA16可感染TSLF;同时,可见TSLF细胞普遍呈现绿色,表明SCARB2受体在CA16感染TSLF过程中有较多表达,很可能参与了CA16的感染进程。
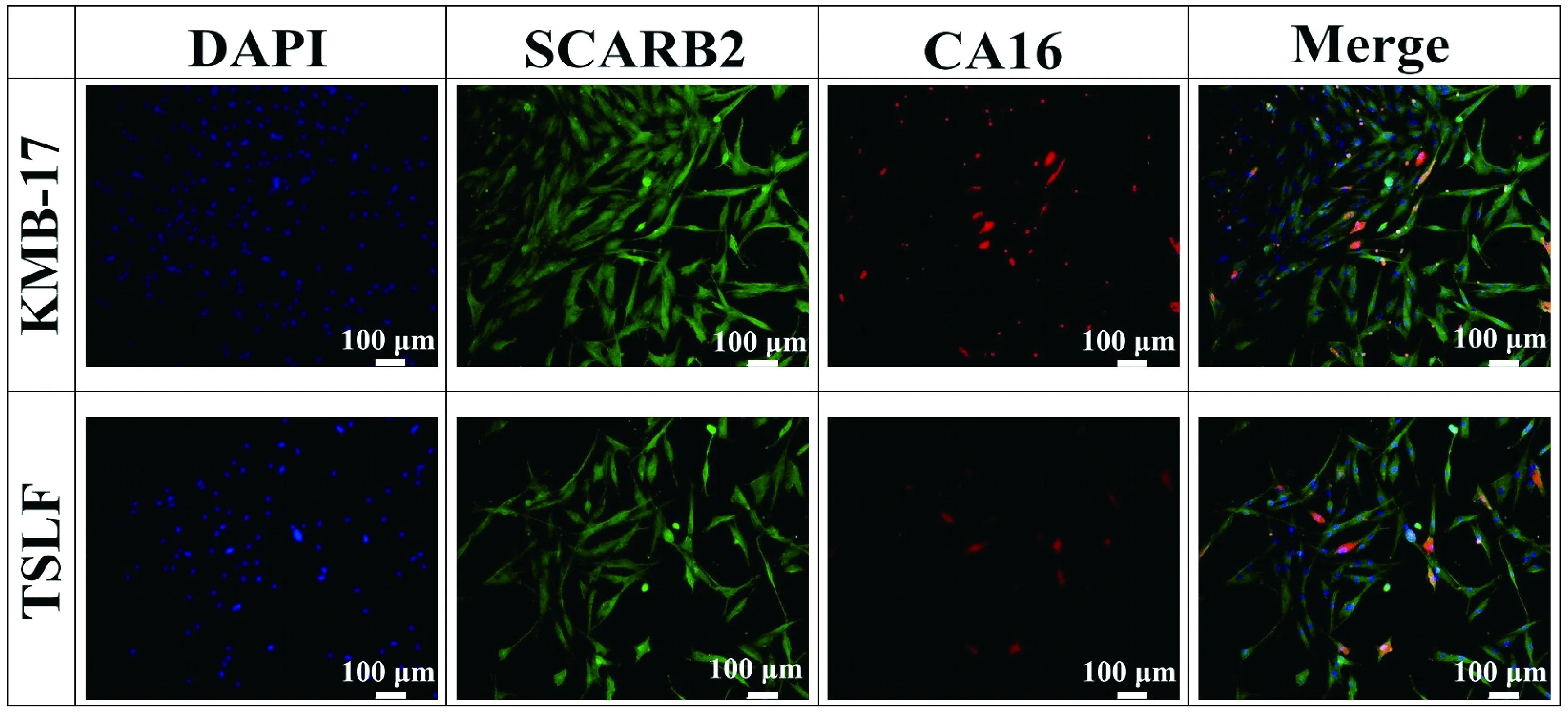
图2 CA16病毒蛋白和受体SCARB2蛋白的免疫荧光观察Figure 2 Immunofluorescence observation of CA16 protein and receptor SCARB2 protein
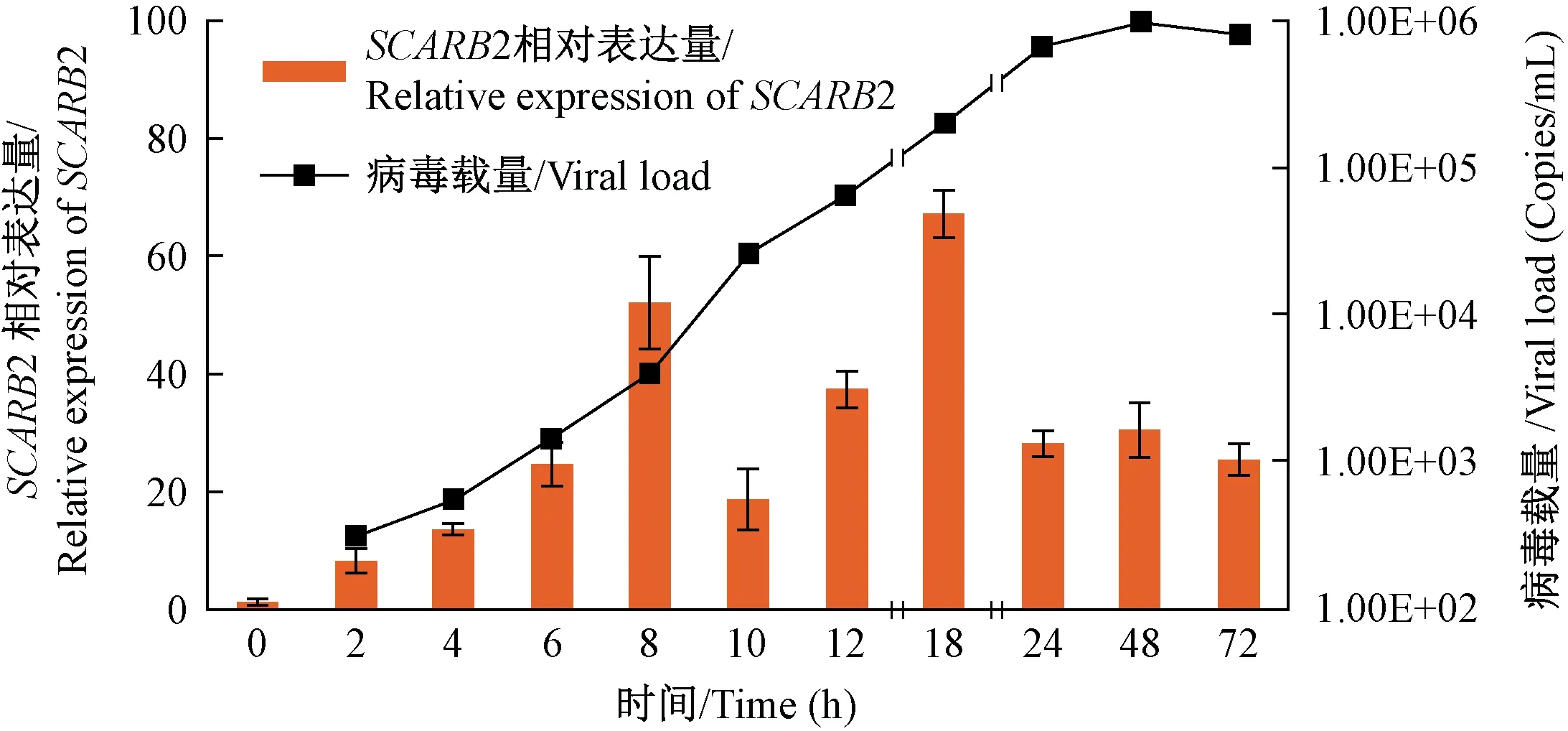
图3 CA16增殖曲线和受体SCARB2基因相对表达量Figure 3 Proliferation curve of CA16 and relative expression of receptor SCARB2 gene
2.3 CA16病毒载量和受体SCARB2基因表达情况
在对CA16病毒感染TSLF的情况进行定性观察后,再通过实时荧光定量PCR进行定量分析。以100 TCID50/105cells的接种密度,CA16感染TSLF后的病毒载量变化如图3所示,病毒经过短暂的适应,在24 h内病毒基本呈线性增殖,之后增殖趋于缓慢,48 h达到最高值9.59×105copies/mL,此后24 h并未出现较大变化。
此前免疫荧光实验观察到 CA16感染TSLF过程中有受体SCARB2蛋白的普遍存在,通过相对荧光定量PCR对其基因表达情况进行检测,如图3所示,SCARB2基因表达水平有伴随感染进程增高的趋势,前18 h基因表达比较活跃,8 h出现一次小高峰,18 h出现第二次高峰,而在24 h之后则基本维持一个相对较低的表达水平,结合病毒增殖曲线,可以看到在每次受体表达高峰之后都有病毒载量的快速升高,提示SCARB2与CA16的感染相关。
2.4 SCARB2基因序列的同源性分析
利用NCBI的在线BLAST功能,对树鼩SCARB2基因预测序列(XM_006142962.3)进行比对,结果发现其与人和非人灵长类具有较高的同源性,其中和人(AK313016.1)、食蟹猴(NM_001284776.1)、猕猴(XM_001096458.3)、绿猴(XM_007998945.1)、土拨鼠(XM_027939796.1)、裸鼹鼠(XM_004848034.2)、小鼠(BC029073.1)的同源性分别为88.69%、87.27%、87.22%、87.15%、85.35%、82.87%、82.25%。选取不同物种的多个SCARB2序列利用mega7软件进行系统进化树构建,结果如图4所示,树鼩与食蟹猴及人的遗传距离最为接近,和啮齿类等动物相距较远。
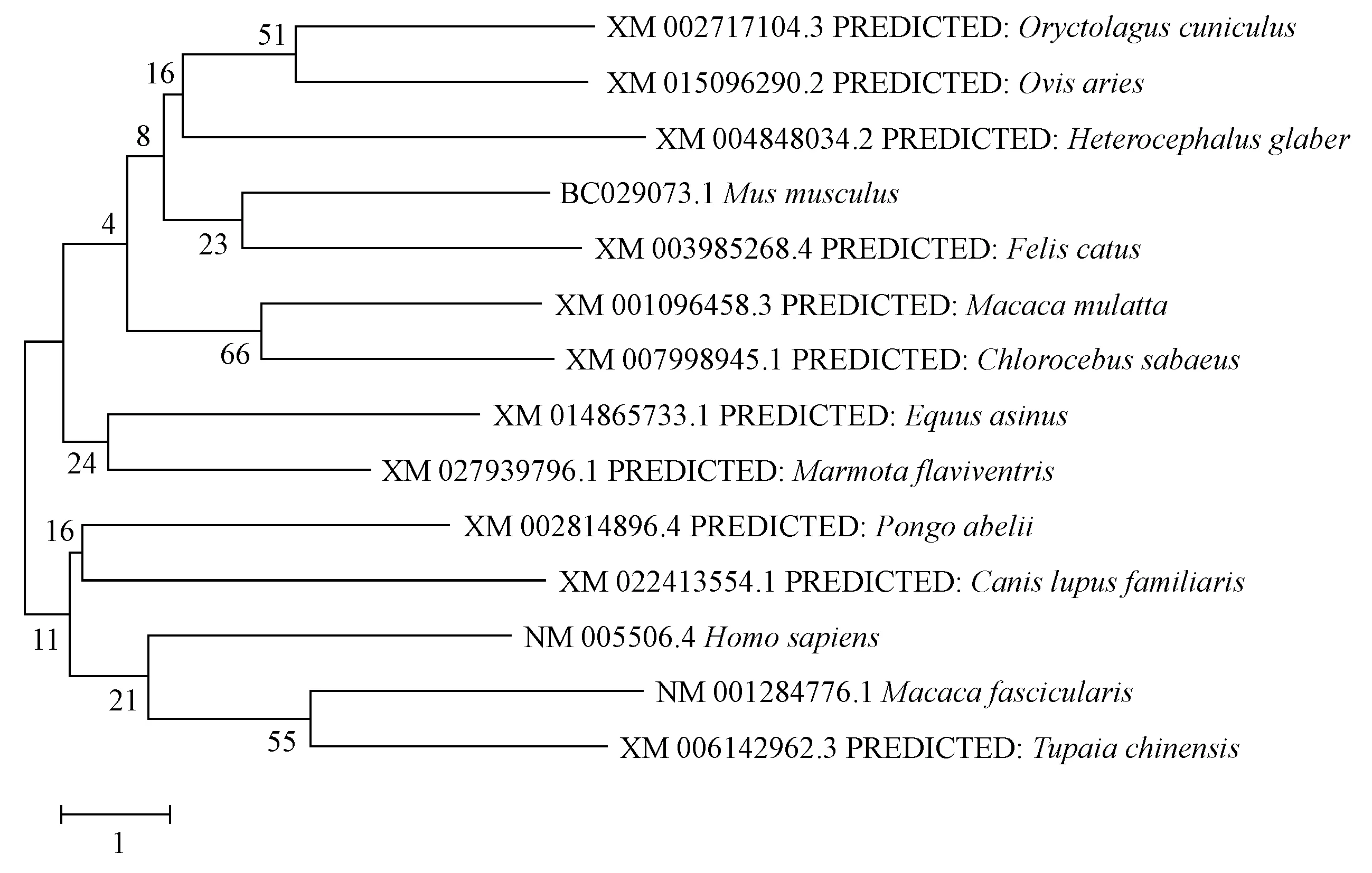
图4 SCARB2基因在不同物种的系统进化树Figure 4 Phylogenetic tree of SCARB2 gene in different species
3 讨论
啮齿类动物较早和较多的应用于CA16的研究[13-14],比较成功的有通过脑内或腹腔接种的乳鼠[13]、新生小鼠[13]以及腹腔注射的21 d内沙鼠[17],均能表现出一定的症状,但由于接种年龄、感染方式以及物种差异等因素的影响,无法完全复制CA16的病程和病理变化,也就限制了此类动物模型的深入应用。非人灵长类动物模型亦有报道[15],CA16 经呼吸道感染猕猴,可观察到手足口部疱疹和发热症状,可在血液和多种组织中检测到病毒载量,但其中和抗体反应和病理变化较弱,加之动物成本较高,在CA16的基础研究中尚不能广为应用。
除了啮齿类和非人灵长类动物模型外,新型实验动物树鼩也被用于肠道病毒相关研究,先后有人成功建立了EV71感染树鼩的体内[18]和体外模型[19],最近有研究发现树鼩对CA16具有易感性[16],将CA16通过呼吸道感染2月龄树鼩,发现感染后4~7 d,树鼩的体温和血中性粒细胞/单核细胞百分比均升高,在其粪便和包括中枢神经系统在内的多种组织中检测到高载量病毒,同时在其肺、肾等组织中也发现细胞损伤和炎性细胞侵润等病变,提示树鼩可用来建立CA16感染的动物模型。
本研究实验发现,CA16感染可引起TSLF出现变圆、脱落和裂解等细胞病变;免疫荧光实验可见CA16病毒蛋白的表达;根据实时荧光定量PCR数据可绘制出病毒增殖曲线,定性与定量数据均表明CA16可感染TSLF,这与CA16体内感染可致树鼩肺组织损伤的结果一致,基本确定建立该细胞感染模型是可行的。
多项研究证明[20-21],清道夫受体b亚类成员2(SCARB2)是CA16的受体,树鼩的SCARB2受体基因序列与人具有较高的同源性(88.69%),其进化关系比啮齿类更接近于人和非人灵长类。本研究通过免疫荧光双染实验同时观察到CA16病毒蛋白和SCARB2受体蛋白的分布,而且检测到受体基因表达水平与病毒增殖相关,基本确定树鼩的SCARB2参与CA16感染,支持CA16感染树鼩的模型的建立,同时也提示了树鼩对人肠道病毒易感的理论依据和先天优势。当然,SCARB2仅仅是报道的CA16受体之一,如何介导感染进程尚需进一步验证,此外,还有哪些受体以及如何参与还需开展更多的实验研究。
