Oct4B1基因沉默通过调控AKT/GSK-3β/β-catenin通路对膀胱癌T24细胞上皮间质转化的影响及机制研究
2022-08-15甄洪涛王朝亮
甄洪涛 王朝亮
膀胱癌是临床常见的泌尿系统恶性肿瘤,在男性中发病率居于第6位,女性中居于第16位,近年来发病率和致死率均呈上升趋势[1]。目前,膀胱癌以手术切除结合化疗等综合治疗为主,但仍有较高的复发率,给患者生命健康造成严重威胁[2]。研究表明,上皮间质转化(epithelial mesenchymal transition,EMT)是上皮细胞来源的恶性肿瘤获得侵袭和迁移能力的主要原因之一,与病灶远端转移、复发及化疗耐药等不良预后关系密切[3]。目前关于膀胱癌细胞EMT调控机制尚未完全阐明,寻找针对性干预靶点,对改善疾病预后有重要意义。八聚体结合转录因子4(octamer blinding transcription fator 4,Oct4)B1是胚胎干细胞干性转录因子Oct4的主要亚型。近年来研究表明,Oct4在膀胱癌组织中呈高表达状态,且表达程度与膀胱癌转移及远期预后关系密切[4]。体外实验证实,Oct4B1基因过表达可增强结直肠癌细胞的迁移和侵袭能力[5]。目前,关于Oct4B1基因对膀胱癌细胞EMT过程的影响研究尚少,本研究应用RNA干扰(RNA interference,RNAi)技术沉默膀胱癌T24细胞Oct4B1基因,观察对细胞EMT过程的影响,并初步探讨其影响机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 人膀胱癌T24细胞株,购自上海中科院细胞库,培养于含10%胎牛血清的RPMI 1640培养基中,培养条件为37 ℃、5%CO2。
1.1.2 主要试剂和仪器 含绿色荧光蛋白(green fluorescent protein,GFP)的Oct4B1-短发夹RNA(shRNA)质粒干扰载体、阴性对照质粒(上海吉玛制药技术有限公司),蛋白激酶B激动剂(胰岛素样生长因子IGF-I,美国Abcam公司),LipofactamineTM2000试剂盒、RNA提取试剂盒(美国Invitrogen公司),逆转录试剂盒(日本Takara公司),全蛋白提取试剂盒(上海蓝基生物科技有限公司),Transwell小室(美国Corning Incorporated公司),兔抗人Oct4B1多抗、兔抗人E-cadherin、Vimentin、N-cadherin单抗、兔抗人p-AKT、p-GSK-3β、β-catenin单抗(美国Abcam公司),辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体(北京中山金桥生物技术有限公司)。Varioskan LUX多功能酶标仪(美国Thermo Fisher公司),7300实时荧光定量PCR仪(美国ABI),CheniDoc XRS化学发光成像分析系统(美国Bio-rad公司)。
1.2 方法
1.2.1 细胞转染及分组 取对数期T24细胞,调整细胞密度为1×105/ml,重新接种于6孔板,细胞再次融合达60%时,按照LipofactamineTM2000试剂盒说明书操作,将Oct4B1-shRNA质粒干扰载体、阴性对照质粒转入T24细胞中,分别设为shRNA组、shRNA-NC组,每组5个复孔,继续常规培养5 h后,更换培养基为含10%胎牛血清的RPMI1640,继续培养至24 h,于荧光显微镜下观察转染效率。
另取转染至8 h的shRNA组、shRNA-NC组细胞,分别用AKT激动剂IGF-I(100 ng/ml)处理12 h,分别设为shRNA+AKT激动剂组、shRNA-NC+AKT激动剂组,每组5个复孔,然后更换常规培养基,继续培养至24 h进行后续实验。
1.2.2 Oct4B1 mRNA表达检测 收集转染至24 h的shRNA组、shRNA-NC组细胞及shRNA+AKT激动剂组、shRNA-NC+AKT激动剂组细胞,磷酸盐缓冲液(PBS)洗涤后,按照RNA提取试剂盒说明说提取总RNA,并用逆转录试剂盒合成cDNA。设计PCR扩增引物序列:Oct4B1:F:5′-CTGATGCTGGAACGTTAGCTG-3′,R:5′-AGTAGCTGTGATGCGTGATGC-3′;β-actin:F:5′-TAGCTGATGCTGTGAAACCT-3′;R:5′-CTATGCTGTAGTGCTGATCG-3′。按照说明说设定反应体系,反应条件为:94 ℃预变性5 min;40个循环(94 ℃变性20 s,58 ℃退火30 s,72 ℃延伸45 s);72 ℃延伸5 min。以β-actin为内参对照,2-△△CT为Oct4B1的相对表达强度。
1.2.3 侵袭能力检测 采用Transwell实验检测shRNA组、shRNA-NC组、shRNA+AKT激动剂组、shRNA-NC+AKT激动剂组细胞侵袭能力。Transwell小室滤膜由RPMI 1640培养基1∶6稀释的Matrigel包被,将小室放入24孔板,上层小室加入密度为2.0×105/ml各组细胞悬液200 μl,下层小室加入含10%胎牛血清的RPMI 1640培养基。常规培养24 h,用无菌棉签擦去上层小室细胞,以0.1%结晶紫染色0.5 h,显微镜下计数5个随机视野中的穿膜细胞数,取平均值。
1.2.4 迁移能力检测 采用划痕实验检测shRNA组、shRNA-NC组、shRNA+AKT激动剂组、shRNA-NC+AKT激动剂组细胞迁移能力。取各组细胞以2×104/ml重新接种至24孔板,完全融合为单层细胞后,用20 μl无菌枪头划直线,PBS轻柔冲洗划痕边缘,记为0 h,加入完全培养基继续培养48 h,各组细胞于0 h和48 h分别取3个不同视野进行拍照,Image分析计算细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.2.5 上皮间质标记物E-cadherin、Vimentin、N-cadherin及AKT/GSK-3β/β-catenin通路蛋白表达检测 收集转染至24 h的shRNA组、shRNA-NC组细胞及shRNA+AKT激动剂组、shRNA-NC+AKT激动剂组细胞,PBC洗涤后转至离心管,按照全蛋白提取试剂盒说明书提取总蛋白,并进行BCA蛋白定量。取40 μg待测蛋白进行SDS聚丙烯酰氨凝胶电泳恒压分离,湿法转移至聚偏二氟乙烯膜,加入5%脱脂奶粉室温封闭1 h,然后加入一抗稀释液(E-cadherin、Vimentin、N-cadherin、β-catenin均为1∶1 000,p-AKT、p-GSK-3β为1∶2 000),4 ℃孵育过夜,加入HRP标记的山羊抗兔IgG二抗稀释液(1∶10 000),常温孵育2 h,以目的蛋白与内参对照β-actin灰度值比值表示蛋白相对表达量。
1.3 统计学方法

2 结果
2.1 转染效率观察
瞬时转染48 h后,于光学显微镜和倒置荧光显微镜下观察并计算shRNA组和shRNA-NC组转染效率均>80%,可用于后续实验。
2.2 各组Oct4B1 mRNA相对表达量比较
RT-qPCR结果显示,shRNA组、shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组Oct4B1 mRNA相对表达量组间比较,差异有统计学意义(P<0.001)。与shRNA组比较,shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组Oct4B1 mRNA相对表达量均较高(P<0.05);与shRNA+AKT激动剂组比较,shRNA-NC组、shRNA-NC+AKT激动剂组Oct4B1 mRNA相对表达量较高(P<0.05),shRNA-NC+AKT激动剂组高于shRNA-NC组,差异有统计学意义(P<0.05),见表1。

表1 各组Oct4B1 mRNA相对表达量比较
2.3 各组细胞侵袭能力比较
Transwell结果显示,shRNA组、shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组穿膜细胞数分别为(21.20±3.41)个/视野、(46.80±5.73)个/视野、(95.40±10.36)个/视野、(126.60±11.48)个/视野,组间比较,差异有统计学意义(F=158.530,P<0.001)。与shRNA组比较,shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组穿膜细胞数均较多,差异有统计学意义(t=8.585、15.212、19.680,均P<0.001);与shRNA+AKT激动剂组比较,shRNA-NC组、shRNA-NC+AKT激动剂组穿膜细胞数均较多(t=9.179、13.907,均P<0.001),且shRNA-NC+AKT激动剂组多于shRNA-NC组,差异有统计学意义(t=4.02,P=0.002),见图1。

注:a为P<0.05,与shRNA组比较;b为P<0.05,与shRNA + AKT激动剂组比较;c为P<0.05,与shRNA-NC组比较。
2.4 各组细胞迁移能力比较
划痕实验结果显示,shRNA组、shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组细胞48 h迁移率分别为(25.41±4.40)%、(33.88±5.87)%、(65.15±6.50)%、(86.64±9.38)%,组间比较差异有统计学意义(F=87.144,P<0.001)。与shRNA组比较,shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组细胞48 h迁移率均较高,差异有统计学意义(t=4.211、10.622、13.215,P均<0.05);与shRNA+AKT激动剂组比较,shRNA-NC组、shRNA-NC+AKT激动剂组细胞48 h迁移率较高(t=7.984、11.321,P均<0.001),且shRNA-NC+AKT激动剂组高于shRNA-NC组,差异有统计学意义(t=2.582,P=0.033)。见图2。
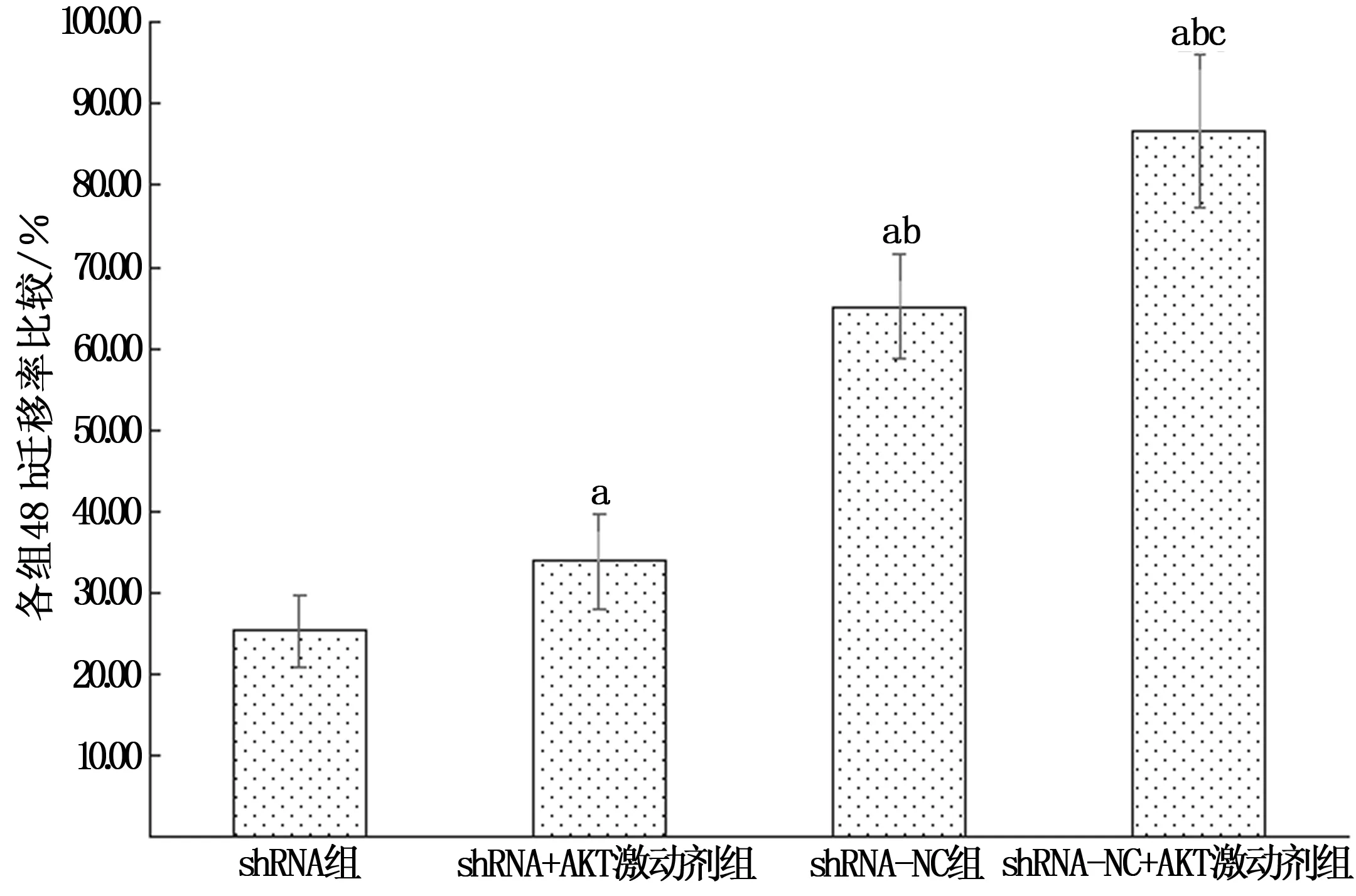
注:a为P<0.05,与shRNA组比较;b为P<0.05,与shRNA + AKT激动剂组比较;c为P<0.05,与shRNA-NC组比较。
2.5 各组上皮间质标记物E-cadherin、Vimentin、N-cadherin蛋白相对表达量比较
E-cadherin、Vimentin、N-cadherin蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与shRNA组比较,shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组E-cadherin蛋白相对表达量升高,Vimentin、N-cadherin蛋白相对表达量降低,差异有统计学意义(P<0.05);与shRNA+AKT激动剂组比较,shRNA-NC组、shRNA-NC+AKT激动剂组E-cadherin蛋白相对表达量升高,Vimentin、N-cadherin蛋白相对表达量降低,差异有统计学意义(P<0.05);shRNA-NC+AKT激动剂组E-cadherin蛋白相对表达量高于shRNA-NC组,Vimentin、N-cadherin蛋白相对表达量低于shRNA-NC组(P<0.05)。见图3A,3B。

注:a为P<0.05,与shRNA组比较;b为P<0.05,与shRNA + AKT激动剂组比较;c为P<0.05,与shRNA-NC组比较。
2.6 各组AKT/GSK-3β/β-catenin信号通路蛋白表达比较
p-AKT、p-GSK-3β、β-catenin蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与shRNA组比较,shRNA+AKT激动剂组、shRNA-NC组、shRNA-NC+AKT激动剂组p-AKT、p-GSK-3β、β-catenin蛋白相对表达量降低,差异有统计学意义(P<0.05);与shRNA+AKT激动剂组比较,shRNA-NC组、shRNA-NC+AKT激动剂组p-AKT、p-GSK-3β、β-catenin蛋白相对表达量降低,且shRNA-NC+AKT激动剂组低于shRNA-NC组(P<0.05)。见图4A,4B。

注:a为P<0.05,与shRNA组比较;b为P<0.05,与shRNA + AKT激动剂组比较;c为P<0.05,与shRNA-NC组比较。
3 讨论
膀胱癌是一种直接威胁患者生命的疾病,目前,膀胱癌早期行手术切除联合术后药物灌注治疗效果较为理想,但仍面临病灶复发和转移的风险[6-7]。临床调查显示,膀胱浅表性癌经尿道切除术后仍有10%~60%的患者在12个月内复发,最终进展为肌层浸润性癌,预后生存期缩短,分析可能与膀胱癌EMT密切相关[8-10]。EMT是参与肿瘤侵袭和迁移的关键步骤,是指上皮细胞在外界诱因下向间质细胞转化的过程,该过程中细胞失去极性及细胞间黏附能力,同时获得运动特性,使癌细胞向远端转移能力及抗凋亡能力增强,从而增加治疗失败的风险[11-12]。因此,寻找抑制膀胱癌细胞EMT过程的针对性靶点,对膀胱癌的治疗有重要意义。
Oct4主要有3个亚型,Oct4A、Oct4B及Oct4B1,研究显示,Oct4B1在调节胚胎干细胞干性方面能力较其他亚型强,进一步发现,Oct4B1在包括膀胱癌在内的多种恶性肿瘤细胞中呈高表达状态,参与肿瘤的发生、发展[13-15]。Mirzaei等[16]研究认为,Oct4B1具有抗凋亡特性,有助于癌细胞逃避凋亡机制,可能通过调控抗凋亡基因的表达发挥作用。Zhou等[17]通过检测结直肠癌细胞中Oct4B1基因表达变化与EMT的关系,发现Oct4B1基因可能通过促进癌细胞EMT过程促进细胞自我更新,进而促进肿瘤复发、转移过程。上述研究均说明,高表达的Oct4B1基因有助于促进癌细胞发生EMT,增强细胞侵袭和迁移能力。本研究采用RNAi技术成功敲低膀胱癌细胞中Oct4B1基因,应用Transwell实验和划痕实验检测发现,shRNA组穿膜细胞数少于shRNA-NC组,48 h迁移率及E-cadherin蛋白相对表达量均低于shRNA-NC组,Vimentin、N-cadherin蛋白相对表达量高于shRNA-NC组,提示沉默Oct4B1基因可抑制T24细胞侵袭和迁移能力,抑制细胞EMT过程。
此外,本研究在RNAi沉默Oct4B1基因表达的基础上,应用AKT激动剂进行干预,结果显示shRNA-NC+AKT激动剂组及shRNA+AKT激动剂组Oct4B1 mRNA相对表达量、穿膜细胞数、48 h迁移率及E-cadherin蛋白表达均较shRNA-NC组、shRNA组升高,而shRNA+AKT激动剂组低于shRNA-NC+AKT激动剂组;Vimentin、N-cadherin及p-AKT、p-GSK-3β、β-catenin蛋白表达与上述结果相反,提示AKT信号通路激活有助于促进膀胱癌细胞EMT过程,增强其侵袭和转移能力;而靶向沉默Oct4B1可抑制AKT激动剂诱导的EMT过程,降低其侵袭和转移能力,因此,沉默Oct4B1基因可能通过调控AKT/GSK-3β/β-catenin信号通路抑制癌细胞EMT过程。AKT/GSK-3β/β-catenin是诱发EMT的重要信号通路[18]。AKT磷酸化激活后,引起下游GSK-3β丝氨酸9(Ser9)磷酸化,从而失去与β-catenin结合能力,细胞内游离β-catenin增多进而转入细胞核,该信号通路被活化[19-20]。β-catenin可与E-cadherin形成复合体,以维持上皮细胞形态及细胞间黏附作用,β-catenin活化后复合体稳定性降低,导致细胞间连接松散,有利于细胞侵袭和转移[21]。
综上所述,沉默Oct4B1基因可抑制膀胱癌T24细胞EMT过程,抑制癌细胞侵袭和转移能力,沉默Oct4B1基因还能抑制AKT/GSK-3β/β-catenin信号通路诱导的EMT转化作用,为临床抑制膀胱癌的复发和转移提供了参考靶点。
