5-羟色胺和多巴胺在初孵扬子鳄小脑的定位与表达
2019-08-21任士佳陈梅芳刘再群周际海
任士佳, 陈梅芳, 刘再群, 周际海
(安徽师范大学 生命科学学院 安徽省重要生物资源与利用重点实验室 生物环境与生态安全省级重点实验室, 芜湖 241000)
5-羟色胺(5-hydroxytryptamine, 5-HT),因其最先是从人的血清素中发现的,具有紧缩血管的功能,故又称血清素(serotonin)。5-HT是一种吲哚衍生物,分子式为C10H12N2O。现已证实,5-HT作为一种“经典”的神经递质,普遍分布于脊椎动物的中枢神经系统中,参与介导各类活动诸如学习、记忆、痛觉传导、睡眠、摄食、行为等的调节。另有研究表明,5-HT在变色龙种群间的信息交流过程中也发挥作用[1]。目前,在各类爬行动物如暹罗鳄[2]、尼罗鳄[3]、日本水龟[4]、平原巨蜥[5]、毒蝰[6]的中枢神经系统已有一些关于5-HT分布的报道。有学者认为暹罗鳄小脑内5-HT含量及浓度并不高,但幼体要高于成体[2]。在尼罗鳄小脑内可见小脑深核的5-HT免疫阳性[3]。在日本水龟的小脑,5-HT能纤维可见于颗粒层,但未见于分子层,且小脑核周围也可见一些5-HT能纤维[4]。在平原巨蜥小脑核旁侧可见5-HT免疫阳性神经细胞,分子层、颗粒层以及小脑核附近也可见5-HT免疫阳性神经纤维[5]。在毒蝰小脑皮质的颗粒层有大量的5-HT能纤维[6]。
多巴胺(dopamine, DA)也是一种“经典”的神经递质,分子式为C8H11O2N。在之前的很长一段时间,人们一直以为多巴胺在中枢神经系统中仅仅是作为NE的前体物质发挥作用,直到1975年瑞典科学家Carlsson确定DA在脑内还扮演了信息传递者的角色,人们才意识到DA在神经信号传导过程中也发挥着重要作用。现已证明,DA在运动控制、联系学习、觉醒、执行能力等方面都发挥了重要的作用。人脑DA的缺乏与一些神经精神疾病,如精神分裂症、帕金森症等精神疾病的病发有着非常密切的干系[7]。目前对于DA在爬行动物如红耳龟[8]、彩龟[9]、球蟒[10]、大壁虎[11]的中枢神经系统的分布已有一些相关研究。尚未见DA在鳄类动物中枢神经系统的相关报道。
扬子鳄(Alligatorsinensis)属爬行纲鳄目短吻鳄科短吻鳄属,是中国特有的一种珍稀淡水鳄,为国家一级保护动物,野生种群数量较少,主要分布于长江流域。它们体型较大、结构较进步,被誉为爬行动物中的“活化石”。现在,对扬子鳄的研究主要集中在扬子鳄的消化系统、呼吸系统和运动系统的组织学研究以及扬子鳄胚胎学、生态学、人工饲养和繁殖、保护和利用等方面[12],但关于扬子鳄中枢神经系统的研究并不是很多。对于扬子鳄小脑的报道,仅见于刘再群等[13]对初孵扬子鳄小脑皮质生长抑素的免疫组化研究。
本文运用Nissl染色方法研究了初孵扬子鳄小脑的组织学结构,运用免疫组织化学方法研究了5-HT和DA在初孵扬子鳄小脑的表达和定位情况,以期为日后更深层的研究提供一些理论基础。
1 材料与方法
1.1 材料
初孵扬子鳄3只,长约15 cm,取自安徽省宣城市扬子鳄繁殖研究中心。乙醚麻醉后迅速从颅腔剥取整脑组织,脑重约0.24~0.36 g。上述行为均得到了中国林业部门和安徽师范大学动物伦理委员会的批准。用Bouin′s液固定48 h后,常规脱水、透明,石蜡包埋,莱卡切片机连续切片(厚约7 μm),于45 ℃清水展片并固定于含粘片剂的洁净载玻片上,然后于37 ℃烘箱内烘干。
1.2 Nissl染色方法
干燥后的切片每隔5张间距选取一张,将切片放入二甲苯中脱蜡后,100% (I)、100% (II)、95% (I)、95% (II)、80%和70%梯度酒精和蒸馏水复水,再将切片置于甲苯胺蓝染液中染色10 min,随后置于0.25%冰乙酸分色3 s,蒸馏水清洗多余液体,放入烘箱中烘干后于二甲苯中透明,最后用中性树胶进行封片。
1.3 免疫组织化学染色方法
SABC法:切片入二甲苯(I)和二甲苯(II)脱蜡,再分别入100% (I)、100% (II)、95% (I)、95% (II)、80%和70%酒精以及蒸馏水复水,30% H2O2和蒸馏水1∶ 9混合后滴加于组织上,室温下放置5~10 min以灭活内源性酶,然后用蒸馏水冲洗3次;将切片浸入枸橼酸盐缓冲液(pH 6.0)热修复抗原;冷却至室温后再用PBS(pH 7.2~7.6)洗2 min×3次;滴加5% BSA封闭液,室温下封闭20 min,甩去多余的液体(勿洗);滴加一抗(5-HT, DA;1∶ 100稀释),4 ℃冰箱中过夜。次日,PBS连续冲洗3次,每次2 min;滴加生物素化二抗,37 ℃恒温箱中放置30 min后取出,PBS连续洗2 min×3次;再滴加SABC,37 ℃恒温箱中放置30 min,PBS洗5 min×4次。DAB(取1 mL蒸馏水,往其中各加一滴A、B、C混匀)显色,室温下放置5~30 min,显微镜下控制反应时间,蒸馏水冲洗;苏木素轻度复染,切片入梯度酒精脱水,再入二甲苯透明,最后用水溶性封片剂封片。抗兔5-HT多克隆抗体(BA-0121-1)、抗兔DA多克隆抗体(BA-1454)、链霉素亲和素-生物素-过氧化物酶复合物(Streptavidin-Biotin-Peroxidase Complex,SABC)免疫组织化学试剂盒(SA 1029),均购自武汉博士德生物工程有限公司。
1.4 观察
在Olympus BX61型显微镜和Motic BA600-4型全自动扫描显微镜下观察、拍照。
2 结果
2.1 初孵扬子鳄小脑
初孵扬子鳄中枢神经系统长约4.5 cm,从前往后逐次可分成端脑、间脑、中脑、小脑、延髓和脊髓,通常将中脑和延髓合称为脑干(图 1)。初孵扬子鳄小脑位于中脑之后,延脑的背前侧(图 1-A、C),呈椭圆形,且横径大于纵径,其与脑干共同围成第四脑室(the fourth ventricle, V4)。

A和a: 背面观; B和b: 腹面观; C和c: 侧面观。 1: 嗅球; 2: 大脑; 3: 中脑; 4: 小脑; 5: 延髓; 6: 脊髓; 7: 漏斗
图1初孵扬子鳄中枢神经系统
Figure 1 The central nervous system of the new-hatching Yangtze alligator
横切面上,可见小脑尾端嵌入脑干上端,围成第四脑室背部(图 2-A)。往头端,小脑在第四脑室背部逐渐变宽(图 2-B),两侧与下面的脑干融合(图 2-C)。再往头端,小脑继续变宽,且小脑中部嵌入第四脑室(图 2-D);背部的小脑与腹部的脑干围成的第四脑室逐渐变大,第四脑室的正中沟和外侧沟明显可见(图 2-E、F),再继续往头端,小脑与脑干分离,第四脑室逐渐变小且仅被脑干封闭(图 2-G、H、I)。纵切面上,可见小脑室(图 2-J),小脑与脑干形成V4并通过脉络丛来封闭V4,封闭不完全(图 2-J)。
小脑皮质表面并不光滑,有皱褶,可见沟回分化(图 3-A)。在小脑髓质内,埋藏了两个小脑核团,分别是外侧小脑核(the nucleus cerebelli lateralis, NCL)(图 3-B)和内侧小脑核(the nucleus cerebelli medialis, NCM)(图 3-C)。外侧小脑核细胞分布稀疏且胞体较小;内侧小脑核细胞分布较密集且胞体较大。还观察到在小脑皮质外有与其相联系的血管丛(vascular plexus, VP)(图3-D)。此外,髓质内还可见大量的血管(图 3-E)。

A: 横切面上小脑尾端嵌入脑干上端,围成第四脑室(V4)背部; B: 横切面上小脑在第四脑室背部逐渐变宽; C: 横切面上小脑两侧与下面的脑干融合; D: 横切面上小脑继续变宽且小脑中部嵌入第四脑室; E、F: 背部的小脑与腹部的脑干围成的第四脑室逐渐变大; G-I: 小脑与脑干分离,第四脑室逐渐变小且仅被脑干封闭; J: 纵切面上小脑与脑干形成V4并通过脉络丛(CP)来封闭V4(插图示脉络丛)。标尺: 500 μm; 插图标尺: 100 μm。VC: 小脑室
图2初孵扬子鳄小脑(CBe)同脑干(BS)的相对位置
Figure 2 The relative position between the cerebellum (CBe) and brainstem (BS) of the new-hatching Yangtze alligator
2.2 5-HT在初孵扬子鳄小脑的分布
冠状切面上,小脑皮质可明显分为4层,从外向内为外颗粒层(external granular layer, EGL)、分子层(molecular layer, ML)、浦肯野细胞层(Purkinje cell layer, PCL)和颗粒层(granular layer, GL)(图 4-A、B、C)。其中浦肯野细胞可见明显多细胞层(图 4-C)。髓质可见小脑核(图 4-D)。矢状切面上,可见第四脑室由顶部的小脑和下部的脑干围成,第四脑室后部由脉络丛(choroid plexus, CP)不紧密封闭(图 5-A),构成第四脑室顶部的小脑皮质部位可见明显的外颗粒层(图 5-B),小脑髓质内部可见小脑室(ventriculus cerebelli, VC)(图 5-D)。

矢状切面上A: 小脑皮质表面并不光滑(标尺: 200 μm); B: 外侧小脑核(标尺: 20 μm); C: 内侧小脑核(标尺: 20 μm); D: 小脑皮质外血管丛(VP,标尺: 50 μm); E: 小脑髓质内的血管(箭头示,标尺:50 μm)。GL: 颗粒层; ML: 分子层; PCL: 浦肯野细胞层
图3初孵扬子鳄小脑结构
Figure 3 The cerebellar structure of the new-hatching Yangtze alligator
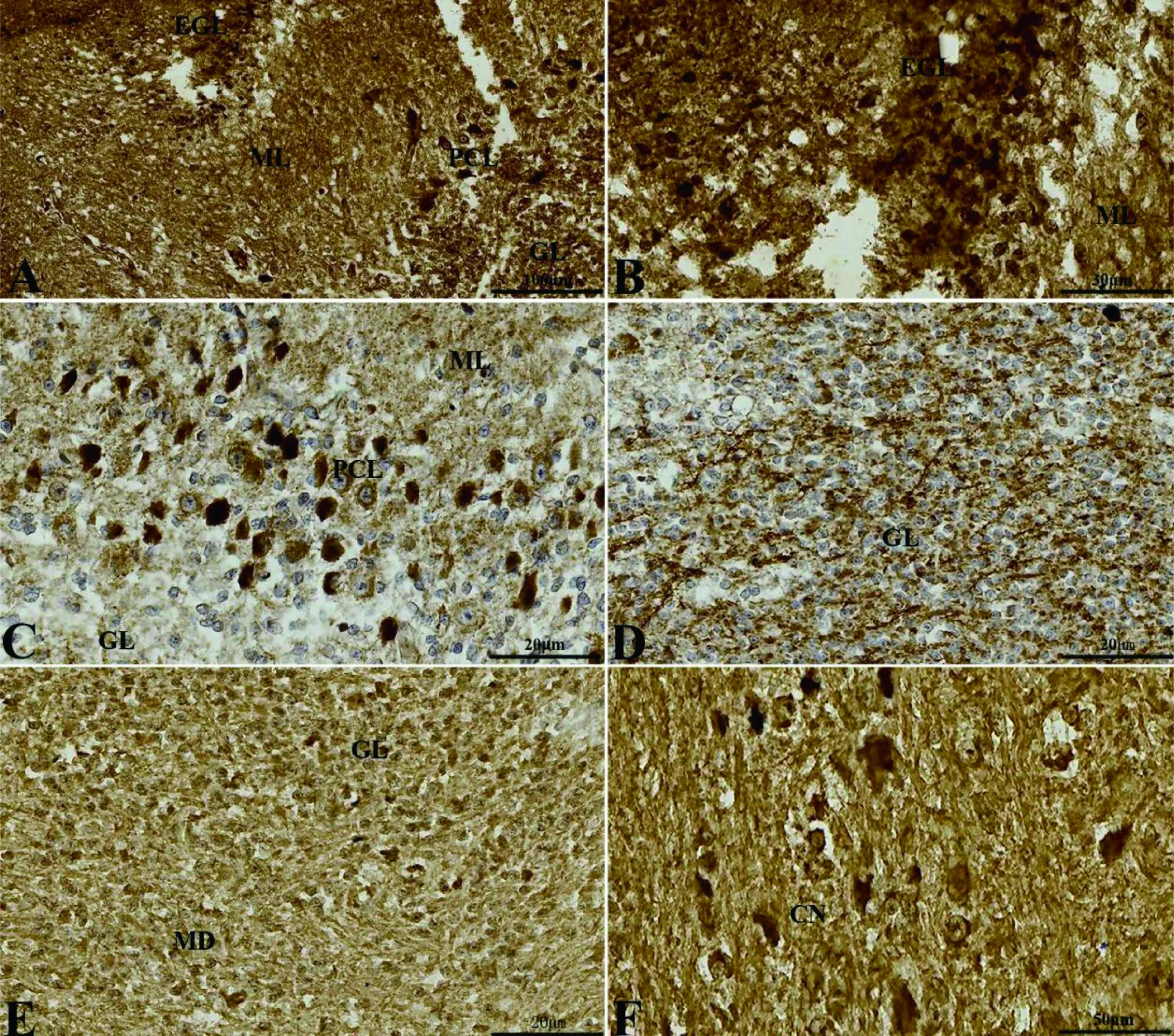
A: 小脑皮质分层(标尺: 100 μm); B: 外颗粒层 (EGL,标尺: 30 μm); C: 浦肯野细胞(PCL,标尺: 20 μm); D: 颗粒层(GL,标尺: 20 μm); E: 颗粒层与髓质(MD)的边界(标尺: 20 μm); F: 髓质核团(CN,标尺: 50 μm)。ML: 分子层
图4冠状切面上5-HT在初孵扬子鳄小脑的分布
Figure 4 The distribution of the 5-HT in the cerebellum of the new-hatching Yangtze alligator in transversesections

A: 初孵扬子鳄小脑纵切(标尺: 300 μm); B: 外颗粒层(EGL,标尺: 20 μm); C: 浦肯野细胞(PCL,标尺: 20 μm); E: 小脑室(VC,标尺: 30 μm); E: 脉络丛(CP,标尺: 80 μm)。ML: 分子层; GL: 颗粒层
图5矢状切面上5-HT在初孵扬子鳄小脑(CBe)的分布
Figure 5 The distribution of the 5-HT in the cerebellum (CBe) of the new-hatching Yangtze alligator in sagittal sections
冠状切面上,外颗粒层细胞的细胞质为5-HT阳性(图 4-B);浦肯野细胞显示细胞质5-HT阳性,细胞核5-HT阴性(图 4-C);分子层和颗粒层均显示5-HT神经纤维阳性且阳性较强(图 4-B、C、D)。髓质内侧核团细胞体5-HT阳性(图 4-F)。矢状切面上,可见外颗粒层细胞5-HT阳性明显(图 5-B);分子层和颗粒层神经纤维5-HT阳性(图 5-C);小脑室的室管膜细胞呈5-HT阴性(图 5-D);脉络丛细胞呈5-HT浅阳性(图 5-E)。
2.3 DA在初孵扬子鳄小脑的分布
冠状切面上,小脑皮质可明显分为4层,从外向内为外颗粒层(external granular layer, EGL)、分子层(molecular layer, ML)、浦肯野细胞层(Purkinje cell layer, PCL)和颗粒层(granular layer, GL),见图 6-A、B、C。其中浦肯野细胞可见明显多细胞层(图 6-C)。小脑髓质和皮质较易区分(图 6-E),髓质可见小脑核(图 6-F)。矢状切面上,可见第四脑室由顶部的小脑和下部的脑干围成,第四脑室后部由脉络丛(choroid plexus, CP)不紧密封闭(图 7-A),构成第四脑室顶部的小脑皮质部位可见明显的外颗粒层(图 7-B),小脑髓质内部可见小脑室(ventriculus cerebelli, VC),见图 7-D。

A: 小脑皮质分层(标尺: 100 μm); B: 外颗粒层(EGL,标尺: 30 μm); C: 浦肯野细胞层(PCL,标尺: 20 μm); D: 小脑皮质与髓质(MD)的边界(标尺: 50 μm); E: 髓质核团(CN,标尺: 30 μm); J: 第四脑室(V4)脑脊液物质(标尺: 20 μm)。ML: 分子层; GL: 颗粒层
图6冠状切面上DA在初孵扬子鳄小脑的分布
Figure 6 The distribution of the DA in the cerebellum of the new-hatching Yangtze alligator in transversesections

A: 初孵扬子鳄小脑纵切(标尺: 300 μm); B: 外颗粒层(EGL,标尺: 20 μm); C: 浦肯野细胞(PCL,标尺: 20 μm); D: 小脑室(VC,标尺: 30 μm); E: 脉络丛(CP,标尺: 80 μm)。ML: 分子层; GL: 颗粒层
图7矢状切面上DA在初孵扬子鳄小脑(CBe)的分布
Figure 7 The distribution of the DA in the cerebellum (CBe) of the new-hatching Yangtze alligator in sagittal sections
冠状切面上,外颗粒层细胞有微弱的阳性(图 6-B);浦肯野细胞显示细胞质DA阳性,细胞核DA阴性(图 6-C);分子层和颗粒层均显示DA神经纤维阳性(图 6-B、C、D)。髓质内有较多DA免疫阳性纤维分布密集(图 6-D),髓质内侧核团细胞质DA阳性,细胞核阴性(图 6-E)。第四脑脑室脑脊液物质也显示DA免疫阳性(图 6-F)。矢状切面上,可见外颗粒层纤维DA阳性明显(图 7-B);分子层和颗粒层神经纤维DA阳性(图 7-C);小脑室的室管膜细胞呈DA阴性(图 7-D);脉络丛细胞呈DA强阳性(图 7-E)。
3 讨论
由于爬行动物运动的复杂性,其小脑较两栖动物更为发达,水生爬行动物的小脑就更加发达了;鳄的小脑已有分化成中央蚓部和两侧小脑鬈的趋向[14]。小脑在保持身体平衡、调节肌张力和协调肌群运动等方面都有着重要意义。刘再群等[13]曾对初孵扬子鳄小脑的生长抑素的分布进行了研究,而本文首次系统阐述了初孵扬子鳄小脑的组织学结构特征以及5-羟色胺和多巴胺在初孵扬子鳄小脑的分布情况。
3.1 小脑皮质分层
在爬行纲动物中,Larsell[15]曾研究了鳄目部分动物的小脑,他认为鳄类的小脑皮质可划分成典型的3层,即分子层、浦肯野细胞层和颗粒层。报道表明其他一些爬行动物如红耳龟[16]、中国石龙子[17]、尼罗鳄[18]的小脑皮质同样可分为3层。成年扬子鳄的小脑皮质同样可分3层,并不存在外颗粒层[12]。但是,本研究结果显示初孵扬子鳄小脑皮质可分为4层,从外向内依次是外颗粒层、分子层、浦肯野细胞层和颗粒层。对小鼠小脑皮质的发生的研究表明,在小脑的组织生成过程中,来自原始神经上皮的一些神经前体细胞(也称成神经细胞)会迁移到小脑的表面形成外颗粒层,在这层内侧的那些已经停止增殖的成神经细胞则发展成小脑皮质颗粒细胞的前身,它们随后迁移回到正在发生的白质中发展成内颗粒层[19]。我们推测,初孵时期的扬子鳄的小脑皮质确可分为4层,但伴随着小脑发育成熟,小脑皮质的外颗粒层会逐渐消退。本实验观测到的正是初孵扬子鳄小脑外颗粒层残余,它们会随着小脑的发育成熟而逐渐退化直至消失。
3.2 浦肯野细胞层
浦肯野细胞的胞体呈梨形,所以也可称之为梨状神经细胞。浦肯野细胞层便是由排列整齐的浦肯野细胞的胞体构成。对老鼠小脑内浦肯野细胞的研究表明,浦肯野细胞可通过控制特定运动的区域的时相来协调多关节运动,且与四肢、躯干的协调有关[20]。长久以来,人们一直认为在爬行动物的小脑皮质中浦肯野细胞层是由单层胞体组成的[15, 17-18]。然而,我们在此注意到初孵扬子鳄小脑皮质的浦肯野细胞层其实是由多层浦肯野细胞胞体排列组成的。宋海燕等[21]曾在未发育成熟的皖西白鹅的小脑皮质观察到部分浦肯野的多层排列且伴随着小脑皮质的发育成熟多层浦肯野细胞最终逐渐退化成单层。有学者认为只有那些能够与其他神经细胞建立正常突触联系的浦肯野细胞才能够存活下来,而不能成功建立突触联系的细胞则会凋亡[22]。所以我们推测,在初孵扬子鳄小脑内,可能存在某种化学物质,它调控着浦肯野细胞的发育及突触联系的建立并最终使其成为均一的单细胞层,而那些没能够与其他神经细胞构建突触联系的浦肯野细胞便会出现凋亡,不能存活下来。
3.3 小脑室
陈壁辉等[12]认为成年扬子鳄小脑无空腔脑室,但是,本研究中,我们发现初孵扬子鳄小脑可见脑室,且小脑室与第四脑室相通。我们推测,扬子鳄的小脑室可能随着小脑的发育增大而逐渐与第四脑室融合,不易区分。
3.4 5-羟色胺在小脑的分布
目前,关于5-HT免疫阳性神经细胞及纤维在爬行动物小脑的分布,仅有少量报道。有研究表明,幼年暹罗鳄(1个月)小脑内5-HT含量及浓度比成年鳄5-HT含量及浓度要高;此外,暹罗鳄小脑内的5-HT含量及浓度虽不高,但总体上要高于北美游蛇,可是其中枢神经系统其他区域5-HT含量及浓度低于其他爬行动物[2]。本研究中,我们观察到初孵扬子鳄小脑的5-HT免疫阳性较强。鉴于小脑是运动也是平衡中枢,而5-HT涉及行为等各种活动的调控,这提示初孵扬子鳄小脑内5-HT可能参与扬子鳄运动的调节。在平原巨蜥[5]的小脑内,其小脑核侧边可观察到5-HT免疫阳性神经细胞,且横切面上小脑皮质可见分子层的免疫阳性纤维,小脑核周边同样可见免疫阳性纤维。我们注意到,在初孵扬子鳄小脑髓质的小脑核附近可见5-HT免疫阳性神经细胞及纤维。Challet等[6]发现蝰蛇小脑皮质的颗粒层内存在大量的5-HT能纤维。本研究中同样观察到初孵扬子鳄小脑的颗粒层内可见5-HT免疫阳性纤维。这些均提示在爬行纲的不同动物之间,5-HT在小脑的分布有一定的类似之处。有学者发现尽管锦龟小脑皮质浦肯野细胞层表现出对外源5-HT较强的反应且小脑皮质中可见5-HT能免疫阳性纤维,但是,其小脑内5-HT总体含量并不高[23]。我们发现,初孵扬子鳄小脑的5-HT免疫阳性较强,且不止见于浦肯野层。对彩龟脑干和脊髓5-HT分布的研究表明,小脑核会受到5-HT能神经纤维支配,且小脑皮质颗粒层可见些许背腹侧行5-HT免疫阳性神经纤维,但是小脑皮质分子层未见5-HT免疫阳性纤维[24]。在初孵扬子鳄的小脑内,观察到小脑皮质分子层和颗粒层均可见5-HT免疫阳性纤维,这表明在不同爬行动物的小脑,5-HT的分布也是存在一定差异的。
3.5 多巴胺在小脑的分布
目前未见DA在爬行动物小脑分布的相关报道。但是,在其他脊椎动物中已有一些小脑的DA免疫阳性神经细胞及纤维的分布的报道。欧洲鳗鱼的小脑内仅包含稀疏的DA免疫阳性神经分布,小脑几乎不接受DA能神经纤维的支配,DA能纤维稀疏的分布于小脑体侧边隆起的颗粒层内的颗粒细胞,在小脑联合处也可见一些DA能纤维,这些纤维会形成一纤维束到达第四脑室上方的浦肯野细胞[25]。但是在本研究中,我们观察到浦肯野细胞及髓质内侧核团细胞均呈DA免疫阳性,分子层和颗粒层可见大量DA神经纤维阳性且髓质内也有较多DA免疫阳性纤维分布细胞质DA阳性,第四脑脑室脑脊液物质也显示DA免疫阳性。考虑到小脑有维持平衡、协调运动的作用,扬子鳄是一种冬眠动物,推测DA在扬子鳄打洞等活动中发挥着重要的作用。对湖蛙和蝾螈小脑的DA的免疫组化分布的研究表明湖蛙和蝾螈小脑的腹侧颗粒层区域可见少量的DA免疫阳性纤维[26]。本研究中,我们不仅在初孵扬子鳄的小脑皮质的颗粒层观察到DA免疫阳性纤维,还在小脑其他各部分均观察到DA免疫阳性。DA在运动控制、执行能力等方面都发挥了重要的作用,推测扬子鳄小脑DA的广泛分布可能与其运动的复杂性有着密切的关系。在鸟纲动物中,灰斑鸠的小脑脚腹侧可见DA免疫阳性纤维[27]。本研究中我们同样观察到在初孵扬子鳄的小脑内有丰富的DA免疫阳性分布。这提示DA在不同动物小脑的分布有一定的连续性。在哺乳纲动物中,对大鼠小脑内DA能神经分布的研究结果显示整个大鼠小脑均可见DA能神经纤维分布,其中在小脑皮质的分子层分布最多,但是,未见免疫阳性神经细胞;免疫阳性神经纤维较细[28]。在此,我们在初孵扬子鳄的整个小脑均观察到DA免疫阳性纤维且在颗粒层和髓质区域分布较为密集,同时,还观察到浦肯野细胞也会表达DA免疫阳性。此外,还观察到第四脑室脑脊液物质和脉络丛细胞也呈DA免疫阳性,推测DA在扬子鳄幼体能产生一定的生理功能。
