mTOR-自噬通路对脓毒症小鼠海马小胶质细胞表型的影响
2019-08-16庄欣琪蒋毅杨曼王瑶琪卢悦淳吕国义谢克亮于泳浩
庄欣琪,蒋毅,杨曼,王瑶琪,卢悦淳,吕国义,谢克亮,于泳浩△
脓毒症是一种全身炎症反应综合征,主要由感染因素诱发,以炎症系统的过度激活为主要病理特征,是机体和病原体相互作用引起的抗炎和促炎反应失衡的结果[1-2]。脓毒症患者常出现中枢神经系统并发症,主要表现为认知功能异常,包括注意力、学习和记忆能力降低等[3-4]。脓毒症脑功能障碍的发病机制复杂且尚不明确,研究表明,脓毒症可引起海马小胶质细胞活化,在脓毒症脑功能障碍的病理生理过程中起重要作用[5]。小胶质细胞活化后存在两种表型:M1表型主要分泌多种促炎因子,介导炎性反应的发生发展;M2表型主要分泌抗炎因子,抑制炎症反应的过度发生,促进组织修复[6-7]。有研究发现,哺乳动物雷帕霉素靶蛋白(mTOR)-自噬通路可调节小胶质细胞表型转化,是中枢炎性反应的潜在治疗靶点[8]。本研究拟探讨mTOR-自噬通路对脓毒症小鼠海马小胶质细胞表型的影响,为研究脓毒症脑病的机制和治疗提供新的思路。
1 资料与方法
1.1 一般资料
1.1.1 主要试剂与仪器 主要试剂:mTOR抑制剂雷帕霉素(Ra)购自美国Sigma公司;抗CD86、抗CD206、抗离子钙接头蛋白分子(Iba)-1、抗p-mTOR、抗Beclin-1、抗微管相关蛋白1轻链3Ⅱ(LC3Ⅱ)一抗购自英国Abcam公司;抗β-actin一抗购自美国Sigma公司;山羊抗兔二抗购自北京中杉金桥生物技术有限公司;荧光标记驴抗兔和驴抗大鼠二抗购自美国Jackson公司;肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-10及转化生长因子(TGF)-β酶联免疫吸附试验(ELISA)试剂盒购于美国R&D公司。BX53F荧光显微镜购自日本Olympus公司;EnSpire酶标仪购自美国PerkinElmer公司;PowerPac 200电泳仪和Mini-PROTEAN Tetra电泳槽购自美国Bio-Rad公司。
1.1.2 实验动物与分组 成年雄性ICR小鼠54只,6~8周龄,体质量20~30 g,购自军事医学科学院卫生学环境医学研究所实验动物中心,许可证号SCXK-(军)2014-0001。将动物常规喂养1周后,按照随机数字法分为3组:假手术组(Sham组)、脓毒症组(CLP组)和脓毒症+mTOR抑制剂雷帕霉素组(CLP+Ra组),每组18只。
1.2 方法
1.2.1 脓毒症模型的制备 参照文献[9-10]采用盲肠结扎穿孔法(CLP法)建立小鼠脓毒症模型。腹腔注射2%水合氯醛(15 mL/kg)麻醉,腹部备皮消毒后,沿腹中线切开皮肤、腹壁约1 cm,以无菌无齿镊探查至盲肠,于回盲瓣下方盲肠近段1/4处用手术缝线结扎盲肠,用20 G无菌针头分别于结扎盲肠头尾端穿孔,并挤出肠内容物约0.3 mL,将盲肠和挤出内容物一起还纳腹腔,取无菌手术线逐层缝合切口。Sham组仅进行开腹及盲肠游离,不进行盲肠结扎及穿孔。术后颈部皮下注射生理盐水0.05 mL/g复苏。CLP+Ra组参照文献[11]于造模前6 h腹腔注射雷帕霉素1.5 mg/kg,Sham组和CLP组腹腔注射等量生理盐水。
1.2.2 免疫荧光染色法检测海马组织切片Iba-1/CD86和Iba-1/CD206阳性细胞表达数量 于CLP后24 h,各组取6只小鼠,深麻醉下处死,左心室灌注等渗生理盐水,至右心耳流出清亮液体,断头取脑,4%多聚甲醛固定,20%及30%蔗糖溶液梯度脱水,用切片机行冠状面冰冻切片,切片厚度10µm。随后经PBS冲洗,微波抗原修复,血清封闭,滴加Iba-1一抗(稀释度为1∶500),4℃孵育过夜。复温后经PBS冲洗,滴加荧光(R-PE)标记的驴抗兔二抗(稀释度为1∶1 000)避光孵育1 h,PBS冲洗,滴加CD86或CD206一抗(稀释度均为1∶500),4℃孵育过夜。复温后经PBS冲洗,滴加荧光(FITC)标记的驴抗大鼠二抗(稀释度均为1∶1 000)避光孵育1 h,后用含DAPI的防荧光淬灭剂封片,100倍荧光显微镜下以海马齿状回作为观察区域,Iba-1/CD86双阳性为M1型小胶质细胞,Iba-1/CD206双阳性为M2型小胶质细胞,计数M1和M2型小胶质细胞数量。
1.2.3 ELISA法检测海马TNF-α、IL-1β、IL-10和TGF-β水平 于CLP后24 h,各组取6只小鼠,处死及心室灌注方法同前,断头取脑,剥离海马组织,加入预冷的组织蛋白裂解液匀浆,4℃下15 000 r/min离心10 min后取上清,按照ELISA试剂盒说明书使用酶标分析仪测定海马组织TNF-α、IL-1β、IL-10和TGF-β含量。
1.2.4 蛋白免疫印迹技术(Western blot)检测海马p-mTOR、LC3Ⅱ和Beclin-1表达 于CLP后24 h,各组取6只小鼠,剥离海马取匀浆上清方法同前,采用BCA法进行蛋白定量分析,每孔取20µg蛋白上样,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),采用湿式电转移法将目的蛋白转至PVDF膜上,5%脱脂奶粉室温封闭2 h,洗膜后加入pmTOR、LC3Ⅱ、Beclin-1一抗和β-actin内参(稀释度均为1∶1 000),4℃摇床孵育过夜。次日洗膜后加入碱性磷酸酶标记的山羊抗兔二抗(稀释度均为1∶5 000),室温孵育1 h,洗膜后于暗室内加入显影剂并曝光扫描。采用Image J软件分析条带灰度值,以目的蛋白条带与内参β-actin条带灰度值的比值反映目的蛋白的表达水平,以LC3Ⅱ与LC3Ⅰ条带灰度值的比值反映LC3Ⅱ的表达水平。
1.3 统计学方法 应用SPSS 18.0统计学软件进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 免疫荧光染色检测结果 与Sham组比较,CLP组海马组织Iba-1、Iba-1/CD86和Iba-1/CD206阳性细胞数量增加(均P<0.05)。与CLP组比较,CLP+Ra组海马组织Iba-1/CD86阳性细胞数量减少,Iba-1/CD206阳性细胞数量增加(均P<0.05),见图1、表1。
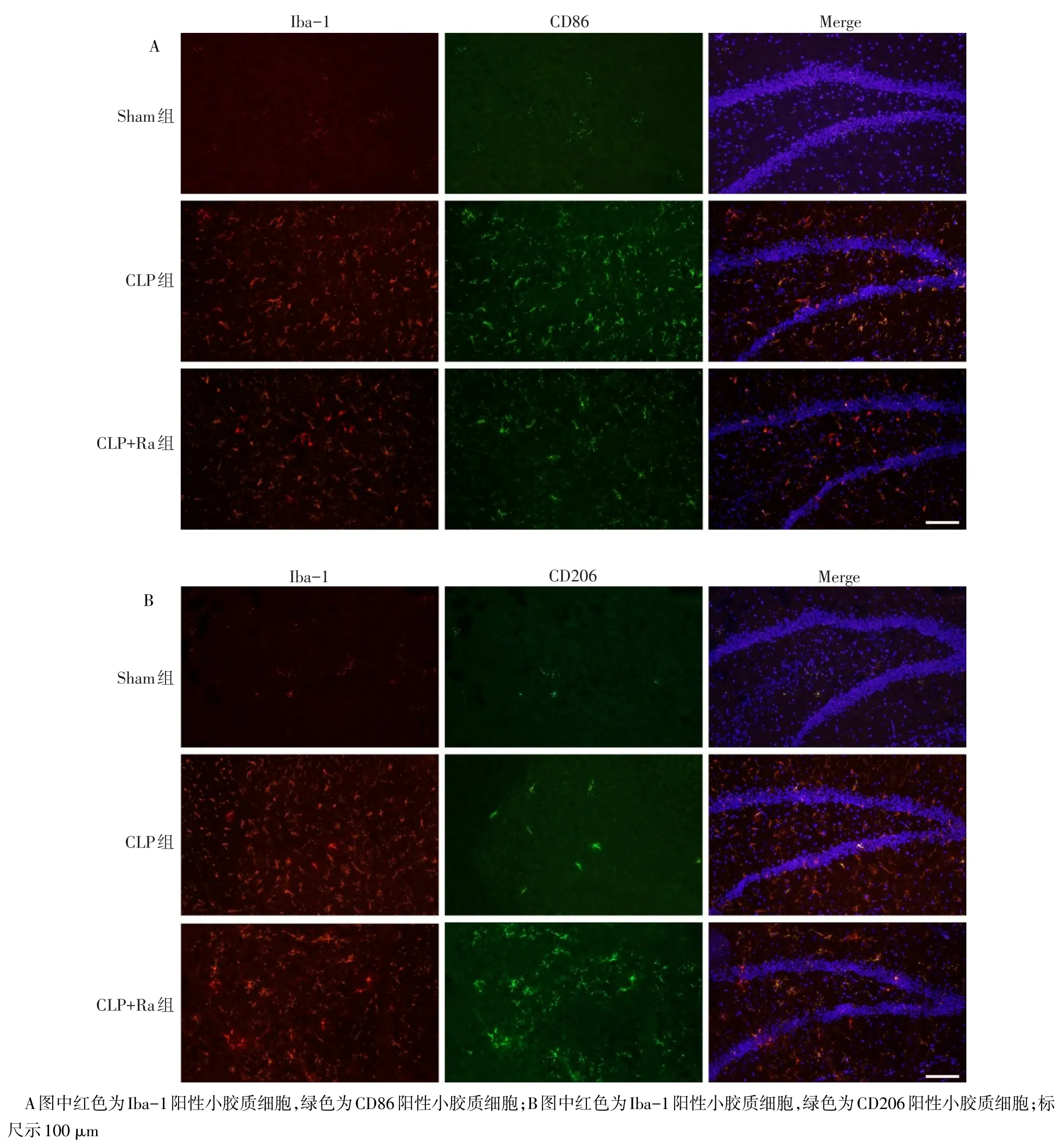
Fig.1 Double immunostaining of Iba-1/CD86 and Iba-1/CD206 of microglia from hippocampus in three groups(×100)图1 3组海马组织小胶质细胞Iba-1/CD86与Iba-1/CD206免疫荧光双染色结果(×100)
2.2 海马组织炎症因子检测结果与Sham组比较,CLP组海马组织TNF-α、IL-1β、IL-10和TGF-β水平均升高(均P<0.05);与CLP组比较,CLP+Ra组TNF-α和IL-1β水平减低,IL-10和TGF-β水平升高(均P<0.05),见表2。
Tab.1 Comparison of Iba-1/CD86 and Iba-1/CD206 labeled microglia from hippocampus between three groups表1 3组海马组织Iba-1/CD86和Iba-1/CD206标记阳性小胶质细胞计数比较 (n=6,个/视野,±s)

Tab.1 Comparison of Iba-1/CD86 and Iba-1/CD206 labeled microglia from hippocampus between three groups表1 3组海马组织Iba-1/CD86和Iba-1/CD206标记阳性小胶质细胞计数比较 (n=6,个/视野,±s)
**P<0.01;a与Sham组比较,b与CLP组比较,P<0.05
组别Sham组CLP组CLP+Ra组F Iba-1/CD86双染Iba-1+14.5±3.8 82.5±9.4a 73.5±3.6a 212.992**Iba-1+/CD86+10.8±3.2 72.7±7.3a 36.8±3.7ab 227.692**Iba-1/CD206双染Iba-1+15.7±2.2 81.5±7.9a 77.5±9.0a 166.955**Iba-1+/CD206+5.2±1.2 9.8±1.5a 33.0±4.9ab 143.180**
Tab.2 Comparison of TNF-α,IL-1β,IL-10 and TGF-β levels in hippocampus between three groups表2 3组小鼠海马组织TNF-α、IL-1β、IL-10和TGF-β水平的比较 (n=6,ng/g,±s)

Tab.2 Comparison of TNF-α,IL-1β,IL-10 and TGF-β levels in hippocampus between three groups表2 3组小鼠海马组织TNF-α、IL-1β、IL-10和TGF-β水平的比较 (n=6,ng/g,±s)
**P<0.01;a与Sham组比较,b与CLP组比较,P<0.05
组别Sham组CLP组CLP+Ra组F TNF-α 83.8±10.2 311.5±39.5a 173.3±22.8ab 108.487**IL-1β 32.3±2.4 72.6±4.2a 52.2±6.1ab 121.454**IL-10 48.5±7.5 86.7±11.8a 147.2±17.2ab 90.280**TGF-β 26.2±5.0 49.0±7.1a 76.3±11.9ab 51.986**
2.3 Western blot检测结果 与Sham组比较,CLP组海马组织p-mTOR上调,LC3Ⅱ和Beclin-1表达下调(均P<0.05)。与CLP组比较,CLP+Ra组海马组织p-mTOR下调,LC3Ⅱ和Beclin-1表达上调(均P<0.05),见图2、表3。
3 讨论
3.1 脓毒症导致小胶质细胞活化 CLP法是诱发脓毒症动物模型的金标准和经典方法,穿孔处挤出的粪便可引起腹腔感染,被结扎盲肠缺血坏死可释放炎症因子,引起全身炎症反应[9]。研究发现,脓毒症脑病小鼠海马组织可发生小胶质细胞活化,Iba-1为其标志物[12],分泌TNF-α、IL-1β和IL-6等炎性因子[5]。本研究参照课题组前期研究成果制备小鼠CLP模型[10],与Sham组比较,CLP组Iba-1阳性细胞数量增加,TNF-α和IL-1β水平升高,提示模型制备成功。
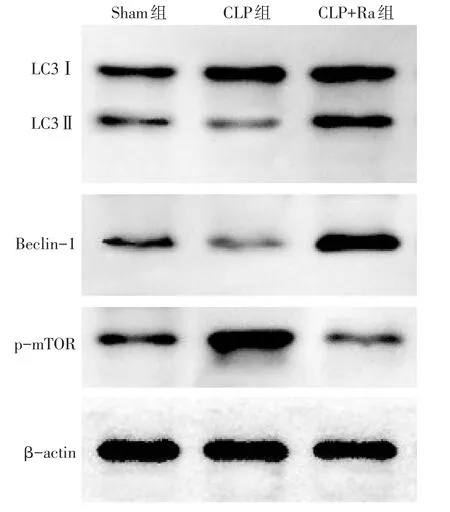
Fig.2 The expressions of p-mTOR,LC3Ⅱ and Beclin-1 detected by Western blot assay in three groups图2 Western blot法检测3组p-mTOR、LC3Ⅱ和Beclin-1表达情况
Tab.3 Comparison of expressions of p-mTOR,LC3Ⅱand Beclin-1 between three groups表3 3组小鼠海马组织p-mTOR,LC3Ⅱ和Beclin-1表达的比较 (n=6,±s)

Tab.3 Comparison of expressions of p-mTOR,LC3Ⅱand Beclin-1 between three groups表3 3组小鼠海马组织p-mTOR,LC3Ⅱ和Beclin-1表达的比较 (n=6,±s)
**P<0.01;a与Sham组比较,b与CLP组比较,P<0.05
组别Sham组CLP组CLP+Ra组F LC3Ⅱ/LC3Ⅰ0.34±0.04 0.21±0.03a 0.66±0.06ab 169.801**Beclin-1 0.45±0.06 0.30±0.04a 0.86±0.07ab 141.637**p-mTOR 0.46±0.21 1.11±0.10a 0.41±0.06ab 49.633**
3.2 小胶质细胞表型与自噬标志物的选择 小胶质细胞约占胶质细胞数量的10%,属单核巨噬细胞系,与外周单核细胞功能类似,是常驻中枢神经系统内的免疫细胞,通过持续性监测危险信号来参与正常脑实质的免疫监控[13]。一般情况下,中枢神经系统内的小胶质细胞处于静止状态;而在病理状态下,小胶质细胞发生活化,并通过释放一系列细胞因子,参与神经炎症的发病机制[14]。神经系统内活化的小胶质细胞可以分为M1和M2两种表型。M1型小胶质细胞占活化的小胶质细胞的绝大多数,CD86为其标志物,产生TNF-α、IL-1β、IL-6等致炎因子,是介导炎症反应发生的主要来源;M2型小胶质细胞以CD206为其标志物,分泌IL-10和TGF-β等抗炎因子,抑制炎症反应并发挥组织修复作用[6-7]。自噬在维持细胞内环境稳态和应对细胞内外应激等方面发挥重要作用。Beclin-1是哺乳动物中具有自噬调节作用的基因,是重要的自噬起始因子。LC3靶向定位于自噬体膜,参与自噬的形成,当自噬发生时,LC3Ⅰ经泛素样加工修饰与磷脂酰乙醇胺结合,形成LC3Ⅱ,LC3Ⅱ蛋白结合并始终位于自噬小体膜上,是自噬小体的标志分子[15]。mTOR在调节细胞生长代谢方面发挥重要作用,也是自噬水平的重要调节者[16]。故笔者选择mTOR、LC3Ⅱ和Beclin-1作为研究观察蛋白。
3.3 mTOR-自噬通路调节小胶质细胞表型 本研究结果显示,与Sham组相比,CLP组术后24 h小鼠海马切片Iba-1/CD86和Iba-1/CD206阳性细胞数量增加,Iba-1/CD86阳性细胞数量大于Iba-1/CD206阳性细胞数量,TNF-α、IL-1β、IL-10和TGF-β水平提高,p-mTOR水平上调,LC3Ⅱ和Beclin-1水平下调,提示脓毒症小鼠海马组织mTOR通路激活,自噬水平受到抑制,活化的小胶质细胞以M1表型为主,分泌促炎因子占优势,加重炎症反应。此前已有研究证实,中枢损伤后发生小胶质细胞活化,以M1表型占主导,提示活化的小胶质细胞是脓毒症中枢炎性反应的重要参与者[12]。相比于CLP组,CLP+Ra组Iba-1/CD86阳性细胞数量减少、Iba-1/CD206阳性细胞数量增加,海马组织TNF-α和IL-1β水平下降,IL-10和TGF-β水平提高,p-mTOR水平下调,LC3Ⅱ和Beclin-1水平上调,提示Ra通过抑制mTOR通路,激活自噬,小胶质细胞M1表型减少,M2型增加,减少促炎因子分泌,增加抗炎因子分泌,抑制炎症反应。结果提示提高海马自噬活性有利于减轻神经炎症反应,与文献[17]抑制自噬恶化中枢炎症反应的结果一致。
综上所述,抑制mTOR通路,激活自噬,可调节脓毒症小鼠海马组织小胶质细胞表型转化,发挥抗炎作用。mTOR-自噬通路有望作为减轻脓毒症脑病的治疗靶点进行深入研究。
