苋菜AtPAL基因克隆与表达分析
2019-08-15黄彬茹赵春丽赖钟雄刘生财
曾 林 ,黄彬茹 ,王 晓 ,赵春丽 ,赖钟雄 *,刘生财 *
(1.福建农林大学园艺学院,福建福州 350002;2.福建农林大学园艺植物生物工程研究所,福建福州 350002)
苋菜(Amaranthus tricolor L.)属于石竹目苋科苋属,为一年生植物,又名凫葵、莕菜等。苋菜中富含多种营养物质,具有很高的营养价值[1],并且富含类黄酮[2]、甜菜色素[3]等多种具保健功能的次生代谢物质,在近20年来成为研究热点,引起越来越多的关注[4]。
苯丙烷代谢通路是植物体中苯丙烷类物质代谢的一条重要途径,其直接或间接产生了植物体中所有含苯丙烷骨架的物质,如木质素、黄酮类物质等[5-6],苯丙氨酸解氨酶(phenylalaniammonia-lyase)是苯丙烷途径代谢中的第一种酶,也是关键酶和限速酶[7],是许多次级代谢产物的前体[8]。大量研究表明,PAL基因在维持植物正常生长发育及参与植物抗逆境作用等方面均发挥着重要作用[9-10],如菜心的抗逆性[11]、桂花类黄酮的积累[12]等。目前,研究PAL基因的表达调控机理对研究植物次生代谢物的产生具有重大意义,是现在研究的热点之一。
光是植物体正常生长发育必不可少的环境因子,不仅直接影响到植物的光合作用,同时对植株形态建成、营养元素、化学成分等方面均有一定影响[13]。前人研究表明,光对PAL基因的表达以及甜菜色素、类黄酮等物质的积累也具有重要作用。谢灵玲等[14]研究发现,红光、蓝光、紫外光都能够诱导大豆PAL基因的表达;刘洋等[15]研究发现,不同光质对青钱柳叶黄酮类化合物含量和PAL活性均有显著影响,且两者存在显著的交互作用。
水杨酸(Salicylic acid,SA)是一种重要的植物激素,可调节植物体的一些生理活动,在植物体的抗病抗逆上具有重要作用[16]。前人研究发现,PAL基因参与植物体内水杨酸的合成[16]。赵亚婷[17]研究发现,水杨酸处理能增强杏果实PAL基因的表达,并且能显著提升杏果实PAL的活性及类黄酮含量;韩秀丽[16]研究发现SA处理能够诱导大麦PAL基因的表达。
1 材料与方法
1.1 材料
试验所用种子材料是从南京金盛达种子有限公司购买的‘全红’苋菜品种。选择健康饱满的种子经催芽后播种于营养钵中,放置于室外自然光照条件下,30 d后苋菜苗长到20 cm左右,取其叶片用于RNA提取,每次取样均为3次重复。
1.2 总RNA的提取及cDNA的合成
苋菜总RNA提取使用Bio Teke的多糖多酚植物总RNA提取试剂盒(北京百泰克生物技术有限公司)。采用1%的琼脂糖凝胶电泳检测苋菜总RNA的可靠性,利用超微量分光光度计检测RNA样品的浓度和纯度。cDNA第1链采用Fermentas公司的RevertAidTM First Strand cDNA Synthesis Kit试剂盒进行合成,用于 ORF 及 3′-RACE、5′-RACE 的扩增。
1.3 AtPAL基因cDNA全长序列克隆
1.3.1 引物设计与合成。从福建农林大学园艺植物生物工程研究所实验室已构建的苋菜转录组数据库中筛选PAL基因的序列片段,然后通过NCBI数据库比对确定所要克隆的PAL基因序列,利用DNAMAN7.0软件和NCBI在线比对分析,从开放阅读框两端设计1对特异引物,利用扩增出来的ORF区域,根据 3′-RACE、5′-RACE 的要求设计引物,引物由北京六合华大基因科技有限公司合成(表1)。
1.3.2 AtPAL基因ORF序列的获得。以合成的cDNA第1链为模板进行PCR扩增,扩增产物利用琼脂糖凝胶回收试剂盒(Gel/PCR Extraction Kit)进行回收纯化,以pMD18-T为载体进行连接,利用大肠杆菌DH5α感受态细胞进行转化,而后进行活化、涂板,37℃恒温培养12 h、挑菌,37℃摇床中培养12 h,菌检PCR,检验后菌液送至北京六合华大基因科技有限公司进行测序验证。
1.3.3 AtPAL基因3′RACE和5′RACE扩增。从获得的ORF片段靠近3′端及5′端处分别设计基因序列的2条3′-RACE正向特异引物及2条5′-RACE反向引物(表1),以逆转录合成的cDNA为模板,进行2轮槽式PCR扩增,扩增出3′端带PloyA的UTR序列及5′端UTR序列。扩增后进行测序拼接验证。

表1 引物序列
1.4 AtPAL基因的生物信息学分析
利用DNAMAN7.0进行基因序列及氨基酸序列比对;采用NCBI的BLAST检索分析基因序列,并从GenBank中挑选出甜菜、菠菜等27个物种的PAL基因的氨基酸序列,采用MEGA7.0构建系统进化树;采用 ProtScale(http://web.expasy.org/protscale/)进行AtPAL蛋白基本理化性质分析;采用SOPM(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopm.pl)进行蛋白二级结构分析;采用SWISS.MODEL(http://swissmode1.Expasy.org/interactive)进行蛋白三级结构预测;采用 Wolf Psort Prediction(http://www.gen—script.com/psort/wolf—psort.htm1)进行亚细胞定位分析 ;采用 TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白跨膜结构分析;采用SignalP(http:/www.Cbs.Dtu.dk/services/SignalP/)进行蛋白信号肽分析;采用 NetPhos(http:/myhits.isb—sib.ch/cgibin/motif—scan)进行翻译后蛋白修饰位点分析。
1.5 非生物胁迫条件下AtPAL基因表达分析
1.5.1 不同光质处理下。选取健康饱满的‘全红’苋菜种子,依次用体积分数75%乙醇、0.1%升汞进行消毒处理1、8 min,消毒后用无菌水对种子进行5次冲洗,在无菌的条件下将消毒后的‘全红’苋菜种子播种在MS培养基中,然后放置在恒温培养室中暗培养7 d。7 d暗培养后将材料移至不同光质(红、蓝、绿、白、黑暗)下进行培养,在处理后的3 h时取苋菜幼苗的根上部分,随机取样,重复3次,冻存,之后进行qRT-PCR定量分析。
1.5.2 不同浓度SA处理下。根据日本园试配方配制所需的水培营养液,将‘全红’苋菜种子放置于营养液上的水培海绵块中全光照培养20 d(水培盆周边进行遮光),20 d后将材料移入不同浓度SA(0.25、0.5、0.75、1.00、1.25 mmol/L)条件下进行培养,以不含SA的组为对照,处理12 h后取苋菜幼苗的根上部分,随机取样,重复3次,冻存,之后进行qRT-PCR定量分析。
1.5.3 AtPAL基因荧光定量PCR分析。使用Bio Teke多糖多酚植物总RNA提取试剂盒提取样本总RNA,采用1%琼脂糖凝胶电泳检测总RNA的可靠性,利用超微量分光光度计检测RNA浓度和纯度,利用SYBR ExScriptTM试剂盒合成cDNA。根据AtPAL基因全长设计qRT-PCR定量表达特异引物,Actin为内参基因(表1),采用Roche Lightcycler480进行定量表达分析,计算基因相对表达量。
2 结果与分析
2.1 AtPAL基因的克隆结果
以‘全红’苋菜为材料进行基因序列扩增获得的结果如图1所示,通过NCBI的比对和DNAMAN的拼接验证,确认最终获得了苋菜PAL基因cDNA的全长序列(GenBank登录号:MK574874),将其命名为AtPAL,该基因cDNA全长为2 476 bp,包含一个长为2 142 bp的ORF,预测编码713个氨基酸,5′端UTR 序列为 112 bp,3′端 UTR 序列为 222 bp,poly A尾巴长为29 bp,终止密码子为TAA。
2.2 AtPAL基因的生物信息学
2.2.1 AtPAL蛋白基本理化性质。苋菜AtPAL蛋白基本理化性质分析结果显示,该蛋白理论编码蛋白分子量为(Mw)77.469 2 kD,理论等电点(pI)为6.10,分子式为C3408H5455N957O1048S27,原子总数为10 895,不稳定系数(II)为34.96,小于40,推测苋菜AtPAL蛋白为不稳定蛋白,脂肪系数(AI)为90.08。AtPAL中带正、负电氨基酸数量分别为81个和72个。
2.2.2 AtPAL蛋白序列二级及三级结构。使用SOPM预测的苋菜AtPAL蛋白的二级结构(图2)显示,序列中α螺旋、β转角、延伸片段和随机卷曲分别占51.05%、7.57%、10.80%和30.58%,说明AtPAL蛋白二级结构以α螺旋为主。使用SWISS-MODEL预测的AtPAL蛋白三级结构如图3所示。

图1 苋菜AtPAL基因PCR扩增产物

图2 苋菜AtPAL蛋白二级结构分析结果

图3 苋菜AtPAL蛋白三级结构

图4 27个物种 PAL蛋白系统进化树
2.2.3 AtPAL蛋白信号肽、亚细胞定位及跨结构域。TMHMM分析结果表明,AtPAL蛋白属于非跨膜蛋白,不含跨膜螺旋区。SignalP分析结果显示,AtPAL蛋白不含信号肽序列。使用Wolf Psort预测表明,其亚细胞定位于内质网。NetPhos 2.0 Serve分析结果显示,AtPAL蛋白含有59个磷酸化修饰位点,丝氨酸(S)、酪氨酸(Y)、苏氨酸(T)磷酸化修饰位点分别为31个、8个和20个,表明AtPAL蛋白主要在丝氨酸和苏氨酸残基上磷酸化。
2.2.4 不同物种PAL蛋白序列对比与进化树分析。AtPAL氨基酸序列比对结果显示,AtPAL与甜菜、藜麦、菠菜3种甜菜色素代谢类型植物的PAL同源性均在90%以上,并且与花青素代谢类型的康乃馨、葡萄、杏、毛白杨、番茄的同源性也都在84%以上,这进一步证实该次克隆获得的是苋菜的AtPAL基因。利用MEGA7.0构建的系统进化树如图4所示,结果显示,单子叶植物与双子叶植物被分成了2个不同的分支,苋菜AtPAL蛋白与同为石竹目的甜菜、菠菜、康乃馨、藜麦4个物种的PAL蛋白聚成一类,其中同属藜科的甜菜、菠菜、藜麦单独聚成一小类,表明苋菜AtPAL蛋白与藜麦、甜菜、菠菜、康乃馨的PAL蛋白亲缘关系较近,而与水稻、葡萄、番茄等的PAL蛋白亲缘关系较远。
2.3 非生物胁迫条件下AtPAL基因实时定量PCR(qRT-PCR)分析
2.3.1 不同光质处理对AtPAL基因表达量的影响。AtPAL基因的定量分析结果显示,在红光、白光、绿光、蓝光4种不同光质处理下,除白光处理外,AtPAL基因在’全红’苋菜中的表达量相较于CK对照(黑暗)都呈现上调变化(图5),而白光处理下则呈现下调变化。在蓝光处理下,AtPAL基因表达量最高,且与对照组相比出现极显著差异(P<0.01),但红光、白光、绿光处理下与对照组相比AtPAL基因的表达量没有出现显著差异,说明蓝光能够明显促进AtPAL基因的表达。

图5 不同光质处理下AtPAL基因表达情况
2.3.2 不同浓度SA处理对AtPAL基因表达量的影响。AtPAL基因的定量分析结果显示,在不同浓度SA的处理下,AtPAL基因在‘全红’苋菜中的表达量相较于对照组都出现上调的变化(图6),呈现出“升—降—升”的变化趋势,且不同浓度SA处理下AtPAL基因的表达量相较于对照组都出现极显著差异(P<0.01),当 SA 浓度为 0.75 mmol/L时,表达量达到最高。
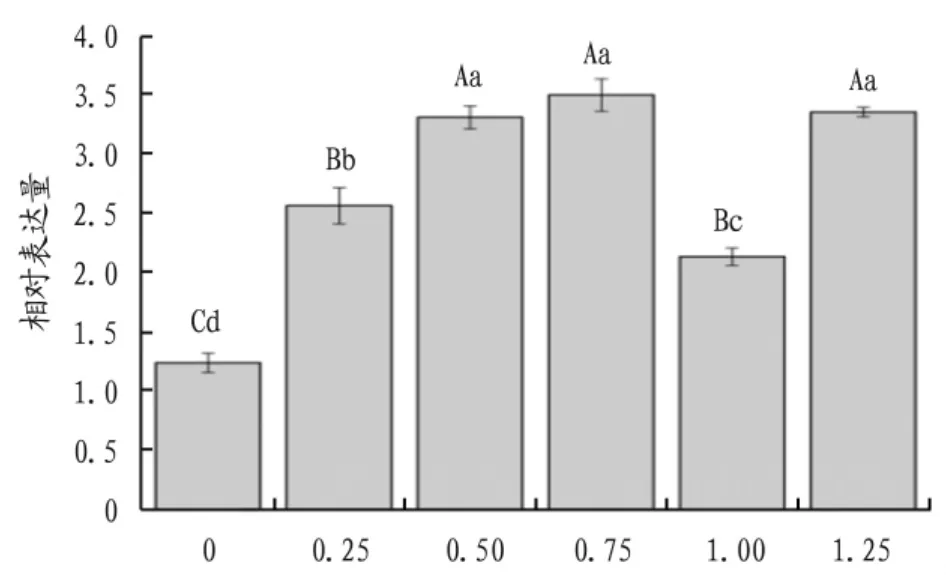
图6 不同浓度水杨酸处理下AtPAL基因表达情况
3 讨论
目前,PAL基因已在石榴、夏枯草等物种中成功克隆[18-19],前人研究表明,目前所报道物种的PAL同源基因cDNA序列长度为2 096~2 650 bp,编码628~730个氨基酸[20],该研究克隆得到的苋菜AtPAL基因cDNA序列全长为2 476 bp,编码713个氨基酸,与前人研究所得结果接近。
细胞内蛋白质磷酸化与信号转导密切相关,其磷酸化部位主要有苏氨酸、酪氨酸和丝氨酸结合位点[11],PAL磷酸化后其蛋白质活性也会改变,这种改变对于植物生理生化应答反应具有重要意义[21]。该研究发现AtPAL蛋白主要是在丝氨酸和苏氨酸残基上磷酸化,少数在酪氨酸位置上被磷酸化,与冯立娟等[18]研究所得结论相符。系统进化树结果表明,AtPAL氨基酸序列与藜麦、菠菜、葡萄等植物的PAL氨基酸序列具有很高的同源性,可见PAL作为植物苯丙烷代谢途径中第1个关键酶,在进化的过程中有着较强的演化趋同性与遗传稳定性,与前人的研究结果吻合[22]。分析结果可以为生物进化研究提供一定的科学参考。
谢灵玲等[14]研究发现,红光、蓝光、紫外光都能促进大豆PAL的基因表达,该研究发现不同单色光处理,都能够上调AtPAL基因的表达,并且蓝光最有利于AtPAL基因的表达,与前人研究所得结论一致。韩秀丽[16]研究发现水杨酸可以促进大麦PAL基因的表达,在该研究中也发现水杨酸能够上调AtPAL基因的表达,结果与前人研究结论相符。AtPAL基因在不同非生物胁迫条件下的应答反应暗示其在苋菜的抗逆防御反应过程中发挥着重要作用。此外,大量研究表明PAL基因的表达与光质、水杨酸、以及黄酮类物质的含量都存在明显的相关性[15,23-24],谢灵玲等[14]发现,红、蓝光在促进大豆PAL基因表达的同时还能促进异黄酮的积累,赵亚婷[17]发现SA能够显著促进杏果实PAL基因的表达及类黄酮的积累,提升果实抗病性,因此推测苋菜很有可能是通过调节AtPAL基因的表达来控制黄酮类物质的合成从而提升其对逆境的抵抗能力,但具体是否存在这样的分子调控机制还有待进一步的探究。
该研究首次对苋菜AtPAL基因进行克隆并进行生信分析和表达分析,为探讨苋菜次生代谢的调控机理奠定基础,也在提高植物类黄酮含量、增强作物抗逆等方面有一定的指导价值。
