商陆皂苷甲对IL-17诱导肾小球系膜细胞增殖的影响*
2019-07-09汤杰印张祥贵徐丽君
汤杰印,张 薇,张祥贵,徐丽君
遵义医科大学第五附属(珠海)医院肾内科(珠海519100)
肾小球系膜细胞(Glomerular mesangial cells,GMC)是肾小球内固有细胞之一,GMC大量增殖及其细胞外基质(Extracellular matrix,ECM)分泌增多是各种增殖性肾炎的重要病理基础[1-2]。白介素-17(Interleukin-17,IL-17)细胞主要是由辅助性Th17(T helper cell 17,Th17)合成并分泌的促炎因子,研究证实Th17及其分泌的IL-17参与多种肾脏疾病,尤其在增殖性肾炎的发生、发展中起着重要的作用[3-5]。IL-17可刺激GMC增殖合成并分泌纤连蛋白(Fibronectin,FN),加速肾小球硬化的进展[6]。商陆皂苷甲(Esculentoside A,EsA)具有显著的抗炎症、抗肿瘤,调节免疫,抑制细胞增殖和促凋亡的作用[7-9],具有重要研究价值。我们课题组前期通过体内实验发现,EsA可下调狼疮模型小鼠外周血TNF-α、IL-6的表达,抑制肾脏组织Bcl-2、PCNA表达并诱导Fas、FasL及Caspase-3的表达,促进了肾固有细胞的凋亡,抑制了肾组织的增生,改善了蛋白尿及肾脏的病理状况[10-13];体外实验发现EsA可直接抑制GMC增殖、CDK2的表达及ERK1/2-AP1通路活化,上调了P27表达,抑制GMC细胞周期进程[14-18],EsA还抑制了CD4+T分化Th17减少了IL-17分泌。考虑EsA可能是通过肾脏固有细胞(GMC等)及淋巴系统(CD4+T等)途径来达到治疗系膜细胞增殖性肾炎的作用,对于EsA在组织中的具体作用机制究竟是间接通过淋巴系统还是直接作用于肾脏GMC等固有细胞或是两者皆有之来实现的,目前并不清楚。本研究观察EsA对IL-17诱导的GMC增殖及其细胞外基质FN表达影响,探讨EsA治疗系膜细胞增殖性肾炎的可能机制。
材料和方法
1 材 料 rGMC株(HBZY-1)由CCTCC提供。商陆皂苷甲(上海源叶生物科技有限公司),生产批号:KM0521CA14。IL-17(Prospec公司),DMEM培养液、优级胎牛血清(Thermo公司),胰酶溶液(碧云天生物技术研究所),噻唑蓝、二甲基亚砜(Aladdin试剂),磷酸盐缓冲液(1×)(Thermo公司),大鼠纤连蛋白酶联免疫吸附测定(ELISA)试剂盒。
2 方法与分组
2.1 GMC培养:GMC株购回后,细胞培养液透明、清亮,倒置显微镜下见细胞单层铺满瓶底,呈梭形,适应性培养4 h后,吸弃上清液,用磷酸盐缓冲液清洗细胞2次,胰酶消化细胞,见细胞收缩变圆,片状脱落时,加入10%FBS 的DMEM,终止消化,吹打成单细胞悬液,移入离心管里,800 次/min,5 min离心后,弃上清,将含10%FBS的DMEM培养液3 ml加入离心管重悬细胞,分装3个25 mm2培养瓶,即1∶3方式传代,每瓶培养液加至5 ml并吹打均匀后放入37℃,5%CO2培养箱中继续培养,每48 h更换培养液,观察细胞生长迅速,每72 h予以传代。本实验选用6~9代rGMC。
2.2 细胞实验分组:在检测IL-17对GMC增殖影响中,根据IL-17浓度分为:对照组(不加药物干预),IL-17(5 ng/ml)组,IL-17(10 ng/ml)组,IL-17(20 ng/ml)组,IL-17(50 ng/ml)组,IL-17(100 ng/ml)组共六组;在检测EsA对IL-17诱导的rGMC增殖及其对FN表达影响中分为:对照组(加入IL-17)、干预组(加入IL-17、终浓度为5mg/L EsA)共两组。
2.3 MTT法检IL-17对GMC增殖的影响:取对数生长期GMC接种于96 孔板,先培养箱孵育24 h后使GMC同步化于G0期。对照组为加入5%FBS的DMEM,其余各组加入5%FBS的DMEM及相应浓度的IL-17,上述各组分别培养至24、48 及72 h时,换取新鲜培养液,每孔加入0.5%MTT 20 μl,继续培养4 h后结束培养,吸弃旧培养液,各孔加入150 μl DMSO,室温振荡10 min,充分溶解结晶颗粒,用酶联免疫检测仪OD490值。实验重复4次。
2.4 EsA对IL-17诱导的GMC增殖及其对FN表达的影响:按照上述方法,对照组加入IL-17及5%FBS的DMEM、干预组加入IL-17、终浓度为5 mg/LEsA及5%FBS的DMEM,培养各组细胞至24、48、72 h,仔细收集各组细胞上清液后室温下备用,MTT法检测各组细胞OD490值,实验重复4次。FN的表达采用ELISA试剂盒检测收集的各组细胞上清液,具体步骤按照试剂盒说明书进行检测。
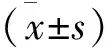
结 果
1 GMC生长形态的观察 经传代24 h后GMC伸张贴壁生长,2~3 d可铺满瓶底。倒置相差显微镜下观察细胞多呈梭形,胞核居中呈卵圆形,生长密集时细胞间缝隙缩小甚至消失(图1)。
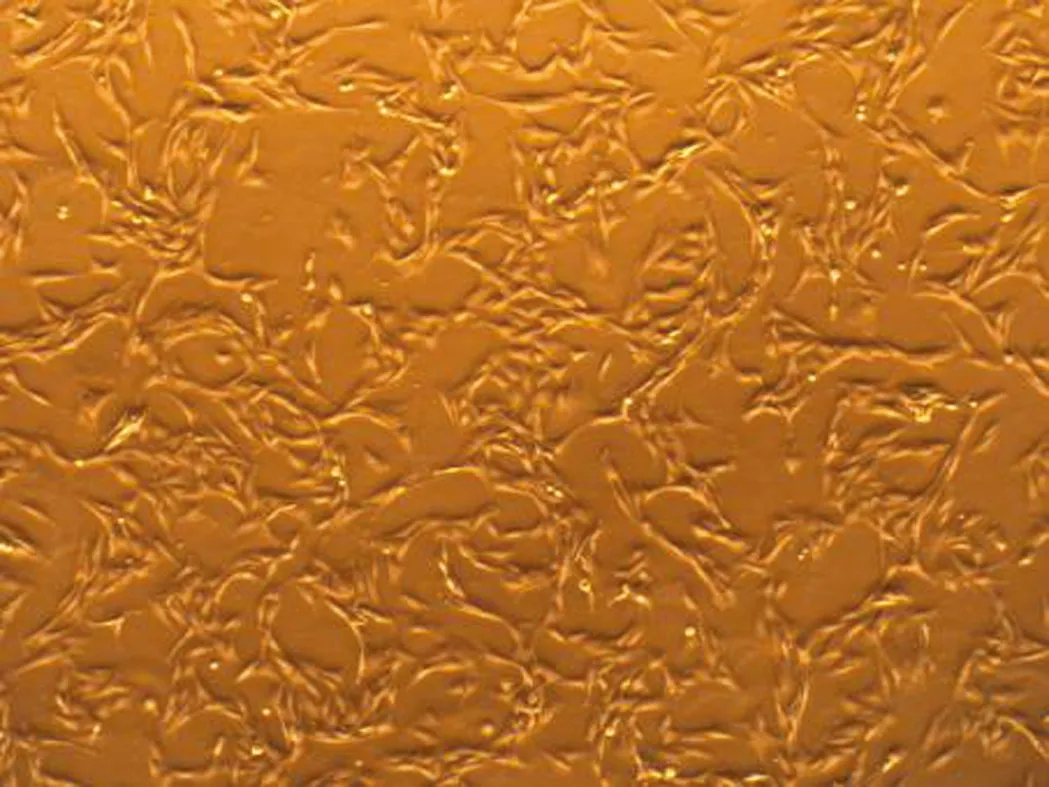
图1 正常GMC形态(×40)
2 MTT法检测IL-17对GMC增殖的影响 与对照组相比较,IL-17各浓度组明显促进了GMC增殖(P<0.05),在各检测时间点,IL-17各浓度组对GMC增殖的影响无统计学差异(P>0.05),见表1。
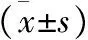
表1 不同浓度IL-17对GMC增殖的比较
注:与对照组比较,*P<0.05
3 EsA对IL-17诱导的GMC增殖及其分泌纤连蛋白的影响 与对照组比较,干预组抑制了GMC增殖(P<0.05),并明显减少了FN表达(P<0.05),见表2、3。
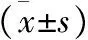
表2 商陆皂苷甲对IL-17诱导的GMC增殖的比较
注:与对照组比较,*P<0.05

表3 商陆皂苷甲对IL-17诱导的GMC分泌FN水平的比较(ng/ml)
注:与对照组比较,*P<0.05
讨 论
IL-17主要是由Th17细胞合成、分泌的细胞因子,在体内其与其受体结合后,可促进多种细胞分泌多种生长因子和趋化因子(如IL-1、IL-6、生长调节因子-α、单核细胞趋化蛋白-1等);IL-17与IL-6等细胞因子协同作用后,放大局部炎症效应;IL-17还具有强大募集炎性细胞(中性粒细胞、单核细胞等)的作用,并刺激炎性细胞产生IL-1β、IL-6、IL-8、TNF-α和PGE2等炎症因子,从而增强局部炎症并引起免疫损伤[19],参与了炎症反应及自身免疫反应[20],目前认为IL-17是一种重要的促进炎症的细胞因子。研究发现IL-17可通过激活中性粒细胞及巨噬细胞来直接参与肾脏的炎症反应,尤其在增生性肾小球肾炎中,IL-17A起着十分重要的作用[21]。Ig A肾病患者存在过量的IL-17,IL-17激活单核细胞释放一系列细胞因子,如TNF-α、IL-1β,而TNF-α、IL-1β是重要的致炎因子,提示IL-17可能参与IgA肾病肾脏炎症反应[22],与非IgA肾病患者相比,IgA肾病患者外周血IL-17及TGF-β1表达上调,且与新月体形成相关[23]。因此,IL-17在系膜细胞增殖性肾炎中起着十分重要的作用。GMC是位于肾小球毛细血管袢之间的一种固有细胞,与系膜基质构成肾小球系膜,在多种刺激后出现增殖失控,分泌大量ECM(主要为FN)及炎症因子,后者又可进一步促进GMC增殖以及ECM的分泌增多,形成恶性循环加重了肾小球损害是各种系膜细胞增殖性肾病的重要病理基础[1]。IL-17可以刺激GMC增殖及基质弥漫增生[24]。本实验结果显示:与对照组相比较,IL-17各浓度组均明显促进了rGMC增殖(P<0.05),与既往研究相符[6],提示IL-17诱导GMC增殖的实验模型成功。但本实验浓度范围内IL-17对GMC增殖影响未见浓度、时间的依赖性,可能与IL-17实验浓度筛选或检测时间点等因素有关,有待进一步实验研究。
EsA是从中药商陆的块根中提纯而得到的一种三萜类皂苷化合物。既往研究显示EsA具有调节免疫、抗炎、抑制细胞增殖和促进凋亡等作用。小剂量EsA可降低巨噬细胞的吞噬能力,并抑制其释放IL-1、PGE2等[25],但大剂量的EsA有明显的肝、肾毒副作用[26]。我们课题组既往通过体内、外实验证实了EsA可明显改善狼疮模型小鼠的尿蛋白及肾脏的炎症,EsA可抑制GMC增殖,从而改善了狼疮模型小鼠病情。FN是GMC外主要基质,是GMC纤维化标志性指标,有研究显示IL-17可刺激GMC合成并分泌FN,且IL-17与FN呈剂量依赖性,从而加速肾小球硬化的发展[6],HMCL均不表达IL-17,但IL-17可促进HMCL分泌IL-1β,且随着IL-17浓度及时间呈依赖性[27]。本实验结果显示:干预组明显抑制了GMC增殖(P<0.05)并降低了细胞外基质FN表达(P<0.01),从而证实了EsA可抑制IL-17诱导的GMC增殖,并减少ECM的分泌。其可能的作用机制是:IL-17的受体几乎表达于所有的细胞表面,IL-17与其受体结合后,主要信号传导途径有3条,首先可通过活化NF-KB,促使NF-KB速易位入核,启动转录及蛋白的合成[28];其次,IL-17可通过蛋白激酶MApK信号传导通路发挥调控细胞周期等生理作用[29];最后一条传导信号途径是JAKS/ STATs[30],而EsA能通过刺激分泌干扰素以及抑制NF-KB和丝裂原等来发挥抗炎作用。结合我们既往的研究结果,EsA可抑制CD4+转化Th17并抑制了其分泌的IL-17诱导的GMC增殖并下调了FN表达,从而改善了系膜细胞增殖性肾炎的病情,因此,EsA既可直接抑制GMC增殖也可通过淋巴系统(Th17,IL-17)间接作用于GMC,表明了EsA对系膜细胞增殖性肾炎的治疗作用是多途径多效应的,具体机制有待今后进一步研究。
本实验结果表明,EsA可抑制IL-17对GMC的增殖,并减少FN的分泌,为EsA治疗系膜细胞增殖性肾炎研究奠定了新基础。
