骨骼肌钝挫伤后线粒体自噬相关基因及自噬体变化研究
2019-06-21董贵俊温含张英祥田雪文李可峰葛新发
董贵俊 温含 张英祥 田雪文 李可峰 葛新发
1 山东体育学院(济南250102)
2 天津体育学院(天津300381)
骨骼肌钝挫伤是常见的运动损伤,特别是股四头肌和腓肠肌的钝挫伤最为常见[1]。钝挫伤后受损组织由于细胞损坏、血管破损、炎细胞浸润、缺血后再灌注等因素导致局部组织供氧不足[2,3],有氧代谢能力显著下降从而诱发能量供给障碍[4],不利于受损部位通过自身循环代谢完成自身免疫、肌纤维再生与重组,从而严重影响损伤后的恢复速度[5,6]。低氧诱导因子-1(hy⁃poxia-inducible factor-1,HIF-1)是细胞中缺氧应激调节的关键转录因子[7,8]。HIF-1 是异源二聚体蛋白,主要由HIF-1α和HIF-1β两个亚基组成,其中HIF-1α亚基受缺氧调控并调节HIF-1 的活性。在缺氧条件下,HIF-1 被激活后调节多种靶基因的转录,介导机体对缺氧应激反应的信号通路。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是具有α1 或α 2催化亚基的异三聚体,它是生物能量代谢调节的关键分子,当ATP浓度水平降低时,AMPK可被激活[9]。
机体能量供应不足或氧化应激状态下,产生大量活性氧簇( reactive oxygen species,ROS),进而影响线粒体分裂-融合的平衡使得线粒体从形态上进行代偿[10,11]。而且,细胞内ROS水平的升高、线粒体分裂-融合的动态变化也会促进线粒体自噬的发生[12,13],以清除功能障碍、受损的线粒体,达到保持细胞生理功能稳定、抑制活性氧的作用[14-16]。研究发现,高浓度的ROS也可直接激活HIF-1[7]。Bnip3 和Nix 是HIF-1 的靶基因,属于促凋亡蛋白,在缺氧条件下可以诱导细胞凋亡,还可诱导细胞自噬[17,18]。
骨骼肌钝挫伤后,受损组织缺血造成缺氧环境,有氧代谢能力显著下降进而造成能量供给障碍,产生氧化应激,诱发ROS 水平升高。缺氧或ROS 水平升高可能激活能量代谢和缺氧应激的关键因子表达,从而诱发钝挫伤后线粒体自噬相关基因表达及自噬体发生,进而促进线粒体更新以利于其质量控制,但目前关于钝挫伤后线粒体自噬发生情况及相关机制尚不明确。因此,本研究通过建立中等程度腓肠肌钝挫伤模型,研究钝挫伤后能量代谢关键因子及自噬相关蛋白,包括AMPKα2、HIF-1α、BNIP3 和NIX 的表达情况,探讨腓肠肌钝挫伤后自噬发生的可能诱发机制,对于揭示钝挫伤后线粒体损伤重建机制具有重要理论意义。
1 研究对象与方法
1.1 研究对象
Wistar 雄性大鼠64 只,体重210~230 g。大鼠及大鼠常规饲料由山大动物饲养中心提供。在山东体育学院动物房饲养大鼠。动物饲养房光照周期被控制为12 h/12 h 明暗循环(早08:00 亮灯,晚20:00 关灯),大鼠被饲养在标准笼内,采取一笼一鼠的饲养方式。标准条件下,自由进食、饮水,每周更换3次垫料,保持通风,室温(21 ± 1)℃,实验动物使用获得相关的动物管理及使用委员会的批准。
随机分为8 组(n=8)。一组为对照组,另7 组为钝挫伤组。钝挫伤组按照伤后取材时间又分为12 h组、2 d组、5 d组、7 d组、10 d组、15 d组、30 d组。参考董贵俊[5]等钝挫伤方法造模:将实验大鼠腹腔10g/L 硫喷妥钠注射麻醉后,固体木制圆柱体下落导致右小腿内侧面(其皮下为腓肠肌中段)一次打击伤。打击半径0.5 cm,打击体长度1.16 m,质量0.62 kg,打击高度0.40 m,打击重力为6108 N,打击动能为2143 J。解剖学指标、CK 等生理指标综合分析鉴定为中度损伤[13]。造模后按时间顺序取腓肠肌,部分置入-80℃冰箱保存用于电镜制片和qRT-PCR,部分直接提取蛋白进行蛋白质免疫印迹(Western blotting)检测。
1.2 研究方法
1.2.1 透射电镜观察受损部位自噬体形成
腓肠肌取材后经生理盐水漂洗,于2%多聚甲醛-2.5%戊二醛中4℃固定2 h,后经0.1M磷酸缓冲液漂洗15 min,重复3次,随后保存于缓冲液中,并于4℃冰箱保存过夜。第2天将保存过夜的材料于1%锇酸中固定1 h,后置于50%、70%、90%、100%乙醇中依次浸泡15 min;再用100%乙醇、丙酮(1:1)混合液中固定15 min;最后在100%丙酮中固定15 min。
将固定好的组织块在100%丙酮、包埋液(1∶1)混合液中室温浸透2 h进行包埋,37℃烘箱中12 h,之后于60℃放置24 h 进行聚合。用LEICA EM UC6 超薄切片机将组织块切成规格为60~70 nm 超薄切片,每只大鼠同一取材部位包埋块选取3张,于HITACHI H-7650 透射电镜下选择10 个相邻的非重叠视野观察骨骼肌超微结构并拍照。
1.2.2 RNA提取,反转录及qRT-PCR
1.2.2.1 总RNA提取
取液氮中冷冻的腓肠肌组织0.2 g,研碎后加入1 mL Trizol(Sigma,USA)充分研磨,转入EP 管中室温静置5 min。以5∶1(V/V)Trizol:氯仿的比例加入氯仿,漩涡震荡15 秒,室温静置3 min,4℃12000 r/min,离心15 min。取上层水相,按2∶1(V/V)Trizol:异丙醇的量加入异丙醇,室温放置10 min,4℃12000 r/min 离心10 min。弃上清,以1∶1 等比例加入75%乙醇进行洗涤,7500 r/min,4℃离心5 min,弃上清。将沉淀的RNA在室温下干燥6 min,后用20 μL RNase-free water 重悬RNA,-80℃保存备用。
1.2.2.2 反转录和qRT-PCR
总RNA 提取后,应用NanoPhotometer P330(Im⁃plen,Munich,Germany)对RNA 浓度和质量进行鉴定。取适量组织总RNA(不超过50 ng)采用试剂盒RevertAid First Strand cDNA Synthesis Kit(Fermen⁃tas,USA)进行反转。随后,采用SYBR green(Ap⁃plied Biosystems,CA,USA)做为荧光染料进行qRTPCR,程序设计如下:95 ℃30 s,1 循环;95 ℃,5 s,60 ℃ 30 s,40 循环(Applied Biosystems StepOne ™Fast Real-time PCR system)。实验中所使用的引物见表1。目的基因的RNA表达水平的相对定量分析采用2-ΔΔCt方法。
1.2.3 Western blotting检测
总蛋白提取:取适量组织置于玻璃匀浆器,加200 μL RIPA 裂解液,手动研碎并置于冰上30 min 后14000 转离心20 min,吸上清,提取组织总蛋白并使用Nanodrop超微量核酸蛋白测定仪进行蛋白定量。根据SDS-PAGE 上样量需要,取适量样品加入4×loading buffer后,100℃煮沸变性5 min。
SDS-PAGE 电泳:分离胶凝胶浓度为10%,浓缩胶浓度为4%。上样量为10 μL。浓缩胶恒压80V,约40 min;分离胶恒压120 V,电泳至溴酚蓝到凝胶底部。
转膜:采用湿法转膜设置,恒流300 mA,冰浴转膜2 h。
Western blotting:(1)封闭:将膜浸没在Western blotting 封闭液Ⅱ(TBST 溶解的5%脱脂奶粉,pH7.5)中室温轻摇90 min(封闭液须覆盖整张膜,且膜在其中能够摇动为宜)。(2)一抗孵育:用Western blotting封闭液Ⅱ按1:500 稀释一抗,室温孵育30 min,放4℃过夜。(3)洗膜:TBST 洗膜7 次,每次5 min。(4)二抗孵育:用Western blotting 封闭液Ⅱ稀释二抗,目的蛋白用羊抗鼠-HRP 1∶20000或羊抗兔-HRP 1:10000(根据一抗进行选择)室温孵育60 min。(5)洗膜:TBST 洗膜7 次,每次5 min。(6)ECL 反应、曝光扫描:一张8 cm×6 cm大小的膜用1 ml ECL(500 μl A 液+500 μl B 液)室温避光反应5 min,曝光1 min(曝光时间随不同光强度而调整)。(7)内参用羊抗鼠β-tabulin 1:500稀释,室温孵育30 min,放4℃过夜,洗膜7遍,每次5 min,再加羊抗鼠-HRP 1∶10000 二抗,室温孵育60 min,洗膜7次,每次5 min。
主要试剂及仪器如下:β-tubulin 兔抗单克隆抗体(Cat#:ab179513)、AMPKα2 兔抗多克隆抗体(Cat#:ab3760)、HIF-1α 兔抗单克隆抗体(Cat#:14179S)、BNIP3 兔抗单克隆抗体(Cat#:ab109362)、NIX 兔抗多克隆抗体(Cat#:ab83808)由abcam Co.Ltd提供;山羊抗兔IgG(H+L)HRP(Cat#:ZB2301)由ZSGB-BIO. Co.Ltd提供;总蛋白抽提试剂盒(Cat#:BSP003)购自Sangon⁃bio.Co.Ltd;高灵敏ECL 发光试剂盒(Cat#: WB⁃KLS0500)、PVDF 膜(Cat#:IPVH00010)购自Millipore公司;Western Show预染蛋白Marker(Cat#:26616)购自Thermo.Co.Ltd;Western blotting 封闭液Ⅱ(奶粉,pH7.5)(Cat#:PC0020)、TBS(pH8.0,20 ×)(Cat#:T1080)、SDS-PAGE 上样缓冲液(还原,4×)(Cat#:P1015)购自Solarbio.Co.Ltd。Mini-PROTEAN Tetra Electrophoresis System、BIO-RAD ChemiDoc XRS 凝胶成像系统、Powerpac Basic电泳仪由BIO-RAD(USA)提供;温控摇床由New Brunswich(USA)提供;Nanodrop超微量核酸蛋白测定仪由Thermo公司(USA)提供。
1.3 数据统计及处理
本研究中所有数据均用SPSS17.0软件进行统计学分析,选择单因素方差分析各组均值的组间差异。研究数据采用平均数±标准差± s)的形式表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 钝挫伤后骨骼肌缺氧、自噬相关因子HIF-1α、AMPKα2、BNIP3、NIX蛋白表达
钝挫伤后,12 h、2 d组腓肠肌HIF-1α蛋白质的表达水平比对照组显著升高(P<0.01);随后表达水平逐渐下降,但5 d、7 d、10 d组的表达水平仍显著高于对照组(P<0.05);伤后15 d、30 d组,HIF-1α蛋白表达水平基本恢复至正常水平(P>0.05)(图1)。
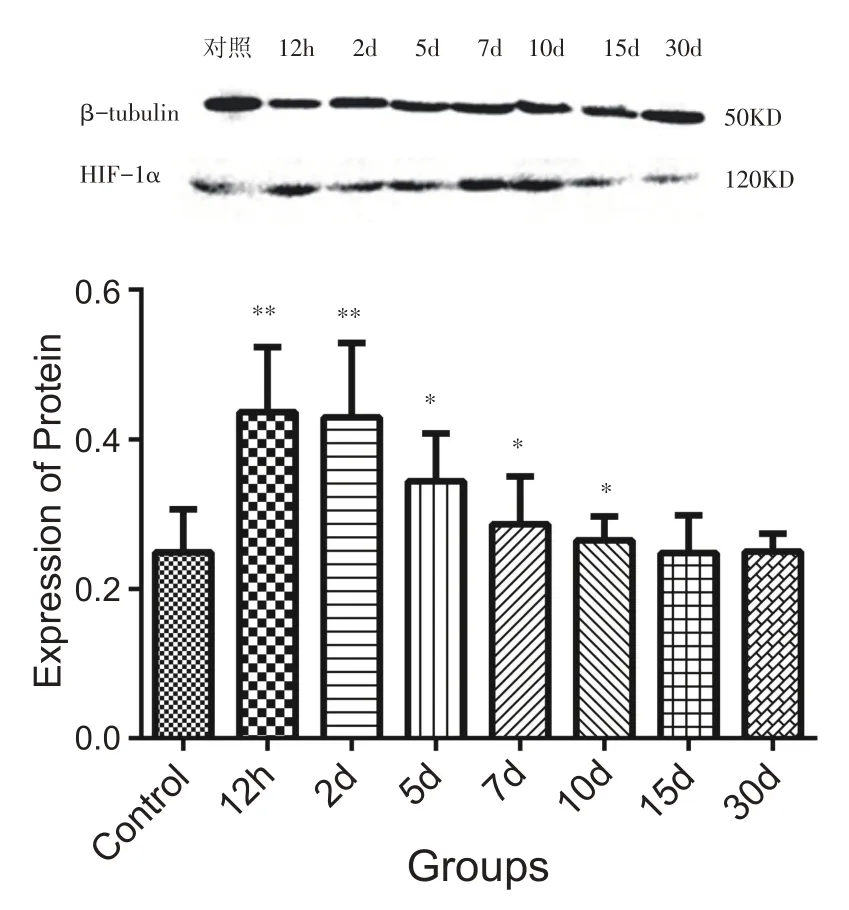
图1 不同组别HIF-1α表达柱状图(n=8)
钝挫伤后,与对照组相比,腓肠肌AMPKα2蛋白质12 h、2 d、5 d 组诱导表达升高(P<0.05,P<0.01)。7 d、10 d、15 d、30 d组与对照组相比无显著差异(图2)。
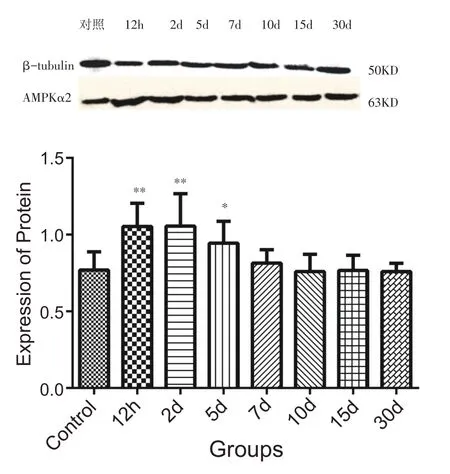
图2 不同组别AMPKα2表达柱状图(n=8)
腓肠肌钝挫伤后12 h、2 d、5 d、7 d、10 d 组的BNIP3 表达水平比对照组显著提高,特别是12 h 组和2 d 组BNIP3 表达表达水平是对照组的1.9 倍(P<0.01),伤后5 d、7 d、10 d 组BNIP3 表达水平较12 h、2 d组时有所回落,但仍显著高于对照组(P<0.05)(图3)。
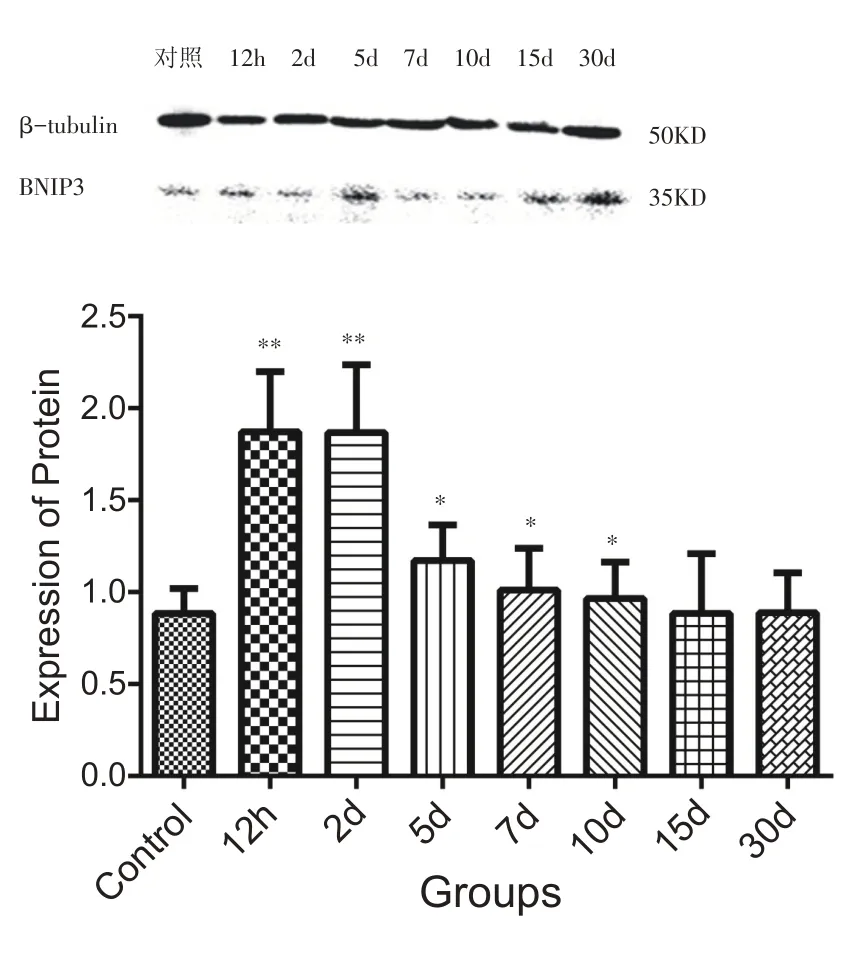
图3 不同组别BNIP3表达柱状图(n=8)
NIX 灰度值比较发现,腓肠肌损伤发生后12 h、2 d 组的NIX 表达水平是对照组的4 倍(P<0.01),5 d 组的表达水平是对照组的2.5 倍(P<0.05),7 d 组的表达水平仍维持在对照组的1.6倍(P<0.05),10 d组的表达水平与对照组无显著性差异(P>0.05)(图4)。
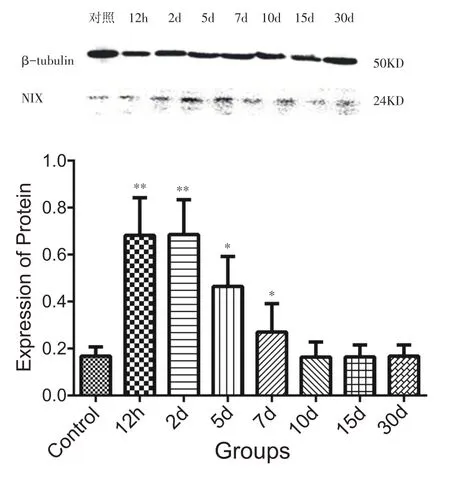
图4 不同组别NIX表达柱状图(n=8)
图5 显示HIF-1α、AMPKα2、BNIP3 和NIX 四个蛋白表达特点是表达量趋势图呈现出四条开口向下的抛物线,峰值前斜率大,既短期内迅速升高至最高点;峰值后形成一个小平台期,后开始以相对较小斜率恢复,直至正常水平。
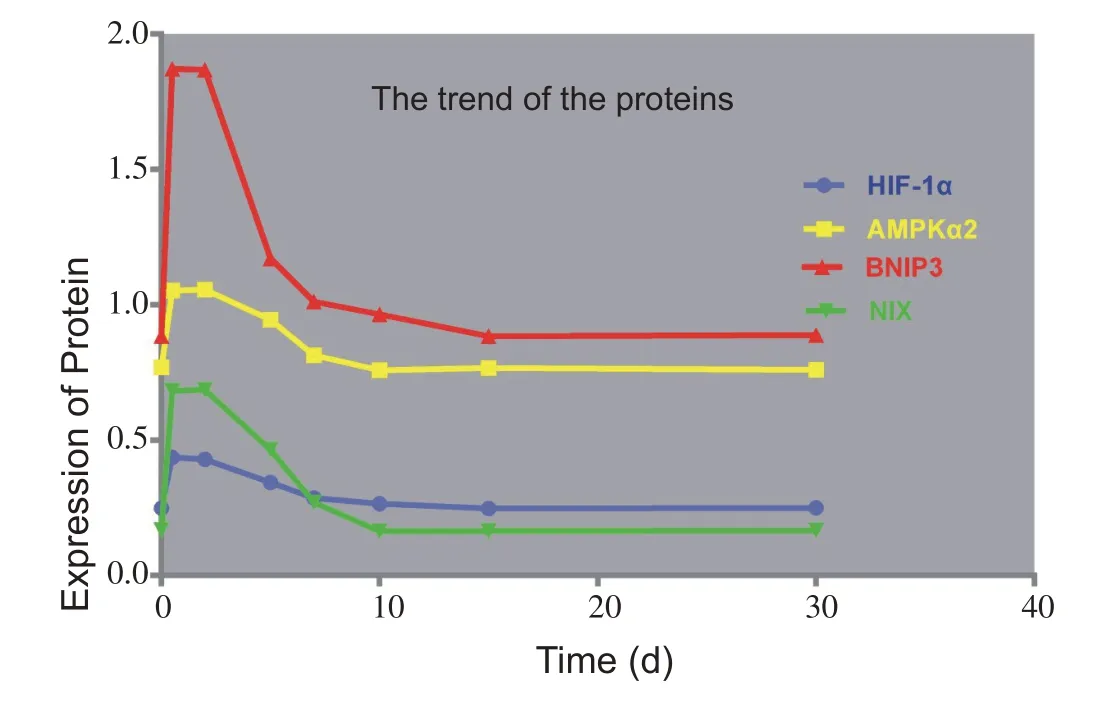
图5 不同组别各蛋白表达变化趋势图
2.2 钝挫伤后骨骼肌缺氧相关因子Hif-1α、Ampkα2、Bnip3、Nix mRNA表达变化
图6结果说明骨骼肌钝挫伤发生后,伤后2 d、5 d组与对照组相比Hif-1α mRNA 表达增高,其中2 d 组增高非常显著(P<0.01),增高水平达到对照组4~5 倍左右;5 d组与对照组相比也有显著增高(P<0.05)。其余损伤组中仅12 h 组高于对照组,但并无显著性差异,其他表达与对照组基本一致。
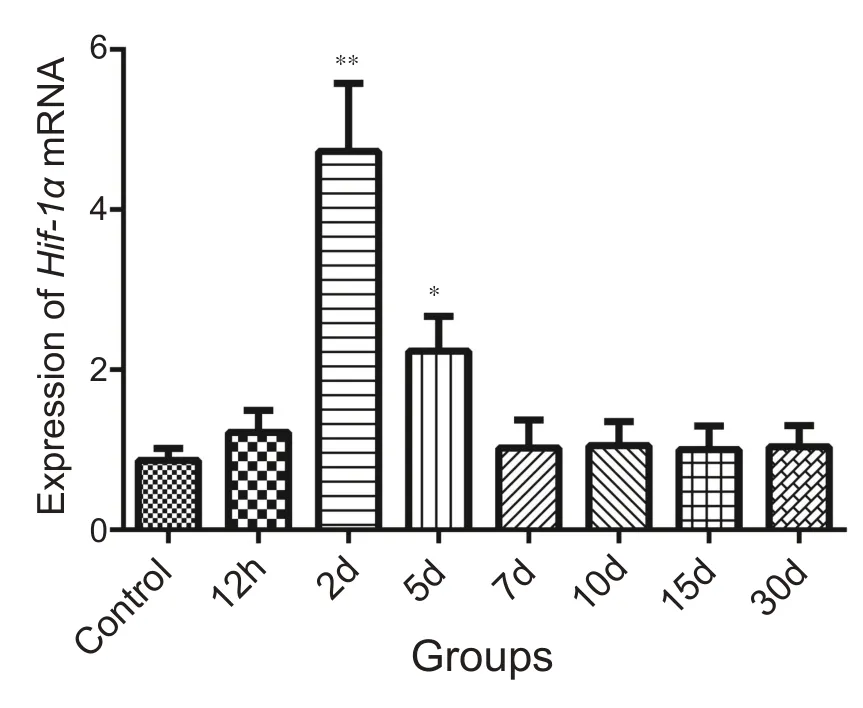
图6 不同组别Hif-1α mRNA表达柱状图
图7 结果表明骨骼肌钝挫伤发生后,伤后12 h、2 d、5 d组与对照组相比Ampkα2 mRNA表达增高,其中12 h、2 d 组增高非常显著(P<0.01),增高水平近对照组3倍;5 d与对照组相比也有显著增高(P<0.05)。
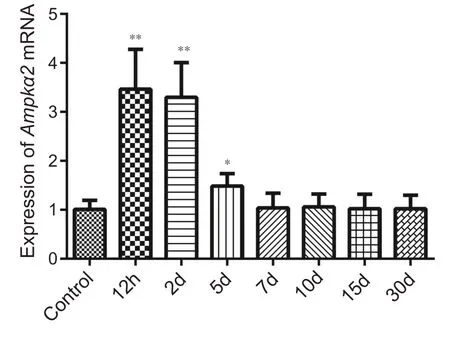
图7 不同组别Ampkα2 mRNA表达柱状图
图8结果表明损伤组除15 d、30 d外,其余时间与对照组相比Bnip3 mRNA 表达增高,其中12 h、2 d 组增高非常显著(P<0.01),增高水平接近对照组3倍;5 d与对照组相比也有显著增高(P<0.05),表达量也近似于对照组的2 倍,7 d、10 d 组表达也明显高于对照组(P<0.05)。
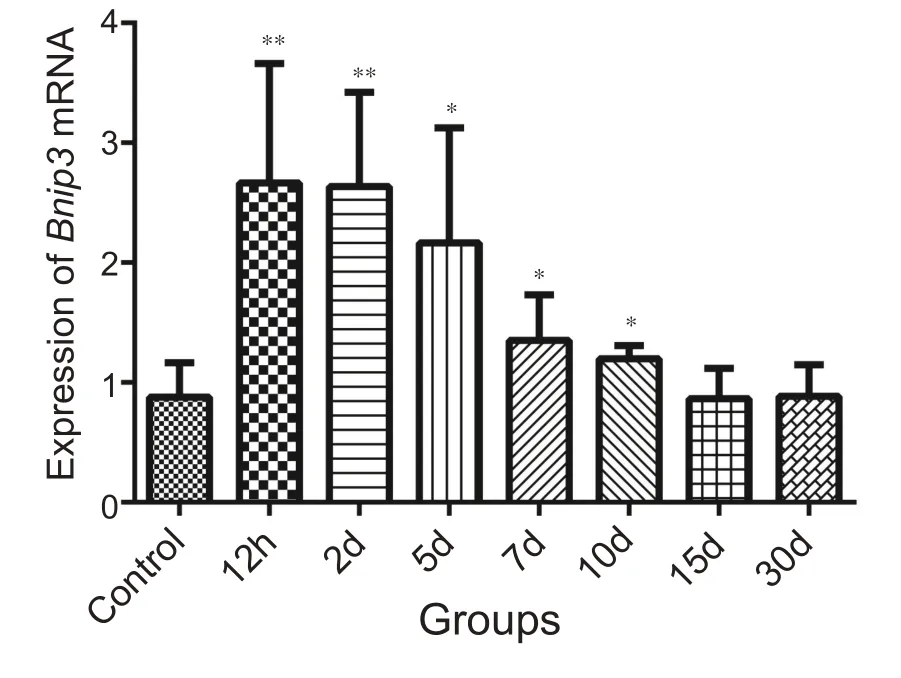
图8 不同组别Bnip3 mRNA表达柱状图
图9 表明损伤组与对照组相比Nix mRNA 表达在12 h、2 d 组增高非常显著(P<0.01),增高水平接近对照组3 倍;5 d 与对照组相比也有显著增高(P<0.05),表达量为对照组的2倍,7 d组表达也明显高于对照组(P<0.05)。
从趋势上来看(图10),Ampkα2、Bnip3、Nix mRNA变化趋势与其蛋白表达基本吻合,三者均呈开口向下的抛物线,从损伤至伤后12 h 就达到峰值,其峰值延续到伤后2 d,形成一个小平台期,此后形成斜率较小的下降期直至接近正常值;而伤后12 h骨骼肌中HIF-1α蛋白表达量已达峰值,而此时其mRNA 却仍接近正常,且其峰值仅在伤后2 d一个取材点出现,并不呈现一个小平台期,之后便开始下降直至恢复至正常水平。
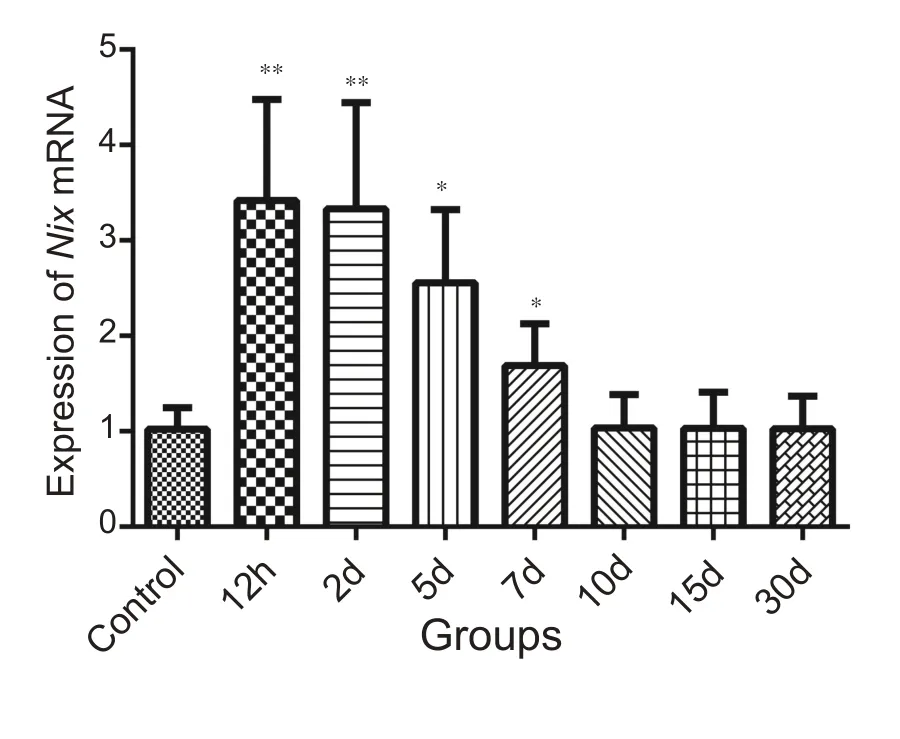
图9 不同组别Nix mRNA表达柱状图
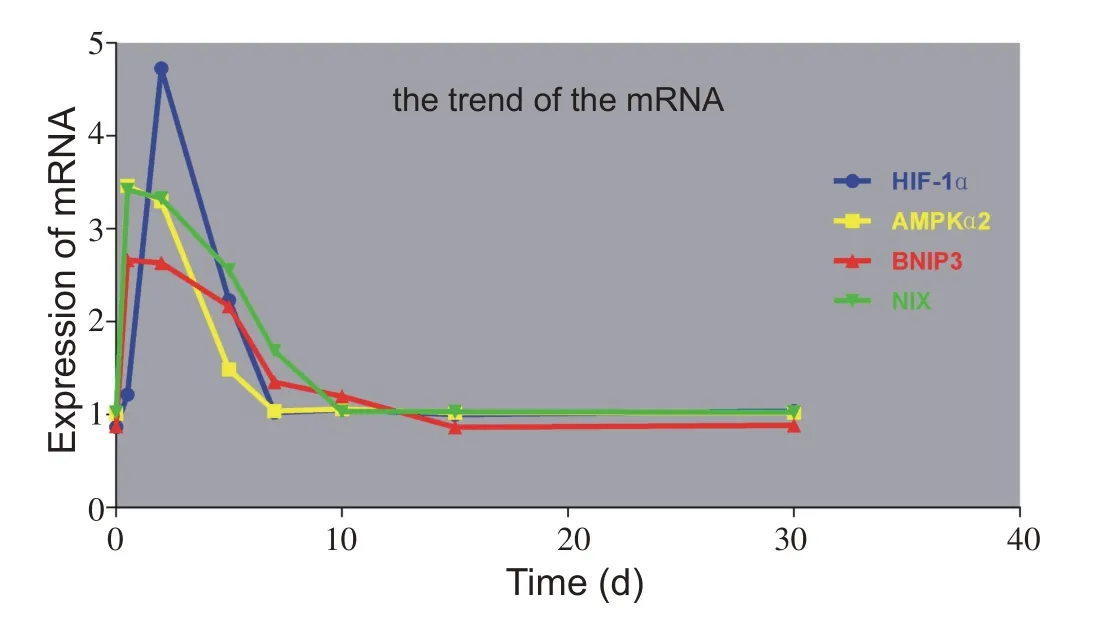
图10 不同取材时间点各mRNA表达变化趋势图
2.3 钝挫伤后腓肠肌超微结构及线粒体自噬体变化情况
对照组(图c-1、c-2):肌纤维排列规律完整,无胞膜的破损,Z线清晰连续无断裂,M线、明暗带较清晰且区域明确,Z线附近可见到长椭圆形的线粒体。
损伤后12 h 组(图12h-1、12h-2):由图12h-1(×6000)可见,肌纤维大量断裂、破损,排列凌乱,Z线完整性缺失,线粒体变圆、肿胀,甚至有空泡化表现;局部高倍(×50000)观察,线粒体嵴模糊不清,出现线粒体自噬体,自噬体由膜结构包裹和半包裹线粒体组成,有的被包裹线粒体内部染色较深,少数被包裹线粒体内部染色变浅呈现空泡状,在单个网孔视野中即可见到多个自噬体。
伤后2 d 组(图2d-1、2d-2)、5 d 组(图5d-1、5d-2)、7 d 组(图7d-1、7d-2)组:2~7 d 时腓肠肌超微结构较为接近,表现为肌纤维断裂仍然较多,但肌纤维的排列在伤后7 d组有明显的改善,三组肌纤维的Z线仍有断裂,线粒体数量明显增多,但正常线粒体形态较少,线粒体肿胀、空泡仍明显;局部高倍视野(×30000~70000)下可观察到清晰的被膜包裹、半包裹的线粒体,单个网孔视野中即可见到数量较多的自噬体。
损伤后10 d 组(图10d-1、10d-2):肌纤维仍存在断裂,但形态上排列趋于规则,破损胞膜逐渐修复,Z线仍不够完整,有断裂表现,但整体改善明显;线粒体数量仍然多于正常对照组,且形态更多表现为椭圆形,但正常形态线粒体开始增多;提高放大倍数后(×10000)视野中可见较多被膜包裹的线粒体结构,但自噬体数量比钝挫伤后12 h~7 d组相比呈现减少趋势。
伤后15 d(图15d-1、15d-2)、30 d(30d-1、30d-2):(×6000)肌纤维相对完整,15 d组虽然仍有少数断裂肌纤维,但相邻两断端之间有染色较深物质填充,可能形成瘢痕,而30 d 组仅有少数肌纤维仍能看到断裂端;肌纤维排列更加规整、有条理,Z线更加整齐完整;虽然仍存在一定数量的椭圆形线粒体,但正常形态线粒体增多接近正常对照组。高倍视野(×40000~50000)下,肌原纤维完整、清晰,排列较规整;但仍观察到极少数被膜包裹、半包裹的线粒体,即自噬体的存在。
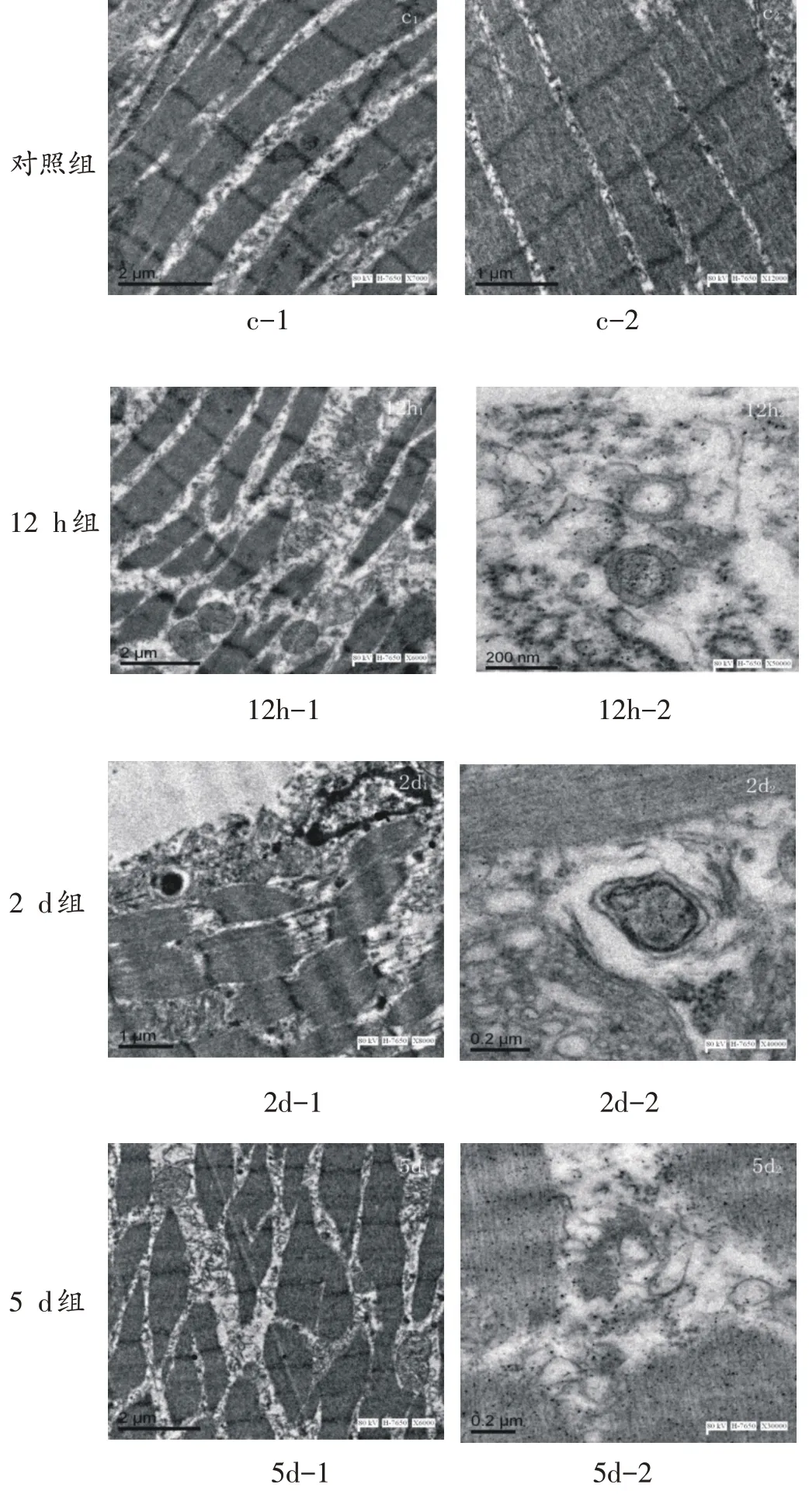
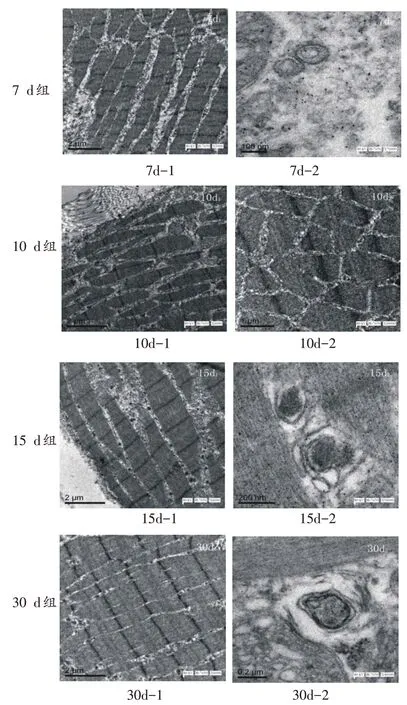
图11 钝挫伤后腓肠肌超微结构及自噬体变化图(×5000~70000)
3 讨论
3.1 腓肠肌钝挫伤对HIF-1α、AMPKα2、BNIP3、NIX 表达影响
骨骼肌钝挫伤后肌组织被破坏,血管损坏、细胞破损、炎细胞浸润、炎性因子聚集、线粒体肿胀破坏等病理性改变,导致ATP生成障碍,AMP/ ATP 的比值升高诱发肿瘤抑制激酶LKB1-STRADα/β-MO25α/β复合物生成,激活缺氧应激因子脯氨酸羟化酶(PHDs),从而激活AMPK[19,20]。而AMPK作为上游关键信号因子对诱导低氧诱导因子HIF-1促进机体和细胞产生低氧适应具有调节作用,因此钝挫伤后AMPK表达可能与HIF-1表达出现同步[21,22]。本研究中,Hif-1α mRNA在伤后第二天表达出现峰值,与对照组有非常显著性差异(P<0.01),伤后第5天表达有下降趋势,但仍较对照组有显著升高(P<0.05),伤后第7 天表达回落正常;而Ampkα 2 mRNA从伤后12 h表达较对照组有非常显著的升高且达到峰值,该趋势一直延续至伤后第2 天,伤后第5天表达虽显著高于对照组,但表达却呈下降趋势,伤后第7天表达回归正常水平至伤后30天。蛋白HIF-1α、AMPKα2表达折线图趋势说明12 h、2 d两取材点为整个恢复过程中表达的峰值,伤后10 d,HIF-1α表达均明显高于对照组(P<0.05),伤后15 d后HIF-1α表达接近正常;而AMPKα2 仅在伤后5 d 表达仍显著高于对照组(P<0.05),自伤后10 d 起,表达回归至正常水平。我们的研究表明腓肠肌钝挫伤恢复过程中,HIF-1α、AMPKα2变化趋势同前人研究的组织病理变化具有一定关联性[23,24]。在骨骼肌钝挫伤恢复过程中,HIF-1α、AMPKα2 表达在伤后12 小时和2 天内维持最高表达,说明此时是受损组织缺氧和能量障碍最为严重的应激反应期。之后,即第5天时,虽然二者的表达均显著高于对照组,但已明显下降,说明损伤5 天后,缺氧和能量障碍的状态已缓解。至第7天,AMPKα2的表达恢复至正常水平,说明此时ATP 产生已趋于正常,而HIF-1α的表达是损伤后15天时趋于正常水平,说明伤后15天组织供氧已恢复。结合病理学,即钝挫伤后5d,炎性浸润开始消退,新生血管开始向损伤组织内长入[23],此时缺血缺氧有所改善,ATP 生成有所增加,HIF-1α、AMPKα2表达量开始下降。
BNIP3、NIX 是定位在线粒体外膜的、受缺氧诱导表达、参与线粒体自噬过程的一类基因。钝挫伤诱发的缺氧导致了缺氧诱导因子HIF-1α表达升高,诱发下游因子BNIP3、NIX的表达升高。随着自体损伤修复进行,局部改善损伤部位的缺氧环境,过表达的BNIP3和NIX通过介导线粒体内溶酶体蛋白的沉积从而促进线粒体完整性[25],同时BNIP3和NIX可诱导线粒体自噬和细胞凋亡的发生[18,26],控制线粒体质量,从而促进钝挫伤修复过程。我们的结果显示:BNIP3、NIX 在骨骼肌钝挫伤伤后恢复过程中,表达量的变化趋势非常接近,在伤后12 h 即出现峰值。BNIP3 蛋白的表达自伤后5 d开始下降直至伤后10 d,但其间仍高于对照组,伤后15 d后回归正常水平;NIX的表达于伤后5 d、7 d两取材点仍高于正常,自伤后10 d开始至伤后30 d归于对照;BNIP3、NIX 的mRNA 变化情况与其蛋白表现相符。本研究中,BNIP3、NIX的表达于伤后2天内保持峰值,之后下降,直至10~15 天恢复至正常水平,这与HIF-1α的表达变化相一致,说明损伤后缺氧诱导了线粒体自噬的发生。伤后10~15天内,机体完成了受损线粒体的清除,有效的对线粒体质量进行了控制。
3.2 钝挫伤后自噬体发生与基因表达同步性分析
Fisher 等[27]早在1990 年就观察并描述了骨骼肌钝挫伤恢复过程中微观结构的变化。本研究在前人研究基础上重点对钝挫伤后线粒体形态、数量、自噬体形成等进行描述,发现12 h 后线粒体自噬体开始出现,伤后2 d、5 d、7 d 组线粒体数量明显增多,但正常线粒体形态较少,线粒体肿胀、空泡仍明显,单个网孔视野中即可见到数量较多的自噬体,说明在此期间线粒体网状结构尚未完全恢复,线粒体仍处在自噬发生阶段。损伤后10 d出现较多被膜包裹的线粒体结构,说明线粒体结构开始重建,自噬体数量趋于减少。
本研究结果显示,钝挫伤后线粒体自噬体在12 h~7 d 是线粒体自噬发生较为活跃的阶段,这与前人的研究结果一致[28]。另外,结果显示自噬体形成、发生与自噬相关蛋白BNIP3、NIX 的表达具有一定的同步性,即12 h~7 d期间BNIP3、NIX 表达明显增高,说明线粒体自噬水平出现显著提高,而电镜结果印证了上述mRNA 和蛋白水平的结果。同时,HIF-1α、AMPKα2表达也显著增高,说明钝挫伤后炎症浸润、局部血肿造成局部缺氧环境产生了骨骼肌能量代谢危机[25,29]。另外,BNIP3、NIX介导的线粒体自噬直接受到HIF-1α的调节,本研究结果HIF-1α、AMPKα2、BNIP3、NIX 表达增高说明在钝挫伤发生后12 h~7 d局部ATP 产生不足,同时缺氧明显,HIF-1α直接调控BNIP3、NIX 表达升高介导线粒体自噬发生。在钝挫伤修复过程中线粒体形态和数量在12 h~7 d 发生明显改变,其机制可能是损伤后局部线粒体发生过程被激活。钝挫伤发生后局部受损骨骼肌产生ATP 水平降低,导致AMPKα2高表达从而诱导线粒体发生[30,31]。因此,骨骼肌钝挫伤后能量调节关键因子AMPKα2、缺氧敏感因子HIF-1α、线粒体自噬诱导蛋白BNIP3、NIX表达均显著增加,且呈现与时间相关的变化,间接反映了损伤后缺氧环境发生与改善,诱导线粒体自噬,清除破损细胞器、线粒体从而加速损伤部位线粒体重建,加速钝挫伤的伤后恢复过程。
4 总结
(1)骨骼肌钝挫伤发生后,损伤早期代谢调控因子AMPKα2、缺氧敏感因子HIF-1α 损伤变化情况表明损伤后受损骨骼肌内部出现能量危机、并形成缺氧环境。另外,能量供应的恢复要早于氧供应的恢复。
(2)线粒体自噬、细胞凋亡相关因子BNIP3、NIX表达变化表明损伤后线粒体自噬被启动,缺氧诱导了骨骼肌钝挫伤早期的线粒体自噬。损伤后线粒体质量控制的完成要迟于能量供应的恢复,但与氧供应的恢复基本同步。由此我们推测,钝挫伤后有氧呼吸受阻,机体可能存在其他的能量供应代偿途径。
(3)缺氧诱导的线粒体自噬可及时清除受损线粒体,维持线粒体质量、为新生线粒体提供原料,从而减小损伤程度,以利于受损骨骼肌的快速恢复,这可能是损伤发生后机体的一种代偿性机制。
