16周高强度间歇训练对增龄大鼠骨骼肌ROS-AMPK-PGC-1α通路及最大摄氧量的影响
2019-06-21蒋中业苏浩杨中亚倪震孔振兴于晶晶
蒋中业 苏浩 杨中亚 倪震 孔振兴 于晶晶
1 北京体育大学(北京100084)
2 六盘水师范学院(贵州553004)
目前,人口老龄化问题日益严峻。因骨骼肌增龄性退变(sarcopenia)、体育运动参与的逐渐减少而导致的跌倒、骨折等问题是老年人生活质量下降的重要因素[1]。骨骼肌增龄性退变是由年龄增长引起的中老年人骨骼肌质量减少与代谢能力下降的现象。有研究指出,除药物干预外,专门针对中老年人群骨骼肌增龄性退变问题,制定以规律的抗阻运动或中等强度运动内容为核心的运动处方,来指导中老年人群有规律地参与体育运动,是改善骨骼肌增龄性退变的有效手段[2]。
Steven 等[3]研究指出,中老年人肌肉质量与力量的改善不一定能有效改善其功能表现,而骨骼肌氧化能力的变化尤其是线粒体氧化供能能力对改变肌肉表现有重要作用[4-5]。过氧化物酶体增殖物激活受体γ共激活因子1(peroxisome proliferators γ activated receptor coativator-1α,PGC-1α)是一种转录辅酶激活因子,通过与转录因子结合,调控靶基因转录。Mootha[6]、Yan[7]、Puigserver P[8]和韩雨梅[9]等研究发现,PGC-1α在线粒体数量和功能的调节中起主要作用。5′单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)是细胞的能量感受器,是PGC-1α上游一个非常重要的调节因子。
Jager[10]、Carles[11]等研究表明,AMPK 可调节PGC-1α的表达从而促进线粒体的生物合成。活性氧簇(re⁃active oxygen species,ROS)是需氧细胞在代谢过程中产生一系列活性氧簇,ROS 是AMPK 的上游激活剂[12],其量在一定范围内可使骨骼肌内AMPK得到充分的激活。当前有研究表明,PGC-1α可被其重要调节因子AMPK活化,增强骨骼肌线粒体的氧化能力,进而使机体VO2max得以提高[13-14]。高强度运动和无氧运动可以有效地通过体内ROS 的释放来激活AMPK[15]。另有研究表明,有氧运动可有效使大鼠海马体内ROS含量减少同时AMPK和PGC-1α表达量增加[16],低氧和耐力训练可有效延缓增龄过程中大鼠骨骼肌AMPK含量的下降[17-18]。
当前大部分研究主要针对衰老过程中骨骼肌质量与力量的下降,但有关增龄过程中骨骼肌氧化能力改变的研究不多。相较于中等强度运动或抗阻训练等传统运动干预手段,高强度间歇训练(high intensity in⁃terval training,HIIT)作为一种新兴的训练方式,拥有运动周期短[19]、运动依从性高[20]等特点,并可以有效地提升最大摄氧量(VO2max)[21]。本课题组前期研究表明,HIIT相比于传统的中等强度运动对提升骨骼肌有氧能力及心肺耐力更为有效[22-23]。目前,有关HIIT 对骨骼肌线粒体有氧能力影响的研究主要以短期干预为主,长时间干预的时序性研究较为少见。
本研究通过构建自然增龄大鼠模型(8 月龄)并对其进行为期16周的HIIT干预,观察HIIT对骨骼肌ROS以及线粒体合成相关蛋白AMPK、PGC-1α 含量与VO2max的影响。探讨ROS、AMPK和PGC-1α表达量与VO2max的关联性,进而为HIIT在延缓骨骼肌增龄性退变研究中的应用提供有价值的理论参考。
1 对象与方法
1.1 实验对象分组
58 只7 月龄SPF 级雄性Wistar 大鼠利用数字表随机分为:安静组(C 组,n=29)与HIIT 组(H 组,n=29)两组,分组时两组大鼠各项指标无显著性差异。所有大鼠均在屏障环境下喂养。各组大鼠进入动物房后进行为期一周的适应性喂养,其中H 组大鼠进行为期一周的适应性运动。
1.2 实验方案
1.2.1 VO2max测试方案
运动训练开始前对所有大鼠进行最大摄氧量(VO2max)测试,之后每隔两周进行一次VO2max 测试。采用动物气体代谢分析仪(Oxymax Deluxe System,哥伦布斯,美国)进行递增负荷测试。
测试原理为:每次测试之前首先采用含量为20.50%的O2和0.50%的CO2的标准气对氧传感器和二氧化碳传感器进行校正,之后进行测试,首次数据为热身4 min后出现,之后每隔30 s获得一组新的数据。
摄氧量数据通过单位时间内测得的O2的进气量和出气量进行计算,计算方法为:摄氧量=单位时间内O2的进气量-单位时间内O2的出气量。
大鼠达到最大摄氧量的评价标准为:大鼠在电刺激的情况下不能在跑台上继续跑或大鼠最大摄氧量值达到平台或产生是第一次下降前的摄氧量数值。测试的运动方案根据Leandro 等[24]的研究进行改良,具体安排见表1:
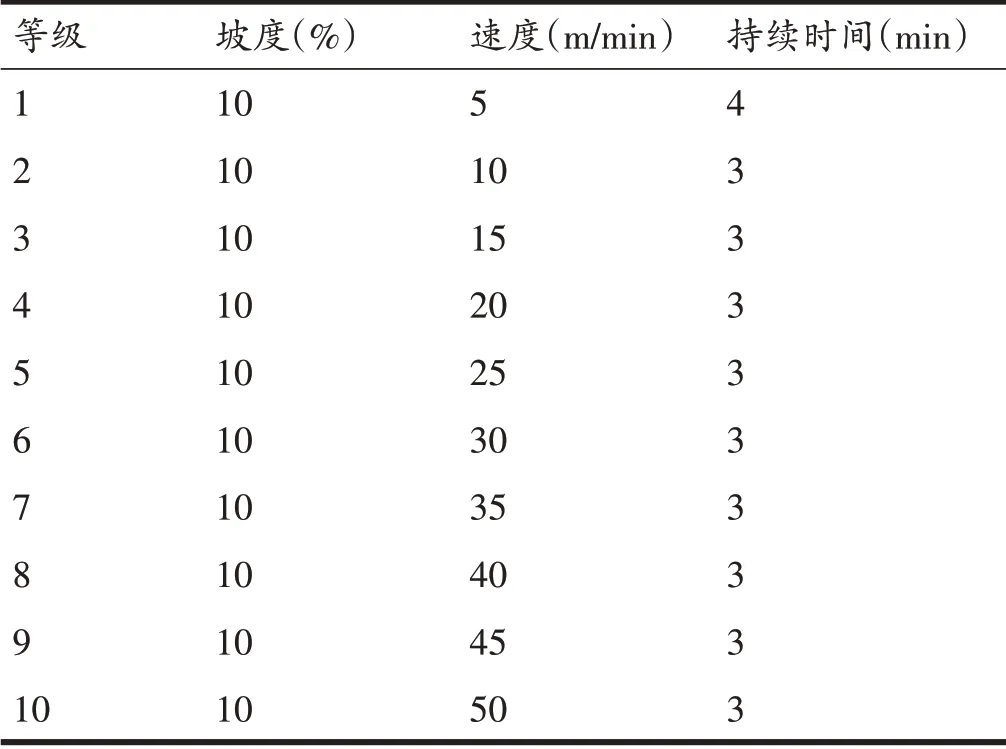
表1 大鼠VO2max测试方案
1.2.2 运动训练方案
C组:不进行运动,采用自由采食和饮水,喂养天数与H组一致。
H组:采用HIIT 运动方式进行50 min/天,5天/周,共16周的运动。运动方案见表2:

表2 HIIT运动训练方案
干预前对H组大鼠进行VO2max测试,依此来制定运动强度,之后根据每两周VO2max 测试的结果对运动速度进行调整。
1.3 取材
首次VO2max测试后以及干预的第8周、第16周最大摄氧量测试结束后24 小时进行取材。取材安排见表3:

表3 大鼠取材安排
采用2%戊巴比妥钠(剂量为0.25~0.5 g/kg 体重)腹腔注射麻醉大鼠后,固定其四肢及头部,对其左右侧后腿比目鱼肌进行切割后由铝箔纸包埋后放入-80℃冰箱保存以备用于AMPK 和PGC-1α信号因子蛋白含量的测试。
1.4 测试指标及方法
1.4.1 采用Western Blot 技术测试比目鱼肌AMPK 和PGC-1α蛋白表达量
将之前储存于-80 ℃保存的各组大鼠50 mg 比目鱼肌取出,分别迅速投入之前准备好的EP 管中,冰水浴环境下匀浆20 s 两至三次。冰浴环境静置30 min 后,于4 ℃环境下、以12 000 r/min 的转速离心3 min,取上清。使用BCA 蛋白测定试剂盒(23227,Ther⁃moScientific,Rockford,Illinois,USA)测定各组大鼠比目鱼肌样品的蛋白浓度。用酶标仪37℃孵育30 min,30 min 后在562 nm,含量设置为225(25 μL 标准液+200 μLA.B 工作液)处读数,得出OD 值。将读出数导出数据,进行计算,得出样本配方。按照配方进行配制样本,按照比例加入裂解液(4×)和样品缓冲液(NP0007,Invitrogen,Carlsbad,CA,USA),将浓度调为一致,完成后置于70 ℃环境中变性10 min。
蛋白质印迹法(Western Blot,WB)采用1X 的电泳缓冲液及NuPAGE®Novex 12% Bis-Tris Gel 预制胶加入之前制备好的骨骼肌样品,加入充满电泳缓冲液的电泳槽先后进行25 min 90 V/300 mA 和60 min 110 V/500 mA的电泳,随后按照蛋白分子量所在位置进行切胶,再制作转膜三明治(顺序依次为:滤纸、胶、甲醇活化后的膜、滤纸)进行转膜(转膜缓冲液浓度:Tris 3.03 g/L、甘氨酸14.41 g/L、甲醇200 mL/L、蒸馏水;300 mA 条件下转膜),转膜时间因相应蛋白分子量不同而有差异,转膜完成后进行BSA(Albumin from bo⁃vine serum 牛血清蛋白)封闭,孵育一抗(Anti-AMPK Ab80039,Anti-PGC1 alpha Ab54481,Anti-Tublin Ab15246,稀释比例均为1∶1000)封闭过夜,隔天用TBST 洗涤三次(每次手摇三遍并在摇床上摇10 mins),之后可酌情回收一抗,然后进行二抗(羊抗兔Ab6721稀释比例1∶10000;羊抗鼠Ab97023 稀释比例1∶10000)的孵育(至少1小时)之后用TBST洗涤三次,最后均匀滴加发光液曝光条带。条带分析中,以基础状态组作为参考对照,运用Image Lab 4.0对条带进行灰度分析得到个样本蛋白含量的相对值。
1.4.2 骨骼肌ROS测试方法
使用GENMED 试剂盒(GMS10016.3,GENMED Scientific,Arlington,USA)进行骨骼肌ROS 含量测试:实验开始前将GENMED 染色液(Reagent B)至于冰槽中融化,将GENMED稀释液(Reagent C)放入37℃恒温水浴槽加热。然后将12.5 μL Reagent B 与2.5 μL Reagent C混匀呈染色工作液,至于暗室备用。之后用5 mL GENMED 清理液(Reagent A)将组织浸泡15 s后用无菌绵纸将组织吸干。将组织剪碎后加入5 mL预冷的GENMED 稀释液(Reagent C)漩涡震荡5 s,充分混匀后即可放入预冷的组织匀浆器。匀浆后将所有组织匀浆物移入15 mL 锥形离心管至于冰槽中备用。取10 μL 组织匀浆物或GENMED 稀释液(Reagent C)加入16 孔板,并加入190 μL 之前配好的GENMED 染色工作液。混匀后,放入37℃恒温水浴槽避光孵育20 min 后即刻放入EnVision 多功能酶标仪(PerkinElmer,美国)进行测试。
1.5 数据处理与分析
所有结果均表示为平均数± 标准差的形式。所得VO2max 及其所对应跑速、ROS 和WB 数据运用SPSS 19.0 进行统计分析。测试条带采用Image Lab 4.0 进行数据采集,因大鼠来源于同一均一总体,基因条件与生活环境一致,故各组随机抽样测试值均可视作为该组的重复测量,因此所得数据组内两两对比采用单因素方差分析进行处理,组间比较采用配对样本t检验,设定显著性水平α=0.05。
2 结果
2.1 各组大鼠VO2max及跑速结果
由表4 可知,16 周增龄过程中,C 组与H 组大鼠VO2max 均呈现下降趋势。但在最后一次VO2max 测试时C 组大鼠VO2max 水平较基础状态下降幅度达到了48.9%,而H 组大鼠VO2max 较基础状态下降幅度仅37.4%。其中C 组大鼠在14 和16 周时的VO2max 显著低于基础状态,H组大鼠在第6、14和16周时显著低于基础状态;16周时C组和H组大鼠间VO2max水平未出现显著性差异。
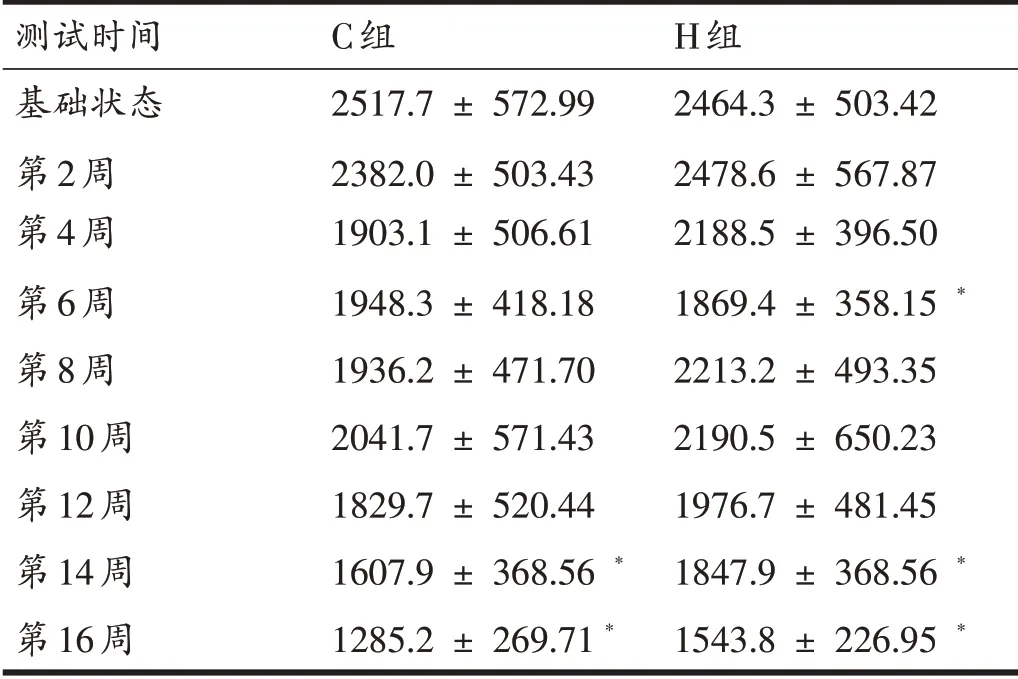
表4 各组大鼠VO2max测试结果(mL/kg/hr)
由表5可知,16周增龄过程中,C组VO2max所对应跑速呈现下降趋势。H 组大鼠VO2max 对应跑速呈现先上升后下降趋势,其跑速在8 周和16 周时均高于基础状态(P<0.05),且H 组VO2max 对应跑速在第8 周和第16周高于C组(P<0.05)。
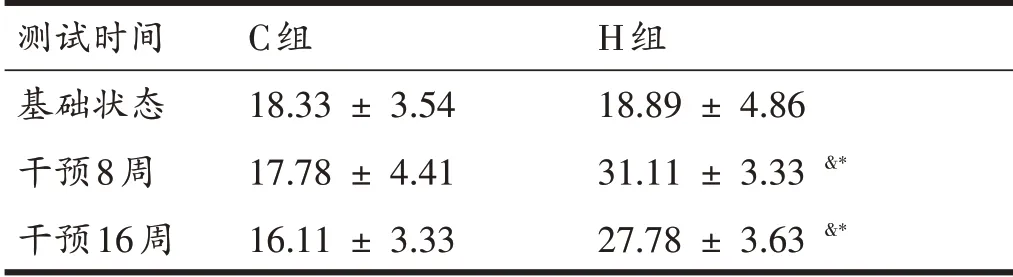
表5 各组大鼠VO2max对应跑速结果比较(m/min)
2.2 各组大鼠骨骼肌ROS含量结果
由表6可知,16周增龄过程中C组和H组大鼠骨骼肌ROS 表达量呈现上升趋势,在8 周和16 周时C 组和H 组大鼠ROS 含量均高于基础值(205.33 ± 47.61 vs 91.25 ± 7.95;170.67 ± 34.31 vs 91.25 ± 7.95,P<0.05),且16 周时ROS 表达量显著高于8 周(423.33 ±80.75 vs 205.33 ± 47.61;372.67 ± 15.04 vs 170.67± 34.31,P<0.05)。第8周和第16周时C组与H组相比两组之间并无显著性差异。但通过趋势来看,8 周和16周时H组ROS含量始终低于同时期的C组。
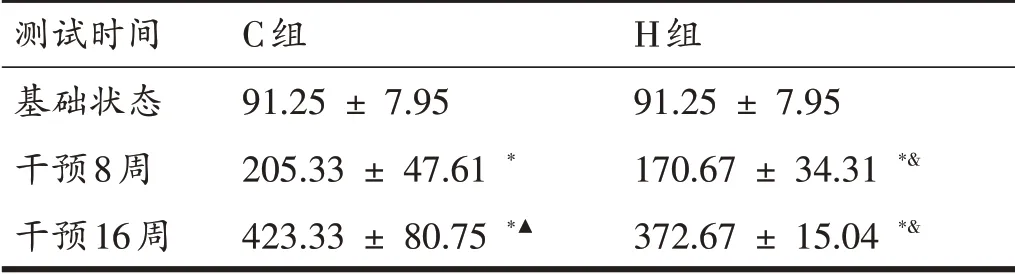
表6 各组大鼠ROS结果比较
2.3 各组大鼠骨骼肌AMPK及PGC-1α蛋白表达量结果
由表7与图2可知,16周增龄过程中C组AMPK表达量呈现下降趋势,且在第8和第16周时AMPK表达量显著低于基础值(0.73 ± 0.23 vs 1.00 ± 0.00;0.53 ±0.24 vs 1.00 ± 0.00,P<0.05)。经过16 周干预,H 组AMPK表达量呈现先升高后下降的趋势;干预的第8周、第16周AMPK表达量均显著高于C组(1.20 ± 0.24 vs 0.73 ± 0.23;0.71 ± 0.35 vs 0.53 ± 0.24,P<0.05)。
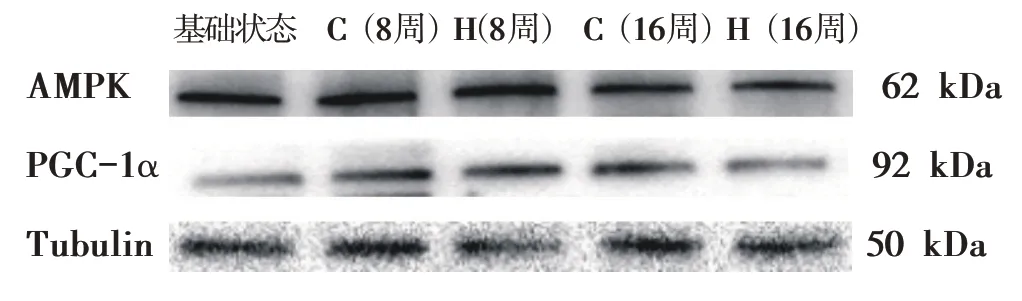
图2 各组大鼠AMPK蛋白实验结果的电泳条带
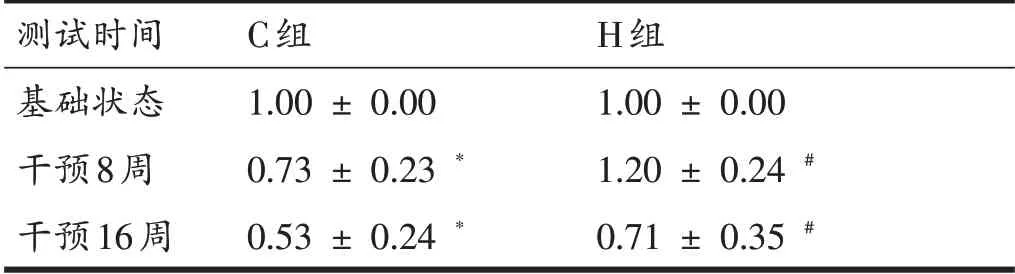
表7 AMPK含量测试结果比较
由表8 可知,16 周增龄过程中C 组大鼠骨骼肌PGC-1α表达量呈现下降趋势且在16 周时PGC-1α表达量低于基础值(P<0.05)。16周HIIT干预过程中H组大鼠骨骼肌PGC-1α表达量呈现先升高后下降的趋势,第16 周PGC-1α表达量低于第8 周(P<0.05),但第16周与基础状态相比并无显著性下降。在干预至第16周时,H 组大鼠骨骼肌PGC-1α表达量高于C 组(P<0.05)。
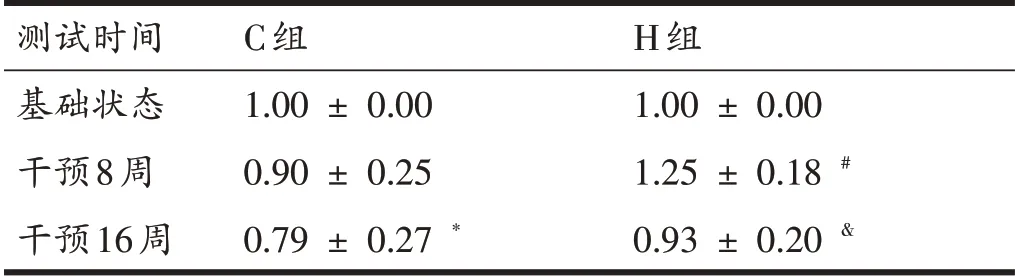
表8 各组大鼠PGC-1α含量测试结果比较
两组均出现APMK 蛋白表达量下降早于PGC-1α的变化,但C组下降更为明显,干预结束后H组上述两项指标均显著高于C组(P<0.05)。
3 分析与讨论
3.1 16周HIIT干预对ROS含量的影响
随着机体年龄的增加,在衰老过程中机体线粒体自噬水平也不断发生变化。线粒体的呼吸链能生成ROS,并且占机体ROS 产生的绝大部分。Fulle 等[13,25]的研究认为,ROS 造成的氧化损伤与骨骼肌增龄性退变的发生也有密切的关系。在骨骼肌衰老的过程中ROS 会不断产生,使骨骼肌的氧化损伤程度大大增加[26]。ROS是AMPK的上游激活剂,其量在一定范围内可使骨骼肌内AMPK 得到充分的激活,但一但过量就会造成骨骼肌线粒体的损伤进而促进骨骼肌的增龄性退变[27]。
本研究中C组大鼠ROS随着时间的推移出现了持续上升的趋势。H组大鼠和C组相比,ROS同样呈现持续上升的趋势,但明显上升量较小。8周时H组大鼠体内的ROS 被有效清除,使得H 组ROS 处于适当水平,C组的ROS在16周时高于H组,这种情况表明,运动可以对延缓大鼠骨骼肌内ROS的堆积产生良性作用。相关研究表明,耐力运动和递增负荷训练可以有效促进线粒体能量合成并使衰老细胞中的ROS得到清除[5,14,28,29],这与本研究中ROS的变化规律基本一致。但值得注意的是,16 周时H 组ROS 含量相较于8 周时上升率为119%,而16 周时C 组相较于8 周时上升率则为106%。在8-16 周过程中H 组ROS 的上升幅度较C 组更大,可能是由于此时的运动强度相较于此时大鼠的年龄相对过大,过大强度的运动使大鼠骨骼肌微循环受到损伤,从而加快了机体内ROS的累积[30]。
综合本研究中C组与H组ROS含量的变化可以说明,HIIT 运动可以对增龄过程中大鼠骨骼肌内ROS 的累积起到一定的清除作用。
3.2 16周HIIT干预对AMPK及PGC-1α表达量的影响
AMPK 的活性受AMP/ATP 比值的调节,应激反应可通过减少ATP 的产生的或者增加ATP 的利用,使细胞内AMP/ATP 升高,从而激活AMPK[31]。故在运动训练中,随着能量的消耗,必定会激活AMPK。相关研究表明,线粒体蛋白质的合成速率随着人群老化而减慢,AMPK 在耐力运动中的激活似乎在衰老骨骼肌中变慢,且线粒体蛋白合成的下降在中年更为明显[32]。本研究中,干预16 周后的C 组和基础状态相比AMPK 和PGC-1α含量有明显的下降,这样则确定了由于增龄导致大鼠骨骼肌内AMPK和PGC1-α含量存在性变化。
本研究表明,长期HIIT 运动对延缓大鼠骨骼肌AMPK 的增龄性退变有较为明显的作用。但从趋势来看8 周时相对基础状态值高,整体呈现一种先上升后下降的趋势,这种现象的出现与本实验的预期结果略有不同。因此分析前8周AMPK变化产生的原因,可能是这段时期中大鼠增龄性衰退的减少量少于HIIT运动对它的提升量,或者说这段时期HIIT 运动产生的积极作用略强于大鼠的增龄性退变产生的消极作用所致;另外也可能是由于AMPK的功能不仅与骨骼肌线粒体合成相关,还与心血管系统[33]以及消化系统[34,35]和脂肪组织[36]的氧化相关,其他组织对AMPK利用率的变化可能使骨骼肌中AMPK 含量产生变化所致。可见,无论是长期或是短期HIIT干预对延缓大鼠骨骼肌AMPK含量增龄性退变都有一定的的效果。低氧和耐力训练能使AMPK磷酸化水平提高,且8周的有氧运动可以延缓大鼠骨骼肌中AMPK 随年龄增长而产生的表达下降[17]。AMPK 是骨骼肌的能量感受器,PGC-1α在骨骼肌氧化代谢中起重要作用,AMPK作为PGC-1α的重要调节因子可活化PGC-1α,进而增强骨骼肌线粒体的氧化能力[13]。PGC-1α的升高可增强肌肉中线粒体合成相关蛋白的表达并刺激线粒体生物合成,从而促进线粒体周转,清除损伤的细胞器,使线粒体保持“功能更年轻”的状态[37]。另有研究已证实,PGC-1α的升高使增龄性退变小鼠模型退变的发生得到了有效的延缓,并且显著延长了生命周期[38]。C组和H组PGC-1α含量的变化趋势与AMPK 变化同步,基本与本实验的预期研究结果相符合。
运动主要通过促进骨骼肌AMPK 蛋白的表达,诱导提高PGC-1α蛋白的表达量进而促进线粒体的合成,即骨骼肌AMPK 的增加是PGC-1α表达增加的重要因素[39,40]。相关研究表明,耐力训练可使骨骼肌内AMPK的含量增加,且AMPK含量的增加可导致PGC-1α表达量的上升[41],前人研究基本与本实验结果相符。与AMPK 变化不同的是在16 周时H 组大鼠骨骼肌的PGC-1α的含量与8周H组相比存在明显的下降。说明HIIT 训练从短期的效果来看对延缓骨骼肌PGC-1α增龄性退变的作用效果与AMPK相似,其相比于8周时的显著性下降有可能是大鼠年龄增长,HIIT运动对PGC-1α的增加量不足以弥补增龄性退变的减少量,打破原来建立的生理平衡,所以产生了下降。但也可能是由于PGC-1α对运动训练更为敏感从而使运动延缓PGC-1α下降的效果在16周时并不如AMPK明显[42]。
综上所述,本研究结果显示16周的HIIT训练可以显著提高大鼠骨骼肌AMPK蛋白含量从而延缓增龄大鼠骨骼肌AMPK 表达量的下降,且时间越长效果越明显,但也容易造成疲劳,但长期HIIT训练对AMPK的影响更为稳定。16 周H 组PGC-1α的含量均值显著高于同时期C组,表明HIIT运动对延缓骨骼肌PGC-1α增龄性退变有较好的作用。综合ROS 与AMPK 和PGC-1α的变化结果来看,在第16周时H组的ROS水平均低于同时长C 组,而AMPK、PGC-1α均高于同时长C 组,说明长期的HIIT 训练可通过诱导AMPK/PGC-1α通路,促进骨骼肌有氧代谢来延缓机体有氧能力的增龄性退变,但过量的ROS还会使线粒体发生去极化损伤,若机体内ROS 持续保持较高水平则会导致细胞死亡的发生。通过对各组时序性变化的AMPK 和PGC-1α蛋白表达量的变化趋势进行相关分析,结果显示各组中AMPK 和PGC-1α蛋白表达量的变化具有显著的相关性,符合AMPK为运动诱导PGC-1α蛋白表达的重要影响因素的结论,但变化幅度的差别也可能说明了AMPK并不是运动诱导PGC-1α蛋白表达的唯一因素。
3.3 16 周HIIT 干预对大鼠增龄过程中VO2max 及运动能力的影响
VO2max 是评价心肺耐力的重要指标,其所对应的跑速则能有效体现机体的运动表现。研究表明,肌肉的氧化能力随增龄而下降,增龄导致的肌肉氧化能力的下降使VO2max而下降。有氧耐力运动对VO2max有促进作用,MacDougall等[43]以及Made[44]认为训练强度在60%~80% VO2max 能非常有效提高VO2max,Helgerud等[45]认为持续8 周大强度间歇运动可显著提高VO2max,另有研究表明,终生进行有氧训练会提升骨骼肌适应性,减缓随着年龄增长肌肉氧化能力的衰减[4]。另外,体重是影响VO2max 的重要指标,本研究中VO2max 采用最大摄氧量的相对值(mL/kg/hr)表示,可排除体重的影响。在本研究中,VO2max 与骨骼肌AMPK 和PGC-1α的变化趋势基本相同,但AMPK 和PGC-1α的变化幅度比VO2max 更为明显。C 组由于大鼠自然增龄而使骨骼肌有氧能力发生退变,致使出现骨骼肌有氧能力相关蛋白AMPK、PGC-1α以及心肺耐力相关指标VO2max与其对应跑速的持续下降。C组在0~12 周之间变化没有显著差异,14 周后与基础状态相比出现显著下降,表明VO2max在前10周内的增龄性影响不大。H组VO2max在0~10周之间出现先降低后升高的变化趋势。在第10周后,H组大鼠的VO2max再次出现降低,说明HIIT 对VO2max 的促进作用明显,这些现象均符合前人对运动强度和VO2max 关系的研究。H 组所对应的跑速与其VO2max 变化趋势基本相同,前8 周显著升高,8~16 周过程中虽有下降但其运动能力仍高于基础状态。运动12 周后H 组大鼠VO2max也开始呈下降趋势,这可能是由于大鼠随年龄增长而产生的正常变化。各组大鼠在12 周饲养与训练后组内与组间VO2max无显著性差异,可能是由于训练对大鼠VO2max 的影响有限,使其VO2max 尚未在统计学上形成显著性差异,但H组VO2max水平高于同期C组说明HIIT这种运动负荷方式对延缓大鼠增龄过程中心肺耐力的减弱可能存在一定作用。
综上可得,增龄过程中机体VO2max的变化与骨骼肌氧化能力下降有密切联系。长期运动训练才能有效提高机体VO2max,且HIIT 训练对延缓增龄大鼠VO2max的下降和运动表现的衰退有一定的作用,可能是通过延缓增龄过程中AMPK 和PGC-1α的变化使骨骼肌线粒体氧化能力的下降得到了抑制,进而延缓了增龄过程中机体VO2max和运动表现的下降。
4 结论
16 周HIIT 干预能有效延缓增龄大鼠VO2max 和运动能力的下降可能是通过延缓ROS在机体内的堆积并延缓增龄大鼠骨骼肌AMPK 和PGC-1α蛋白表达量下降来实现的。
