脊髓白细胞介素-10/β-内啡肽通路抑制幼年大鼠神经病理性疼痛
2019-05-30唐雪琪卢金淼毛晓芳王永祥
唐雪琪,卢金淼,毛晓芳,王永祥
(1.上海交通大学药学院King′s Lab,上海 200240;2.复旦大学附属儿科医院临床药学部,上海201102)
临床研究表明,婴儿及儿童极少发生神经病理性疼痛[1-2]。文献报道证明,在幼年(出生后10 d以内)接受神经病理性疼痛造模手术的大鼠不会发生痛觉超敏。同时较多文献报道,接受神经病理性疼痛造模的幼年大鼠脊髓背角抗炎因子IL-10(interleukin-10,IL-10)和白细胞介素-4(IL-4)表达升高,而小胶质细胞向M1型转化[3],巨噬细胞激活[4]及炎性因子白介素-1α、干扰素-γ的蛋白表达[5]都明显弱于接受造模的成年大鼠(出生33 d以后)。幼年小鼠脊髓抗炎因子IL-10基因表达升高能够抑制神经病理性疼痛的发生[5]。这些研究表明,幼年动物少发神经病理性疼痛与其免疫系统向抗炎方向激活有着密切的关系,但下游是否存在其他信号通路尚未见明确报道。本实验室的前期研究表明,鞘内注射IL-10能够通过诱导小胶质细胞表达β-内啡肽发挥镇痛作用[6]。鞘内注射β-内啡肽中和性抗体或μ-阿片受体选择性拮抗剂CTAP能够完全阻断IL-10的镇痛效果,说明IL-10的镇痛作用是由升高β-内啡肽的表达介导的。这一通路被我们定义为脊髓IL-10/β-内啡肽通路,可以被胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂及其他镇痛疗法启动[7-8]。结合文献报道以及本实验室前期研究,我们推测幼年大鼠较少产生痛觉超敏的生理现象可能是由脊髓IL-10/β-内啡肽通路介导。本研究证明了IL-10及随后的β-内啡肽释放在抑制幼年大鼠神经病理性疼痛的发生中起到关键作用,为理解神经病理性疼痛的发生发展过程提供了新思路。
1 材料与方法
1.1 实验动物与试剂
本研究所涉及动物实验方案获得上海交通大学实验动物伦理委员会批准(201708007),并严格按照有关动物福利指导进行动物实验操作。本实验所涉及动物主要包括10 d龄性别随机的SD大鼠和33 d龄雄性SD大鼠,购于上海实验动物资源中心。大鼠饲养于上海交通大学药学院实验动物中心,饲养级别为清洁级,条件如下:温度(22±2)℃,湿度 55%±5%,光照条件为12/12 h昼夜交替(光照时间为 7:00至 19:00),动物可自由摄取水和食物。实验前,实验动物放置于实验环境适应3 d。实验时,动物随机分组,每组6只,行为学测定时,测定者对实验试剂单盲。大鼠IL-10中和性抗体购于R&D Systems(AF519),大鼠β-内啡肽中和性抗体购于Phoenix Pharmaceuticals.Inc.(H-022-33),CTAP购于Abcam(ab120680)。
1.2 坐骨神经分支选择性损伤模型构建
主要参考Decosterd和Woolf在文献中提出的方法进行手术[9]。将10 d龄性别随机的SD大鼠和33 d龄雄性SD大鼠使用异氟烷气体吸入麻醉,麻醉后大鼠取侧卧位固定,打开手术侧股骨附近皮肤,向下打开股二头肌,暴露坐骨神经及其三个末梢:腓肠神经、腓总神经及胫神经。坐骨神经分支选择性损伤(spared nerve injury,SNI)模型大鼠将腓总神经和胫神经用5-0丝线紧扎,剪除2~4 mm远端神经,最后分两层关闭肌肉和皮肤;假手术大鼠在暴露坐骨神经及其末梢后不进行结扎或剪断,分两层关闭肌肉和皮肤。
1.3 足底机械痛阈值测定
采用von Frey法检测大鼠机械痛阈值。将大鼠放置于金属网架和有机玻璃盒组成的检测架上,待大鼠完全适应环境后,采用连接15号测试纤维(量程0.1~90 g)的电子足底机械痛阈测定仪(IITC Life Science Inc,Woodland Hill,CA,USA)垂直刺激大鼠足底中部。测定时逐渐增加力度,同时观察大鼠是否有缩足反应。记录大鼠产生缩足反应时仪器所显示的作用力值,即为足底收缩阈值(paw withdrawal threshold)。重复测定3次,每次测定之间间隔5 min,3次测定的平均值即为最终机械痛阈值。
1.4 鞘内注射给药
大鼠吸入异氟烷短暂麻醉,用50 μL微量注射器针头自L3-L4间隙穿刺进入蛛网膜下腔进行注射。在大鼠SNI手术后7~9 d连续3 d进行IL-10中和性抗体、β-内啡肽中和性抗体或CTAP鞘内注射,注射完成后1 h进行机械痛阈值测定。
1.5 组织总RNA提取与荧光定量PCR
完成机械痛阈值测定后将动物处死,取脊髓腰膨大处组织用TRIzol(Invitrogen)法进行总RNA提取。提取总RNA后采用微量分光光度计测定所得RNA浓度及A260/A280值,保证A260/A280在1.8~2.0之间以确保RNA纯度。提取所得RNA采用逆转录反应试剂盒(Toyobo)在普通PCR仪(BioRad)中进行逆转录,获得cDNA。
荧光定量PCR采用Mastercyclereprealplex(Eppendorf),按照 RealmasterMix(SYBR Green I;Toyobo)试剂盒提供的反应体系和两步法反应程序进行扩增和荧光定量。所用引物序列如下:5′-CCAAGGTCATCCATGACGAC-3′和 5′-TCCACAGTCTTCTGAGTGGC-3′(GAPDH);5′-GGCTCAGCACTGCTATGTTGCC-3′和 5′-AGCATGTGGGTCTGGCTGACTG-3′(IL-10);5′-CTTTCCGCGACAGAGCCT-3′和 5′-CCAGCTCCACACGTCTATGG-3′(β-内啡肽前体阿黑皮素原,proopiomelanocortin,POMC)。根据荧光定量PCR仪所测定的Ct值[10],以GAPDH作为内参基因,采用2-ΔΔCt方法计算目的基因的相对表达量,其中ΔΔCt=(Ct目的基因-Ct内参基因)处理组-(Ct目的基因-Ct内参基因)对照组。
1.6 数据统计与分析
使用Graphpad Prism 7.0软件进行数据处理统计分析,每个实验组数据以平均值±样本平均数标准误(SEM)表示。采用非配对t-检验、单因素方差分析和双因素重复方差分析分析不同处理组和不同因素下的数据是否有差异。当差异显著时,进一步采用post hoc Student-Newman-Keuls分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 SNI手术引发成年与幼年大鼠机械痛超敏结果
为验证SNI手术能够在成年大鼠中建立稳定的疼痛模型而在幼年大鼠中不能引起明显疼痛反应这一观点,我们分别检测了出生33 d接受SNI手术和出生10 d接受SNI手术大鼠1周后的机械痛阈值,结果如图1所示。出生33 d的成年大鼠在接受SNI手术7 d后,健侧肢机械痛阈值为(22.7±2.6)g,术侧肢阈值下降至健侧的27%(P<0.05;图1A),而出生10 d的幼年大鼠在接受SNI手术7 d后,术侧肢机械痛阈值相比于健侧没有明显变化(图1B)。
2.2 SNI手术诱导幼年大鼠术侧脊髓IL-10和POMC mRNA升高
为了探究成年大鼠和幼年大鼠SNI术后脊髓抗炎因子和内源性阿片样肽的表达情况,我们取SNI手术7 d后的大鼠脊髓腰膨大组织用实时荧光定量PCR方法测定了IL-10及POMC的mRNA表达水平。SNI手术7 d后,成年大鼠术侧脊髓中IL-10 mRNA表达下降至健侧的43%(P<0.05;图1C),而幼年大鼠术侧脊髓IL-10 mRNA表达升高至健侧的180%(P=0.12;图1D);成年大鼠术侧脊髓POMC mRNA表达下降至健侧的81%(P<0.05;图1E),而幼年大鼠术侧脊髓POMC mRNA表达则升高至健侧的240%(P<0.05;图1F)。
2.3 鞘内中和IL-10或β-内啡肽引发幼年大鼠机械痛超敏反应
为探究幼年大鼠脊髓内IL-10和β-内啡肽高表达是否与其不发生机械痛超敏有因果关系,我们在幼年大鼠假手术或SNI造模7 d后,经鞘内注射连续3 d给予生理盐水(10 μL)、IL-10中和性抗体(2 μg/10 μL)或β-内啡肽中和性抗体(1∶5,10 μL),分别在给药前和每天给药后1 h检测幼年大鼠的双侧机械痛阈值,结果如图2。与假手术组相比,SNI手术并未明显影响幼年大鼠术侧的机械痛阈值。在SNI组中,与鞘内注射IL-10抗体或β-内啡肽抗体均不影响健侧机械痛阈值(图2A),但在第2天注射IL-10抗体或β-内啡肽抗体大鼠的术侧机械痛阈值分别下降至当天生理盐水组的34%和36%;第3天注射IL-10抗体或β-内啡肽抗体大鼠的术侧机械痛阈值分别下降至当天生理盐水组的41%和37%(P=0.0001;图2B)。
2.4 鞘内注射CTAP引发幼年大鼠机械痛超敏反应
由于β-内啡肽是μ-阿片受体内源性激动剂[11],我们采用了CTAP进一步验证上述假说。在幼年大鼠SNI手术7 d后,经鞘内注射连续3 d给予生理盐水(10 μL)或CTAP(4 μg/10 μL),分别在给药前和每天给药后1 h检测双侧机械痛阈值。从图3中可以看出,与鞘内注射生理盐水相比,注射CTAP不影响健侧机械痛阈值(图3A),但在注射的第2天术侧机械痛阈值降低至当天生理盐水组的62%;第3天术侧机械痛阈值降低至当天生理盐水组的38%(P<0.0001;图3B)。
2.5 SNI手术引起的幼年大鼠脊髓β-内啡肽表达由IL-10调控
为探究SNI术后幼年大鼠脊髓IL-10和β-内啡肽表达的关系,我们取假手术或SNI术后7 d经过连续3 d鞘内注射生理盐水、IL-10中和性抗体或β-内啡肽中和性抗体幼年大鼠的脊髓腰膨大组织样本,通过实时荧光定量PCR方法检测其IL-10和POMC的mRNA表达。SNI大鼠脊髓IL-10 mRNA表达升高至假手术大鼠的178%(P<0.05)。连续注射IL-10抗体或β-内啡肽抗体均不影响SNI引起的IL-10 mRNA表达升高(图4A)。同时,SNI大鼠脊髓POMC mRNA表达升高为假手术大鼠的169%(P=0.08)。连续注射β-内啡肽抗体不影响SNI引起的POMC mRNA表达升高,但连续注射IL-10抗体则能拮抗这一作用(P=0.08;图4B)。
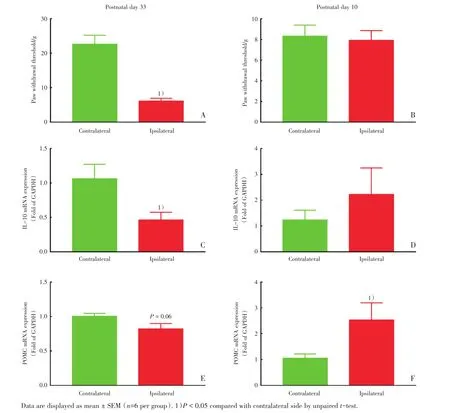
图1 坐骨神经分支选择性损伤手术对成年和幼年大鼠机械痛阈值(A,B),脊髓IL-10(interleukin-10,IL-10)mRNA(C,D)和β-内啡肽前体阿黑皮素原mRNA(E,F)表达的影响Fig.1 Impact of spared nerve injury(SNI)on mechanical paw withdrawal threshold(A and B),interleukin-10(IL-10)mRNA expression(C and D)and POMC mRNA expression(E and F)in infant rats and adult rats
3 讨论
SNI手术可以快速造成成年大鼠机械痛超敏,在手术后2 h即会出现,维持时间达9周以上[9,12],是一种稳定的慢性疼痛动物模型。幼年接受SNI手术的大鼠则会表现出迟发性疼痛,即在手术后4周及以后才出现机械痛超敏[5,13]。本研究证实了成年大鼠术侧后肢机械痛阈值在术后1周后显著低于健侧,而幼年大鼠术后1周术侧后肢机械痛阈值与健侧相比则没有明显变化,即幼年大鼠的神经病理性疼痛处于被抑制的状态。

图2 假手术或SNI手术后连续鞘内注射IL-10中和性抗体或β-内啡肽中和性抗体对幼年大鼠后肢的机械痛阈值的影响Fig.2 Effect of constitutive injections of the IL-10 neutralizing antibody or β-endorphin neutralizing antibody on hindpaws in infants after sham of SNI surgery

图3 假手术或SNI手术后连续鞘内注射μ-阿片受体拮抗剂CTAP对幼年大鼠后肢的机械痛阈值的影响Fig.3 Effect of constitutive injections of the μ-opioid receptor antagonist CTAP on hindpaws in infants rats after sham of SNI surgery
目前很多研究表明成年大鼠在神经病理性疼痛发生后,外周和中枢神经系统发生炎症反应,炎性因子如IL-1β、IL-6、肿瘤坏死因子-α表达升高[14-16],抗炎因子IL-10表达下降[17],小胶质细胞向M1 型转化[3,18],而幼年大鼠在 SNI手术后脊髓小胶质细胞向M2型转化、IL-10 mRNA和蛋白表达量升高[3,5]。本研究证实了SNI术后1周,成年大鼠术侧脊髓与健侧相比IL-10基因表达水平下降,而幼年大鼠的术侧脊髓组织与健侧或假手术组脊髓相比,IL-10基因表达水平明显升高,说明幼年大鼠神经病理性疼痛的抑制与IL-10表达密切相关。
本实验室前期研究发现,内源性和外源性脊髓IL-10的镇痛作用均由小胶质细胞释放β-内啡肽介导[6]。IL-10激动IL-10受体及其下游转录因子STAT3能够促进POMC的转录表达,进而导致β-内啡肽分泌,激动突触后膜μ-阿片受体产生镇痛作用。在本研究中,连续注射IL-10中和性抗体和β-内啡肽中和性抗体均能够在幼年大鼠SNI术侧后肢引发机械痛超敏。同时检测其脊髓的IL-10 mRNA和POMC mRNA表达情况发现,连续注射IL-10中和性抗体能够基本拮抗SNI术后幼年大鼠脊髓中的POMC mRNA基因表达升高,而连续注射β-内啡肽中和性抗体则对IL-10 mRNA的表达没有影响。此结果与我们实验室以前结果相吻合,即IL-10可升高小胶质细胞β-内啡肽表达,而β-内啡肽不影响小胶质细胞 IL-10[6,8]。由此我们认为,在SNI手术后的幼年大鼠体内,IL-10的表达促进了下游β-内啡肽的表达分泌,并由此抑制神经病理性疼痛。
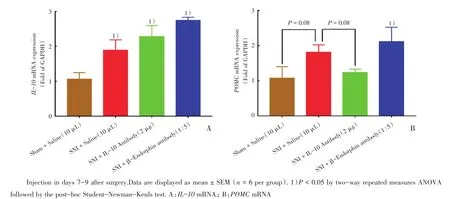
图4 假手术或SNI手术后连续鞘内注射IL-10中和性抗体或β-内啡肽中和性抗体对幼年大鼠脊髓IL-10 mRNA和POMC mRNA表达的影响Fig.4 Effect of constitutive injections of the IL-10 and β-endorphin neutralizing antibodies on the gene expression of IL-10 mRNA and POMC mRNA in infant rats after sham of SNI surgery
β-内啡肽作为一种内源性阿片类物质,具有很强的中枢和外周镇痛作用[19],与μ-阿片受体的亲和力较强[20]。本研究中,鞘内注射μ-阿片受体拮抗剂CTAP能够在幼年SNI大鼠术侧后肢引发机械痛超敏,进一步说明了β-内啡肽在幼年疼痛抑制中发挥的重要作用。另有研究表明,脑脊液β-内啡肽含量会随着年龄增长而降低,1~10岁儿童脑脊液β-内啡肽含量明显高于31~62岁成人[21];血浆β-内啡肽含量较低的幼儿更易发生惊跳反应,运动和感觉能力相较正常幼儿发展缓慢[22],患有孤独症的儿童血浆β-内啡肽水平显著低于正常儿童,对疼痛也更加敏感[23]。因此我们认为,幼儿体内较高的β-内啡肽水平可能是保证其神经正常生长发育的重要因素。
IL-10和β-内啡肽作为具有镇痛作用的重要内源性物质,其在疼痛发生及疼痛治疗中的作用已经被大量研究报道,我们实验室率先发现了两者的上下游关系,从而首次提出IL-10/β-内啡肽通路假说[6-8]。本实验室已发现,GLP-1受体激动剂艾塞那肽能够激活大鼠脊髓小胶质细胞GLP-1受体/IL-10/β-内啡肽信号通路,发挥镇痛作用[7]。在本研究中,SNI手术同样激活了幼年大鼠脊髓的IL-10/β-内啡肽通路,抑制了其神经病理性疼痛的发生,表明脊髓IL-10/β-内啡肽通路可能介导多种生理性和药理性镇痛。
综上所述,本研究分析了幼年大鼠SNI术后的行为学表现以及脊髓IL-10和β-内啡肽基因表达,首次揭示了脊髓IL-10/β-内啡肽通路抑制幼年大鼠SNI诱导的神经病理性疼痛。
