钙荧光白和荧光刀豆蛋白A标记的白念珠菌生长活性和粘附能力
2019-05-30吴晓雁黄家敏黄怀球
张 静,吴晓雁,黄家敏,陆 春,黄怀球
(中山大学1.附属第三医院皮肤性病科,广东 广州 510630;2.孙逸仙纪念医院皮肤性病科,广东 广州 510120)
白念珠菌是系统性念珠菌病的主要致病真菌。钙荧光白(calcofluor white,CFW)和荧光刀豆蛋白A(concanavalin A,Con A)分别结合白念珠菌细胞壁上的几丁质和甘露聚糖,使白念珠菌细胞壁着色,可用于白念珠菌几丁质和甘露聚糖的半定量、几丁质和甘露聚糖在细胞壁的分布、白念珠菌生物膜的标记以及白念珠菌与宿主细胞相互作用的研究[1-4]。既往有研究使用CFW和荧光Con A标记活的白念珠菌后与细胞进行相互作用[5-6]。然而,白念珠菌细胞壁的几丁质和甘露聚糖均为可识别宿主细胞的重要病原相关分子模式(pathogen-associated molecular patterns,PAMP)[7-8],其经荧光标记后的结构变化是否会影响白念珠菌的生长活性和识别粘附细胞的能力?此问题既往尚无研究。因此,本研究通过使用CFW和Alexa Fluor 488-Con A(荧光染料Alexa Fluor 488和Con A结合形成荧光Con A)两种荧光染料标记白念珠菌,并将标记后的白念珠菌分别与巨噬细胞和肠上皮细胞共培养,探讨两种荧光染料对白念珠菌生长活性和粘附能力的影响,以明确在念珠菌和宿主细胞相互作用研究中钙荧光白和荧光刀豆蛋白A是否适用于活念珠菌的标记,为白念珠菌荧光染料的选择提供理论基础。
1 材料与方法
1.1 菌株
本研究使用的菌株为白念珠菌标准株SC5413及19株我院保藏的白念珠菌临床株。将白念珠菌接种于酵母提取物蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)肉汤培养基(BD公司,242820),放置在30℃摇床中孵育过夜。次日,使用PBS缓冲液将白念珠菌细胞清洗3遍,根据实验要求制备不同浓度的菌悬液。
1.2 细胞
巨噬细胞系RAW264.7及肠上皮细胞系caco2,均购于美国模式培养物保藏中心。将RAW264.7细胞接种于含10%小牛血清(Sigma,F2442)的DMEM培养基(Sigma,D6429),放置在体积分数5%CO2的37℃培养箱中培养,细胞长至80%时融合时使用细胞刮轻刮下细胞后传代。将caco2细胞接种于含200 mL/L小牛血清的DMEM培养基中,于含体积分数5%CO2的37℃培养箱中培养。细胞生长至80%融合时使用0.25%EDTA-胰酶(Gibco,25200114)消化后传代。
1.3 CFW及Con A荧光染色
使用血细胞计数板将孵育过夜的白念珠菌悬液调整至(1-5)×106/mL,离心后去除上清液,剩余白念珠菌细胞。CFW染色:根据既往文献[7],取200 μL CFW(1 mg/mL,Sigma,18909)滴于含白念珠菌细胞的EP管内,置于室温下避光孵育1 min,然后使用PBS缓冲液清洗3遍备用。Con A染色:根据既往文献[6],将Alexa Fluor 488-Con A(Invitrogen,C11252)使用PBS稀释至200 μg/mL,取1 mL加入含有白念珠菌细胞的EP管中,于37℃避光孵育30 min。使用PBS缓冲液清洗3遍备用。
1.4 白念珠菌生长活性检测
使用血细胞计数板将孵育过夜的白念珠菌菌悬液调整至(1~5)×106/mL,然后将菌悬液平均分为3组,分别为CFW组、Con A组和未染色的对照组。按照步骤1.3使用CFW对CFW组的菌悬液,使用Alexa Fluor 488-Con A对Con A组的菌悬液进行染色。然后将每组菌悬液稀释1 000倍至(1~5)×103/mL,每组混匀后分别取50 μL菌悬液涂于YPD平板上,置于30℃温箱中孵育。24 h后计数每组YPD平板上的菌落数,将染色组的菌落数与对照组相比较。
1.5 粘附能力检测
1.5.1 巨噬细胞粘附实验 将RAW264.7细胞调整至2×105/mL,接种于24孔板,每孔接种1 mL,设置CFW组、Con A组和对照组,置于含有体积分数5%CO2的37℃培养箱中孵育。按照步骤1.3制备3个组的菌悬液,并使用DMEM重悬菌悬液至1×106/mL。8 h后24孔板中的巨噬细胞已完全贴壁,吸去培养基后使用PBS将细胞清洗3遍,每组中的每孔加入相应的1 mL菌悬液,然后将24孔板置于含有体积分数5%CO2的37℃培养箱中孵育30 min。然后吸去培养基,使用PBS清洗细胞以去除未粘附的白念珠菌细胞。向CFW组、Con A组的样本中加入40 g/L多聚甲醛固定10 min,然后使用PBS清洗3遍备用。将对照组样本固定清洗后再加入体积分数0.1%Triton X-100渗透10 min,然后使用PBS清洗3遍,加入CFW染色1 min后,再次使用PBS清洗3遍备用。
1.5.2 肠上皮细胞粘附实验 将caco2细胞调整至5×104/mL,接种于24孔板,每孔接种1 mL,设置CFW组、Con A组和对照组,置于含有体积分数5%CO2的37℃培养箱中孵育5 d,每隔2 d换液1次。按照步骤1.3制备3个组的菌悬液,并使用DMEM重悬菌悬液至1×106/mL。吸去24孔板中的培养基后使用PBS将细胞清洗3遍,每组每孔加入相应的1 mL菌悬液,然后将24孔板置于含有5%CO2的37℃培养箱中孵育30 min。然后吸去培养基,使用PBS将细胞清洗3遍以去除未粘附的白念珠菌细胞。向CFW组、Con A组的样本中加入40 g/L多聚甲醛固定10 min,然后使用PBS清洗3遍备用。将对照组样本固定清洗后再加入体积分数0.1%Triton X-100渗透10 min,然后使用PBS清洗3遍,加入CFW染色1 min后,再次使用PBS清洗3遍备用。
1.5.3 荧光显微镜检测 将24孔板置于倒置荧光显微镜(日本Olympus IX 71)物镜下拍照。每孔样本拍摄10个400倍高倍视野,同时拍摄白光照片和荧光照片。拍摄荧光照片时,CFW组和对照组均使用紫外线照射,Con A组使用蓝光照射。取10个高倍视野内白念珠菌细胞的平均数为粘附的白念珠菌数目,将染色组的粘附数目和对照组相比较。
1.6 统计方法
实验数据符合正态分布,且3组数据具有方差齐性时,3组之间的数据比较采用单因素方差分析,有统计学意义时,两两比较采用Tukey检验,检验均为双尾,P<0.05差异有统计学意义。实验数据非正态分布或方差不齐时,采用Kruskal-Wallis H检验分析。有统计学意义时,使用Nemenyi法两两比较,检验均为双尾,P<0.05差异有统计学意义。
2 结果
2.1 白念珠菌生长活性
白念珠菌接种于YPD平板后,染色组和对照组均可长出菌落(图1A-C),菌落长出时间约为8 h,3组之间的菌落长出时间无明显差异。CFW组的菌落数目(94.75±19.33)和对照组的(96.80±20.63)相比,无统计学差异(P=0.942;图1D);Con A组的菌落数目(93.85±19.26)和对照组相比,无统计学差异(P=0.885,图1D);CFW组和Con A组的菌落数目亦无统计学差异(P=0.989;图1D)。
2.2 粘附巨噬细胞能力
白念珠菌与巨噬细胞共培养30 min后,在对照组,镜下可见大量白念珠菌粘附在巨噬细胞表面,部分被巨噬细胞吞噬,部分白念珠菌长出菌丝,巨噬细胞呈梭形(图2A-F),单个视野内巨噬细胞个数较染色组减少。共培养后染色组内的巨噬细胞呈圆形并聚集成团状,CFW组白念珠菌未见菌丝长出,Con A组的白念珠菌可见菌丝长出。CFW组的粘附数目45(32~48)和对照组129(134~154)的相比,有统计学差异(P=0.000;图2G);Con A组的粘附数目61(60~70)和对照组相比,有统计学差异(P=0.000;图2G);CFW组和Con A组的粘附数目亦有统计学差异(P=0.000;图2G)。
2.3 粘附肠上皮细胞能力
白念珠菌与肠上皮细胞共培养30 min后,在对照组,镜下可见大量白念珠菌粘附在肠上皮细胞表面,部分被肠上皮细胞内吞。部分白念珠菌长出菌丝,肠上皮细胞连接松散,单个视野内肠上皮细胞的数量较染色组减少。共培养后染色组内的肠上皮细胞连接紧密,CFW组白念珠菌未见菌丝长出,Con A组的白念珠菌可见菌丝长出(图3A-F)。CFW组的粘附数目21(23~37)和对照组60(59~75)的相比,有统计学差异(P=0.000,图3G);Con A组的粘附数目43(40~46)和对照组相比,有统计学差异(P=0.000,图3G);CFW组和Con A组的粘附数目相比亦有统计学差异(P=0.000,图3G)。
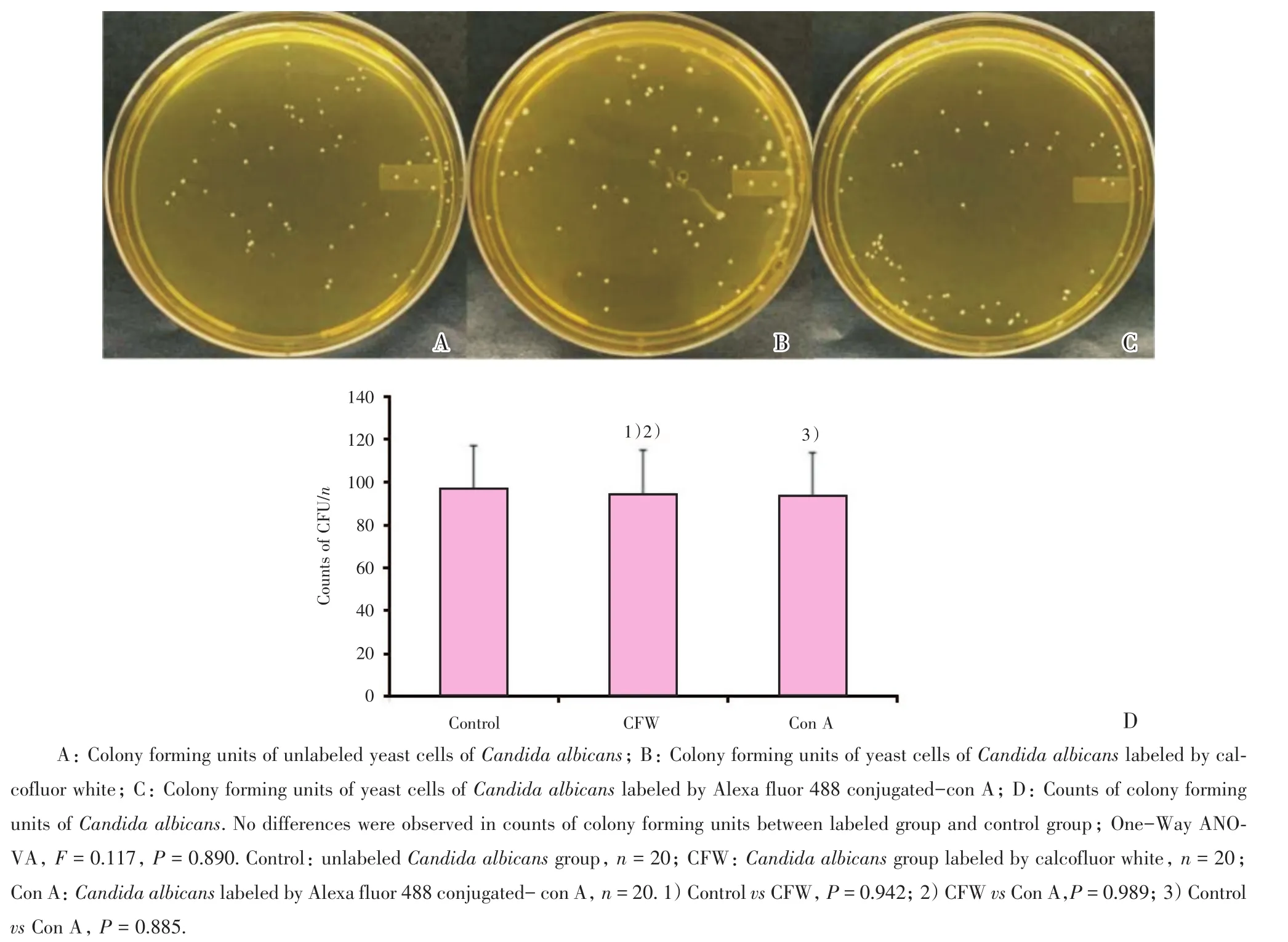
图1 白念珠菌的菌落形成单位Fig.1 Colony forming units of candida albicans

图2 念珠菌与巨噬细胞的粘附Fig.2 Adhesion of candida albicans to macrophages

图3 念珠菌与肠上皮细胞的粘附Fig.3 Adhesion of candida albicans to enterocytes
3 讨论
在人类机体的正常生理环境下,白念珠菌作为一种内源性真菌主要存在于口腔、消化道和阴道等腔道表面;当机体免疫功能低下时,白念珠菌通过粘附腔道的上皮细胞侵入体内,并和体内免疫细胞相互作用,因此本研究选用肠上皮细胞系和巨噬细胞系观察白念珠菌的粘附能力。在本研究中,因CFW仅识别纤维素和几丁质,而巨噬细胞和肠上皮细胞不含纤维素和几丁质,所以使用CFW对固定渗透后的对照组样本染色。CFW仅使白念珠菌着色,在荧光显微镜下可以计数粘附的念珠菌数目。
本研究发现,经CFW染色后的白念珠菌和细胞共培养半小时后未长出菌丝,而对照组白念珠菌则长出菌丝,说明CFW与白念珠菌结合后影响了白念珠菌的正常出芽。既往研究[9]证明CFW与白念珠菌结合后,通过抑制几丁质晶格的形成改变了几丁质在细胞壁的分布和结构,而白念珠菌孢子出芽形成菌丝的过程受几丁质合成酶和几丁质酶合成降解几丁质调控,CFW结合导致的几丁质分布和结构改变可能打破了几丁质合成和降解的平衡,从而影响了白念珠菌的出芽进程。
既往研究已经证实白念珠菌的几丁质是一种PAMP,识别巨噬细胞表面的Toll样受体9(Tolllike receptor 9,TLR9)和甘露聚糖受体,释放IL-10抑制炎症[10],还可阻断dectin-1介导的免疫识别,抑制细胞因子的释放[7]。本研究发现经CFW染色后的白念珠菌对巨噬细胞的粘附能力降低,且共培养半小时后未诱发巨噬细胞分化,我们推测CFW结合几丁质后改变了几丁质的抗原性,进而导致白念珠菌粘附巨噬细胞的能力下降。
本研究发现经荧光Con A染色后的白念珠菌粘附巨噬细胞和肠上皮细胞的能力均下降。甘露聚糖是白念珠菌细胞壁上的重要抗原[11],白念珠菌甘露聚糖可以识别巨噬细胞表面的甘露聚糖受体和TLR4受体启动免疫反应[12],甘露聚糖结合凝集素通过识别TLR2和TLR4启动巨噬细胞的细胞免疫[13],甘露聚糖识别dectin-2诱导TH17细胞分化[14-15];甘露聚糖在体外介导白念珠菌粘附在肠上皮细胞上[16],因此,推测经荧光ConA染色后的白念珠菌粘附细胞的能力减少可能与Con A与甘露聚糖结合后导致其抗原性发生变化有关。表明CFW和荧光Con A标记白念珠菌后不影响其生长活性,可显著降低其粘附巨噬细胞和肠上皮细胞的能力,钙荧光白染色影响白念珠菌的出芽过程。因此,在研究白念珠菌和宿主细胞相互作用时,CFW和荧光Con A不适用于标记活的白念珠菌。
(致谢:衷心感谢乔治城大学李冬梅教授在实验中给予的指导)
