Wnt5a对缺氧复氧导致的心肌细胞氧化损伤的影响
2019-05-21赵丽华尹宏磊吕风华张素荣郭长磊张培勇
赵丽华,尹宏磊,吕风华,张素荣,郭长磊,张培勇
心肌梗死是一种常见的心血管系统疾病,恢复冠状动脉(冠脉)血液流通是治疗心肌梗死的直接途径[1]。恢复冠脉血液流通后有时不仅不能够恢复心脏功能,反而会加重心肌组织损伤,引起心力衰竭,称为心肌缺血再灌注损伤[2,3]。当血液恢复流通后,随着血液流入的氧会引发氧化应激,促进心肌细胞凋亡[4]。Wnt参与细胞分化、增殖、凋亡等生物学过程,属于胞外细胞因子家族,其包含经典Wnt信号通路和非经典Wnt信号通路[5]。经典Wnt信号通路参与心肌缺血再灌注损伤的发生,而对于非经典的Wnt信号通路Wnt5a的研究较少[6]。近年来的研究表明,Wnt5a在心肌缺血再灌注心肌组织中表达上调[7]。本研究以缺氧复氧心肌细胞为研究对象,通过小干扰RNA技术干扰心肌细胞中Wnt5a的表达,探讨Wnt5a对缺氧复氧心肌细胞氧化损伤的影响,以期为探讨Wnt5a在心肌缺血再灌注发病机制中的作用奠定基础。
1 材料与方法
1.1 细胞心肌细胞HCM购自于美国ATCC。
1.2 材料超氧化物歧化酶(SOD)含量检测试剂盒购自于上海贤绵生物科技有限公司;活性氧(ROS)含量检测试剂盒购自于南京建成生物工程研究所;丙二醛(MDA)含量检测试剂盒购自于武汉默沙克生物科技有限公司;二喹啉甲酸(BCA)蛋白定量检测试剂盒购自于美国Thermo;Wnt5a多克隆抗体、辣根过氧化物酶标记的二抗均购自于美国abgent;Wnt5a小干扰RNA(Wnt5a siRNA)和小干扰RNA阴性对照(siRNA control)购自于美国origene;Wnt5a、甘油醛-3-磷酸脱氢酶(GAPDH)引物由南京金斯瑞生物科技有限公司合成;Lipofectamine™ 2000 转染试剂购自于美国Invitrogen;RNA提取试剂盒、反转录试剂盒、RT-PCR试剂盒均购自于碧云天生物技术研究所。
1.3 细胞培养及转染心肌细胞HCM用含有10%胎牛血清的DMEM细胞培养液培养,细胞传代培养用0.25%的胰蛋白酶消化传代,培养条件为:37℃,5% CO2培养箱。心肌细胞融合度达到60%时,用Lipofectamine™ 2000 转染试剂将Wnt5a siRNA和siRNA control转染至HCM细胞中。后续实验中所用细胞均为转染Wnt5a siRNA和siRNA control后培养48 h的HCM细胞。
1.4 缺氧复氧模型构建及实验分组缺氧复氧模型构建:HCM细胞密度达到90%时,将细胞培养液吸除后,加入不含血清的细胞培养液,放在缺氧培养箱中,在缺氧培养箱中充入95% N2,放在37℃恒温箱中缺氧培养5 h。将培养液换成含有10%胎牛血清的细胞培养液,放在37℃,20%O2,5% CO2培养箱中复氧6 h。HCM细胞分为:正常组、模型组、siRNA control组、Wnt5a siRNA组。其中正常组细胞正常培养,模型组、siRNA control组、Wnt5a siRNA组细胞缺氧复氧处理,siRNA control组、Wnt5a siRNA组细胞分别用转染Wnt5a siRNA和siRNA control后48 h的HCM细胞。
1.5 RT-PCR检测转染后细胞中Wnt5a水平正常组、模型组、siRNA control组、Wnt5a siRNA组细胞复氧后,用RNA提取试剂盒提取细胞中的总RNA,紫外分光光度计法检测RNA样品浓度和纯度(在A260/A280的比值为1.8~2.0为最佳)。反转录合成cDNA,步骤参照反转录合成试剂盒。RT-PCR检测Wnt5a的表达水平,内参基因为GAPDH,以Ct法计算Wnt5a表达水平。反应条件为:95℃,10 min;95℃ 15s;60℃ 1 min;95℃15 s;55℃ 1 min,共计40个循环。Wnt5a上游引物为5,-CGGAGATTGTGGATCAGTTC-3’,下游引物5,-GGTTCCAGCTGCAATTCTTG-3’。GAPDH上游引物为5,-AGGGCTGCCTTCTCTTGT GA-3’,下游引物5,-AACTTGCCGTGGGTAGA GTCA-3’。
1.6 Westernblot检测转染后细胞中Wnt5a水平正常组、模型组、siRNA control组、Wnt5a siRNA组细胞复氧后,收集各组细胞,加入裂解液,放置于冰上裂解反应20 min,收集细胞裂解液,14 000 rpm,4℃离心15 min,将蛋白上清液吸取至EP管中,用BCA法对提取蛋白进行定量检测,步骤参照BCA蛋白定量检测试剂盒。将蛋白样品与等体积的2×Loading buffer混合后,在100℃煮沸5 min,使蛋白变性。凝胶电泳:5%浓缩胶,10%分离胶,每孔上样30 μg,90 V恒压电泳。转膜:120 V,4℃转膜70 min。封闭:5%牛血清白蛋白,室温,封闭90 min。结合一抗:1:1000稀释,4℃孵反应过夜。结合二抗:1:2000倍稀释,室温孵育90 min。显色后,以GAPDH为内参,用Photoshop CS3分析目的蛋白表达水平。
1.7 MTT检测细胞增殖活力HCM细胞以1×106个细胞/ml接种到96孔细胞培养板中,按照正常组、模型组、siRNA control组、Wnt5a siRNA组分组处理各组细胞,以不加入细胞的孔为空白组用于调零,每组设置6个复孔。复氧结束后,在每孔中加入20 μl的5 mg/ml的MTT,在37℃反应4 h后,吸除细胞培养液,加入二甲基亚砜溶液150 μl,反应10 min,用酶标仪检测492 nm每孔的光密度值(optical density,OD值),计算分析细胞存活率。以正常组为对照,分别以模型组、siRNA control组、Wnt5a siRNA组为实验组。细胞存活率=100%×(实验组OD值-空白组OD值)÷(对照组OD值-空白组OD值)
1.8 流式细胞术检测细胞凋亡正常组、模型组、siRNA control组、Wnt5a siRNA组细胞复氧结束后,收集各组细胞,调整细胞浓度为每毫升含有106个细胞,加入冰预冷的磷酸盐缓冲液(PBS)重悬洗涤细胞2次后,1000 rpm离心10 min,在细胞中加入100 μl的结合缓冲液,混匀后,依次加入5 μl的膜联蛋白 V-FITC(Annexin V-FITC)和碘化丙啶(PI)5 μl,放在避光条件下室温结合15 min,加入400 μl的结合缓冲液,流式细胞仪检测细胞凋亡情况。
1.9 MDA、SOD、LDH水平检测正常组、模型组、siRNA control组、Wnt5a siRNA组细胞复氧结束后,收集各组细胞和培养液上清。用二硝基苯肼显色法检测培养液上清中LDH水平。用黄嘌呤氧化法检测细胞中SOD水平。硫代巴比妥酸比色法检测细胞中MDA水平。
1.10 统计学处理所得的实验数据均采用SPSS 22.0统计学软件分析,计量资料以均数±标准差(±s)表示,两组间比较用t检验,以P<0.05作为差异具有统计学意义。
2 结果
2.1 转染后细胞中Wnt5a表达检测结果正常组、模型组、siRNA control组、Wnt5a siRNA组Wnt5a mRNA水平依次为:0.26±0.04、1.34±0.12、1.32±0.13、0.51±0.08,蛋白水平依次为:0.11±0.02、1.05±0.06、1.06±0.07、0.18±0.04。模型组Wnt5a mRNA和蛋白水平均明显高于正常组,差异具有统计学意义(P<0.05)。siRNA control组Wnt5a mRNA和蛋白水平与模型组相比差异没有统计学意义(P>0.05)。Wnt5a siRNA组Wnt5a mRNA和蛋白水平均明显低于模型组,差异具有统计学意义(P<0.05)(图1,表1)。缺氧复氧后心肌细胞中Wnt5a表达升高,而Wnt5a siRNA能降低缺氧复氧心肌细胞中Wnt5a的表达。
2.2 细胞增殖活力检测结果正常组、模型组、siRNA control组、Wnt5a siRNA组细胞存活率依次为:(100.00±8.36)%、(62.58±7.25)%、(63.47±6.32)%、(86.32±7.94)%。模型组细胞存活率明显低于正常组,差异具有统计学意义(P<0.05)。siRNA control组细胞存活率与模型组相比差异没有统计学意义(P>0.05)。Wnt5a siRNA组细胞存活率明显高于模型组,差异具有统计学意义(P<0.05,表2)。缺氧复氧能够抑制心肌细胞增殖活力,而干扰Wnt5a表达能够拮抗缺氧复氧对心肌细胞增殖抑制作用。
2.3 细胞凋亡检测结果正常组、模型组、siRNA control组、Wnt5a siRNA组细胞凋亡率依次为:(4.02±0.85)%、(26.47±1.56)%、(25.39±1.68)%、(14.58±1.02)%。模型组细胞凋亡率明显高于正常组,差异具有统计学意义(P<0.05)。siRNA control组细胞凋亡率与模型组相比差异没有统计学意义(P>0.05)。Wnt5a siRNA组细胞凋亡率明显低于模型组,差异具有统计学意义(P<0.05)(图2,表3)。缺氧复氧能够诱导心肌细胞凋亡,干扰Wnt5a表达后能够抑制缺氧复氧诱导的心肌细胞凋亡。
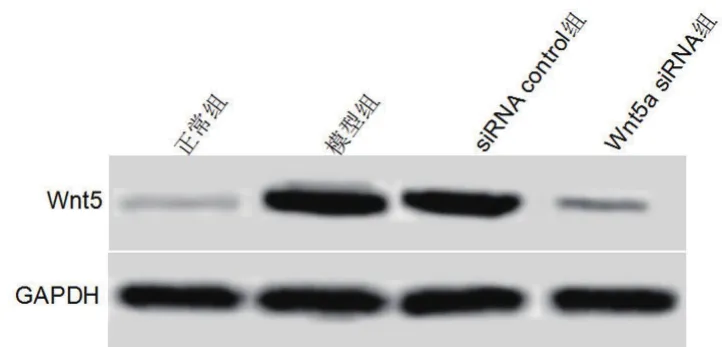
图1 Western blot检测细胞中Wnt5a表达水平
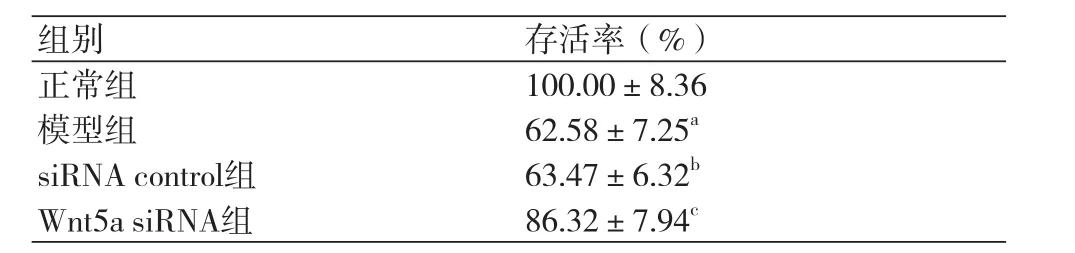
表2 细胞存活率

图2 流式细胞术检测细胞凋亡

表3 细胞凋亡率
2.4 MDA、SOD、LDH水平检测结果正常组、模型组、siRNA control组、Wnt5a siRNA组MDA水平依次为:(0.96±0.13)nmol/mg、(2.85±0.36)nmol/mg、(2.87±0.25)nmol/mg、(1.92±0.14)nmol/mg,SOD水平依次为:(168.95±11.64)U/mg、(104.46±13.26)U/mg、(103.82±12.87)U/mg、(127.74±10.91)U/mg,LDH水平依次为:(21.85±1.94)U/L、(93.26±7.65)U/L、(94.69±8.97)U/L、(56.33±2.57)U/L。模型组细胞中MDA和培养液上清中LDH水平均明显高于正常组,而细胞中SOD水平明显低于正常组,差异均具有统计学意义(P<0.05)。siRNA control组细胞中MDA、SOD水平及培养液上清中LDH水平与模型组相比差异没有统计学意义(P>0.05)。Wnt5a siRNA组细胞中MDA和培养液上清中LDH水平均明显低于模型组,而细胞中SOD水平明显高于模型组,差异均具有统计学意义(P<0.05,表4)。缺氧复氧能导致心肌细胞氧化损伤,干扰Wnt5a表达能够减弱缺氧复氧对心肌细胞的氧化损伤。
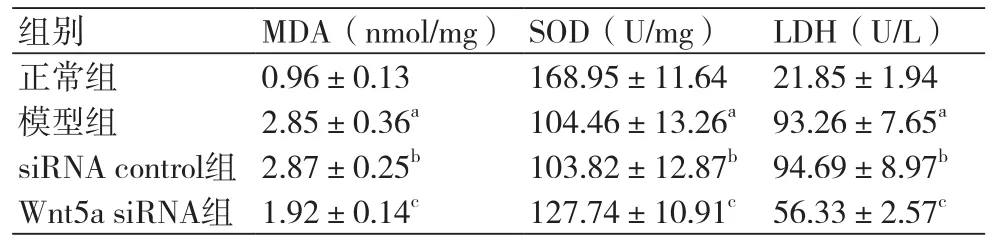
表4 MDA、SOD、LDH水平
3 讨论
Wnt是一个高度保守的由富含半胱氨酸的糖蛋白组成的胞外信号系统,参与胚胎发育,与细胞的生长、凋亡等有关[8]。研究表明,Wnt与人体神经系统疾病、肿瘤发生、心肌肥厚、糖尿病心肌病、心肌梗死等有关,Wnt5a是非经典Wnt信号通路,参与心肌缺血发生过程,在心肌缺血再灌注中表达上调[9-12]。有研究表明,Wnt5a能够增加斑马鱼胚胎细胞中钙离子的浓度,增加Wnt5a细胞表面受体表达后的斑马鱼细胞释放的钙离子增加[13]。而心肌缺血再灌注损伤的发生与钙超载有关,而钙超载后会破坏细胞氧化平衡状态,导致细胞膜通透性发生改变,导致细胞凋亡[14]。周珊珊[15]的研究表明,Wnt5a表达下调后,缺氧复氧心肌细胞中钙离子浓度降低。这些研究均说明,Wnt5a参与缺氧复氧心肌细胞损伤过程。本研究结果显示,缺氧复氧后的心肌细胞中Wnt5a mRNA和蛋白水平表达升高,这与之前的研究报道相符合,均说明Wnt5a可能参与心肌缺血再灌注损伤发生。
心肌细胞凋亡是心肌缺血再灌注损伤的重要组成部分。有研究表明,大鼠心肌缺血45 min后再灌注2 h,心肌细胞凋亡率升高约20倍[16]。本研究结果显示,缺氧复氧后的心肌细胞增殖活力明显下降,细胞凋亡率明显升高,而Wnt5a表达下调后的心肌细胞经过缺氧复氧处理后细胞凋亡率较单纯缺氧复氧处理的心肌细胞凋亡率有所减少。
正常情况下,细胞内氧化系统和抗氧化系统能够维持机体正常的氧化平衡状态。当组织细胞中氧自由基不能及时清除,导致氧自由基在组织内聚集,引起脂质过氧化,损坏细胞膜通透性,进而引起细胞凋亡发生[17,18]。LDH是存在于细胞质内的一种糖酵解酶,当细胞通透性发生改变时,细胞内的LDH泄露,而MDA是脂质过氧化的产物之一,检测细胞培养液上清中LDH水平和细胞中MDA水平可以间接反映细胞膜的完整性和细胞氧化应激损伤程度[19]。SOD是细胞内氧自由基的清除剂,能够将氧自由基催化生成过氧化氢[20]。本研究结果显示,缺氧复氧后的心肌细胞中MDA水平升高,细胞中SOD水平下降,培养液上清中LDH水平升高,而Wnt5a表达下调能够抑制缺氧复氧对心肌细胞的这一作用。这提示,Wnt5a表达下调能够降低缺氧复氧对心肌细胞的氧化损伤。
综上所述,缺氧复氧能够诱导心肌细胞氧化损伤,促进心肌细胞凋亡,而干扰Wnt5a表达能够减轻缺氧复氧引起的心肌细胞氧化损伤,减少心肌细胞凋亡。本研究进一步探讨Wnt5a在心肌缺血再灌注损伤发病机制中的作用奠定了基础。本研究存在一定的局限性,只在体外初步探讨了Wnt5a在心肌缺血再灌注损伤中的作用,后续试验中会在体内进一步探讨Wnt5a在心肌缺血再灌注损伤中的作用,并会对Wnt5a的具体作用就机制进行深入研究。
