TaqMan-MGB探针实时荧光PCR法检测T细胞受体重排删除环评估慢性乙型肝炎患者胸腺近期输出功能①
2019-05-15潘克女张永乐左中宝刘寿荣
潘克女 张永乐 张 钧 左中宝 俞 哲 刘寿荣
(浙江大学医学院附属邵逸夫医院检验科,杭州310016)
乙型肝炎病毒(Hepatitis B virus,HBV)感染的发病机制十分复杂,其发展和预后主要取决于宿主的免疫状态。在乙肝病毒感染的过程中,病毒本身并不会直接引起肝细胞损伤,而是宿主免疫系统的抗病毒免疫应答导致肝细胞损伤和各种肝脏疾病的发生。在宿主免疫应答过程中,T淋巴细胞亚群失衡可能是导致乙型肝炎慢性化过程中的主要原因,胸腺是机体的中枢免疫器官,是T细胞发育、分化、成熟的场所,因此在乙型肝炎慢性化发生、发展及预后的过程中胸腺功能都具有极其重要的意义[1]。本文采用TaqMan-MGB双标记探针技术建立实时荧光定量PCR方法检测外周血中TRECs的含量。并将此技术应用于检测慢性乙型肝炎(CHB)患者PBMCs中TRECs的含量,进而了解CHB患者的胸腺近期输出功能,并分析TRECs含量在健康人群与CHB患者中的差异,现报告如下:
1 资料与方法
1.1资料
1.1.1研究对象 45例慢性乙型肝炎中型患者为2016年9月~2017年6月在杭州市西溪医院就诊的住院患者,其中男35例,女10例,年龄最小25岁,最大45岁,平均38.51岁。慢性乙型肝炎诊断标准符合2015更新版《慢性乙型肝炎防治指南》[2],排除其他型肝炎及肝损伤的相关疾病。35例健康人群为2017年职工体检人群,排除各种引起肝损伤的相关疾病。
1.1.2仪器与试剂 型号SLAN-96实时荧光定量PCR仪购自上海宏石公司,高速冷冻离心机以及连续可调移液器购自德国Eppendorf公司。实时荧光定量PCR试剂中Buffer、DNTP、Mg2+、Taq酶等基础原料购自TaKaRa Biotec;引物,探针由上海生工生物技术有限公司合成;外周淋巴细胞分离及核酸抽提试剂购自广州蓝吉生物科技有限公司。
1.2方法
1.2.1标本处理 取EDTA抗凝血1 ml,用等体积的PBS进行稀释后,轻轻转入2 ml的淋巴分离液中(沿管壁轻轻转入,使稀释全血完全浮于淋巴分离液之上),采用水平冷冻离心机2 500 r/min离心15 min,吸取中间云雾状漂浮物置于5 ml离心管,加 2 ml的PBS,12 000 r/min离心10 min弃上清,重复洗涤4次。将沉淀调成溶液,取溶液10 μl滴入计数板,在显微镜下计数细胞数量,将溶液中的细胞数量稀释为1×106个/ml。采用QiagenMini Blood min柱提试剂盒,具体操作:取200 μl调整好的细胞溶液中加入20 μl蛋白酶K和200 μl细胞裂解液(Cell lysis solution),充分混匀后,56℃水浴10 min,取出加入无水乙醇200 μl充分混匀后全部转入带滤膜的柱中10 000 r/min离心2 min,弃废液,向柱中加入预配好的DW1洗液600 μl,再次10 000 r/min离心2 min,弃废液,向柱中加入预配好的DW2洗液600 μl,离心10 000 r/min,2 min;将柱转入洁净离心管中10 000 r/min离心5 min,弃离心管,更换另一洁净离心管将柱置入,开盖室温放置5 min,使残余酒精充分挥发后,向柱中加入50 μl GE洗脱液(注意洗脱液加入膜的中间,但禁止移液枪头接触膜),关盖室温放置5 min,10 000 r/min离心2 min,收集总DNA备用。
1.2.2引物设计 根据TCRδ基因序列(ACCESS-ION AE000661)中δRec基因片段的下游设计一条上游引物P1 5′-CACATCCCTTTCAACCATGCT-3′,同时在ΨJɑ的上游设计一条下游引物P2 5′-GCCAGCTGCAGGGTTTAGG-3′ 在扩增片段中设计一条5′端标记FAM荧光在3′端标记MGB荧光的双荧光探针5′-FAM-ACACCTCTGGTTTTTGTAAAGGTGCCCACTMGB-3′。该引物的设计与一般的PCR 引物相反,因为TRECsDNA在δRec 和ψJα的两个基因片段删除重组形成一环状DNA,所以设计引物时特别考虑这一特点,只有形成了DNA 环,才能扩增出相应产物。
1.2.3实时荧光定量PCR检测TRECs反应体系的配比及扩增条件 Buffer 5 μl,4 mmol/L的MgCl21 μl,Taq酶1.5 U 1 μl,dNTP 0.2 mmol/L 4 μl,0.5 μmol/L的上游引物下有引物各1 μl,0.1 μmol/L的荧光探针1 μl,ddH2O 31 μl,模板5 μl合计50 μl。扩增程序为:37℃ 5 min,95℃3 min,95℃15 s,60℃ 45 s运行45个循环,分析结果。
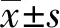
2 结果
2.1TaqMan-MGB双标记探针PCR定量方法性能评价
2.1.1反应体系的特异性和准确性 经过多次调试最终完成了实时荧光双探针标记的PCR反应体系,对含目的基因的反应体系在扩增45个循环后会出现光滑完整的“S”型动力曲线,对不含目的基因的反应体系表现为平直曲线;特异性:采用该反应体系对已确认阳性的解脲支原体DNA,沙眼衣原体DNA,疱疹病毒2型DNA,淋球菌DNA(UUDNA,CTDNA,HSV2DNA,NGDNA)以及HBVDNA各5例进行检测结果均显示阴性(所有对比标本均采用中山大学达安基因股份有限公司生产的商品化试剂盒进行确认阳性的标本)。准确性:采用该体系经行PCR检测产物在2%的琼脂糖电泳里125 bp处出现明显扩增条带,该条带与预期产物量一致,7号带为阴性对照无条带见图1,并对1~6号标本产物进行基因测序验证结果与目的基因序列完全吻合。
2.1.2灵敏度 根据ISO15189试剂和性能验证的方案我们对5×105copies的质粒进行10倍法稀释到50 copies,并进行20次检测最终有19例被检出,检出率95%,因此可判定最低检出限可达50 copies,结果见图2。

图1 TRECs real-time PCR 产物电泳图Fig.1 Electrophoresis diagram by TRECs real-time PCRNote:M.50 bp DNA Ladder;1.Plasmid standard;2-6.Samples;7.Negative.

图2 TRECs反应体系灵敏度实验图Fig.2 Experimental map of TRECs
2.1.3重复性 对6.18 Lg copies/106PBMCs和3.54 Lg copies/106PBMCs高低浓度标本同一批次进行25次检测结果平均值为6.08±0.14,3.52±0.18 Lg copies/106PBMCs批内变异系数CV分别为2.26%,5.12%,对这两份标本连续5 d重复20次试验结果平均值为6.10±0.23,3.51±0.22 Lg copies/106PBMCs批间变异系数CV分别为3.85%,6.27%。批内,批间CV均小于10%表明该方法具有较高的重复性,数据见图3、4,表1。
2.1.4标准曲线参数 对标准质粒进行10倍稀释后扩增所得扩增曲线见图5,斜率-3.038 86,线性相关系数为r=0.999 33,纵截距为39.056。
2.2健康对照者与慢性乙型肝炎中型患者TRECs含量的比较 35例健康对照和45例慢型乙肝炎中型患者的外周血TRECs经PCR定量检测结果 35例健康成人的外周血TRECs平均含量为4.82±1.28 Lg copies/106PBMCs,45例慢性乙型肝炎中型患者外周血TRECs平均含量为4.09±0.97 Lg copies/106PBMCs,两者比较存在统计学差异t=11.25,P<0.05,结果见图6。

图3 低浓度标本25次重复实验验证Fig.3 Low concentration specimen 25 repeated experi-mental verification

图4 高浓度标本25次重复实验验证Fig.4 High concentration specimen 25 repeated experi-mental verification

图5 TRECs real-time PCR标准曲线定量图Fig.5 Standard curve diagram of TRECs real-time PCR
表1 6.18与3.54 Lgcopies/106PBMCs高低浓度标本批内差异分析
Tab.1 Difference between within-run of 6.18 and 3.54 Lg copies/106PBMCs

No.Within-runHighLow 16.253.72 26.033.6635.973.0246.253.5156.273.6165.983.5676.303.6686.183.6296.343.52105.943.62115.963.62126.053.66136.303.51145.963.29156.083.35166.043.37176.073.49185.943.65196.123.65206.073.51215.963.22225.873.71236.123.63246.033.18255.953.60AVG6.083.52SD0.140.18CV%2.265.12
Note:AVG.Average;SD.Standard deviation;CV.Coefficient of variation.

图6 慢性乙型肝炎中型(CHB M)及健康对照(HCS)组间TRECs含量比较(Lg copies/106PBMC)Fig.6 Determination results of TRECs in patients with CHB and HCS(Lg copies/106PBMC)
表2 6.18与3.54 Lg copies/106PBMCs高低浓度标本批间差异分析
Tab.2 Difference between-run of 6.18 and 3.54 Lg copies/106PBMCs

TimeNo.Between-runHighLow 1st day16.033.3526.293.7936.013.7545.573.2155.683.342nd day66.313.5275.963.5086.513.7295.913.18105.993.863rd day115.973.84126.023.41136.283.39146.003.61156.383.404th day166.003.54176.343.10186.243.56196.213.41206.253.64AVG6.103.51SD0.230.22CV%3.856.27
Note:We made a statistical analysis of results from 20 repeated experiments,which were performed 5 times a day for 4 consecutive days.AVG.Average;SD.Standard deviation;CV.Coefficient of variation.
3 讨论
胸腺是机体中枢免疫器官,约有90%成熟T细胞受体(T-cell receptor,TCR)细胞来源于胸腺,早期胸腺是T淋巴细胞分化、发育、成熟的主要场所,随着年龄的增长胸腺的这一功能逐渐减弱,尽管胸腺输出功能与年龄呈负相关,但近年的研究表明,成人胸腺仍持续产生初始的、新分化的T细胞输送至外周[3]。研究发现人免疫缺陷病毒(Human immunod-eficiency virus,HIV)感染者较健康人群胸腺功能有所降低[4]。HIV感染后经过高效抗逆转录病毒治疗(HAART)以及白血病经造血干细胞移植后,胸腺功能较治疗前都有明显改善[5,6]。所以人们认为,胸腺功能的检测是研究免疫功能、免疫缺陷及细胞免疫重建等相关疾病的重要手段。T细胞由多能干细胞发育分化而来,包括了TCR的发育及T细胞的阳性与阴性选择以及发育为成熟T细胞。而TCR的成熟过程需要经过一系列基因有序表达和关闭,基因重排是其中最重要的一步,在重排过程中δ链基因的删除70%是通过位于δ链基因座两侧的δRec和ψJα两个删除片段的特异重组形成DNA而删除,该DNA环即T细胞受体重排删除环(TRECs)[7],是TCR基因重排过程中产生的、性质稳定的环形游离DNA,出现在胸腺T细胞分化的晚期,在T细胞增殖过程中不能复制,而是逐渐被稀释。功能性TCR重排完成后,αβTCR即表达在T细胞表面,TRECs只存在于具有初始表型的αβT细胞,而外周血95%以上的T细胞为αβT细胞,所以外周血单个核细胞TRECs含量基本上代表了TCR基因初始重排形成功能性TCR基因时的初始或幼稚T细胞的含量[8,9]。国外学者利用TRECs含量来评价肾移植后合并巨细胞病毒感染者的免疫状况[10]。因此TRECs用于评价胸腺近期输出功能已被广泛接受,然而选择合适的检测方法显得至关重要。
目前实时荧光定量PCR技术中,TaqMan探针法是最常用且最有应用前景的方法,现已开发了多种商品化试剂盒应用在病毒、细菌、病原微生物等方面。TaqMan-MGB双标记探针定量技术属于TaqMan探针的一种,MGB探针的淬灭基团采用非荧光淬灭基团本身不产生荧光可以大大降低本底信号的强度,同时探针上还连接有MGB(Minor Groove Binder)修饰基团可以将探针的Tm值提高10℃左右。因此在同样的Tm值时MGB探针可以比普通TaqMan探针设计得更短,既降低了合成成本,也使得探针设计的成功率大为提高。通常在模板的DNA碱基组成不理想的情况下,对探针的设计要求极高,探针长度相应缩短,此时MGB探针更容易胜任。在实验过程中该技术产生荧光本底低,分辨率高,使实验结果更精确,特异性增强,更适合模板数量低的检测。谭翰清等[11]采用该技术对H5N6禽流感进行定量检测,沈维祥等[12]利用TaqMan-MGB技术检测幽门杆菌耐药突变,两位学者的实验均取得较好的结果,他们也认为该技术特异性强,灵敏度高具有较好的推广应用前景。
本研究通过多次实验成功建立了实时荧光TaqMan-MGB探针技术检测TRECs含量。通过电泳我们发现在125 bp处出现明显扩增条带,该条带与预期产物量一致,无杂带出现且阴性对照无条带。通过对质粒进行10倍稀释建立标准品,利用该体系检测标准品其曲线斜率为3.038 86,符合PCR扩增理论中的浓度相差10倍扩增原始增长点相差3.333个循环;相关性为0.999 33,说明该体系有较高的稳定性。对高低浓度标本进行同次25次复孔实验和分批20次试验后进行统计变异系数均小于10%,更能体现该体系的稳定性。对质粒进行10倍稀释直到50 copies时复孔20次实验19孔检出,检出率95%,说明该体系的灵敏度可达50 copies。对多种病原体DNA进行交叉试验,均未检出阳性曲线,说明该体系具有较高的特异性。近期国外学者也采用实时荧光定量PCR技术建立了TRECs检测方法用来评价新生重症免疫缺陷的免疫功能[13],本研究的荧光探针采用TaqMan-MGB,从扩增曲线上看曲线更为光滑,结果更为可靠。
笔者对45例慢性乙肝肝炎感染的成人和35例同年龄段的健康人群采用TaqMan-MGB探针法进行定量分析外周血中TRECs含量,结果发现健康成人的外周血TRECs平均含量为4.82±1.28 Lg copies/106PBMCs,慢性乙型肝炎患者外周血TRECs平均含量为4.09±0.97 Lg copies/106PBMCs,两者比较差异存在统计学意义,慢性乙型肝炎感染人TRECs含量低于健康人群,说明慢性乙型肝炎感染人群的胸腺近期输出功能是降低的,这一结论与慢性乙型肝炎的免疫功能下降理论相一致[14]。与马旭明等[15]报道急性冠脉综合征患者与健康人间TRECs含的结论一致,他们研究表明急性冠脉综合征患者胸腺近期输出功能显著低于健康人群,认为TRECs含量能够用于评价机体近期免疫功能。
综合实验结果,笔者认为实时荧光TaqMan-MGB探针定量PCR测定外周血中TRECs含量方法的建立,为评判胸腺近期输出功能提供新的诊疗手段,弥补了初期通过B超技术测量胸腺大小来判断胸腺功能的不足。该方法简单、快速、灵敏度高和特异性强的特点值得临床推广。尤其是如今对慢性乙型肝炎免疫调节治疗的疗效观测或是对核苷酸类药物抗病毒治疗停药后患者免疫状态的改变监测都具有重要意义。