RNA干扰HAS2基因表达对多囊卵巢综合征大鼠卵巢颗粒细胞生物学特性及免疫因子的影响
2019-05-15徐鸿婕孙勤国
徐鸿婕 孙勤国
(武汉市第三医院中医科,武汉430000)
多囊卵巢综合征(Polycystic ovary syndrome,PCOS)是一种在育龄妇女中常见的内分泌生殖疾病,患者表现为胰岛素抵抗、雄激素过多、持续无排卵等,近年的发病率呈现上升趋势,确切的病因尚未明确[1]。有研究指出,卵泡内颗粒细胞异常地增殖及凋亡可能是PCOS患者多个卵泡同时发育的病理基础[2]。因此,研究影响卵巢颗粒细胞增殖凋亡的机制具有重要意义。透明质酸合成酶2(Hyaluronan synthetase 2,HAS2)是透明质酸(Hyaluronan,HA)的一种异构体,其过表达可引起透明质酸的过度分泌,有研究资料显示,在小鼠卵母细胞成熟过程中HAS2基因会伴随卵丘扩张而表达升高,抑制HAS2可增强卵巢颗粒细胞的凋亡[3,4]。这提示HAS2可能影响PCOS的发生发展。在本研究中首先检测了HAS2在PCOS中的表达,并将干扰HAS2的siRNA转染到PCOS大鼠卵巢颗粒细胞中,观察细胞的增殖及凋亡情况,并研究潜在的分子机制,以期为PCOS的治疗提供理论依据。
1 材料与方法
1.1材料 DMEM/F12培养基、胰蛋白酶、胎牛血清均购自美国Gibco;BCA试剂盒、CCK8试剂盒均购自碧云天;LipofectamineTM2000转染试剂购自美国Invitrogen;HAS2、TGF-β1、VEGF、p-NF-κB、p-IκB、cyclin D1和survivin抗体均购自美国CST;Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基;注射用脱氢表雄酮(Dehydroepian drosterone,DHEA)购自湖北远成药业公司;酶标仪购自美国Bio-Rad;流式细胞仪购自美国BD。
1.2方法
1.2.1PCOS大鼠模型卵巢组织采集 SPF级雌性SD大鼠购自武汉大学动物实验中心,21日龄,共30只。将大鼠适应性饲喂2 d,随机分为对照组和实验组,每组15只。PCOS模型建立:大鼠持续肌肉注射DHEA(6 mg/100 g体重)及注射用油0.2 ml,共注射21 d,对照组在此期间仅注射0.2 ml的注射用油。注射DHEA第21天,将大鼠禁食12 h后称重,摘取卵巢组织,备用。
1.2.2Western blot检测两组卵巢组织中HAS2的表达 卵巢组织中加入适量的裂解液提取组织总蛋白,BCA试剂盒检测总蛋白浓度,取50 μg总蛋白上样,经12%的SDS-PAGE、电转PVDF膜、5%脱脂奶粉封闭膜,加入1∶500稀释的HAS2抗体及1∶1 000 稀释的内参GAPDH抗体,4℃摇床孵育过夜,洗膜,加入HRP标记的二抗(1∶5 000稀释),37℃摇床孵育1 h,洗膜,ECL发光剂显色,洗片后进行显影和定影。以GAPDH为内参,以HAS2与GAPDH的灰度比值作为HAS2的蛋白相对表达量。
1.2.3卵巢颗粒细胞的获取 在雌性大鼠于DHEA干预21 d后,DHEA诱导大鼠及空白对照组大鼠分别断颈处死,获取卵巢器官。在解剖镜下用注射器刺破卵巢上的卵泡,使颗粒细胞释放出来。用移液器吸取颗粒细胞,使用含15%胎牛血清的DMEM培养液清洗3次后,于37℃,5%体积分数的CO2培养箱中预培养 24 h。
1.2.4分组及siRNA转染 将卵巢颗粒细胞分为空白组(Control组)、PCOS大鼠模型卵巢颗粒细胞分成阴性对照组(NC组)和si-HAS2组。NC组和si-HAS2组分别转染合成的无干扰作用的siRNA及靶向抑制HAS2的特异性siRNA,转染前24 h以每孔2×105个细胞的数量将生长至对数期的卵巢颗粒细胞接种于6孔板,细胞生长密度达90%以上时,参照LipofectamineTM2000转染说明进行转染。收集转染48 h的细胞,Western blot检测各组细胞中HAS2的蛋白表达。
1.2.5CCK8检测细胞活力 以每孔2 000个细胞接种生长至对数期的卵巢颗粒细胞于96孔板,细胞生长融合达50%时,按照上述分组转染,每组设置5个重复孔,转染48 h后每孔细胞中加入10 μl CCK8,37℃孵育4 h,450 nm波长,酶标仪检测光密度(OD)值。实验重复3次。
1.2.6流式细胞仪检测凋亡 采用Annexin V-FITC/PI双染法,以每孔1×105个细胞的数量接种卵巢颗粒细胞于6孔板的培养皿,细胞生长融合达80%时,无血清培养细胞24 h,按照上述分组转染,转染后48 h,胰酶消化细胞,制备成细胞悬液,离心后重悬细胞,加入Annexin V-FITC和PI各5 μl,混匀,避光反应1 h内,流式细胞仪进行凋亡检测。实验重复3次。
1.2.7TGF-β1、VEGF、p-NF-κB、p-IκB、cyclin D1和survivin蛋白表达检测 参照1.2.2方法。
2 结果
2.1HAS2在PCOS大鼠卵巢组织的表达 建立PCOS大鼠模型,取出卵巢组织,Western blot检测卵巢组织中HAS2蛋白表达,结果如图1所示,对照组及PCOS组卵巢组织中HAS2的蛋白表达分别为0.069±0.008、0.556±0.043,HAS2在PCOS中的表达显著高于对照组(P<0.05)。
2.2si-HAS2转染大鼠卵巢颗粒细胞的效果 各组转染si-HAS2的细胞中HAS2的蛋白表达结果如图2所示,对照组、NC组及si-HAS2组HAS2的蛋白表达分别为0.458±0.046、0.471±0.049和0.103±0.011,si-HAS2组HAS2的表达显著低于对照组(P<0.05),而NC组HAS2的表达与对照组差异无统计学意义(P>0.05)。
2.3si-HAS2转染对大鼠卵巢颗粒细胞活力及凋亡的影响 si-HAS2转染大鼠卵巢颗粒细胞48 h后,细胞活力及凋亡率的检测结果显示,与NC组比较,si-HAS2组细胞活力显著降低(P<0.05),凋亡率升高(P<0.05),见表1、图3。
2.4si-HAS2转染对大鼠卵巢颗粒细胞免疫因子表达的影响 Western blot检测各组细胞中免疫抑制因子TGF-β1和VEGF的蛋白表达,结果如图4和表2所示,与NC组比较,si-HAS2组TGF-β1和VEGF的蛋白表达均显著降低(P<0.05)。
2.5si-HAS2转染对大鼠卵巢颗粒细胞NF-κB信号通路的影响 各组细胞中NF-κB信号通路p-NF-κB、p-IκBα及下游cyclin D1和survivin的蛋白表达结果如图5和表3所示,与NC组比较,si-HAS2组p-NF-κB、p-IκBα、cyclin D1和survivin的蛋白表达均显著降低(P<0.05)。

图1 HAS2在PCOS和对照大鼠卵巢组织的表达Fig.1 Expression of HAS2 in ovarian tissue of PCOS and control rats

图2 si-HAS2转染大鼠卵巢颗粒细胞后HAS2的蛋白表达Fig.2 Protein expression of HAS2 after transfected si-HAS2 in rat ovarian granulosa cells
表1 si-HAS2转染对大鼠卵巢颗粒细胞活力及凋亡的影响
Tab.1 Effect of si-HAS2 transfection on vitality and apoptosis of rat ovarian granulosa cells
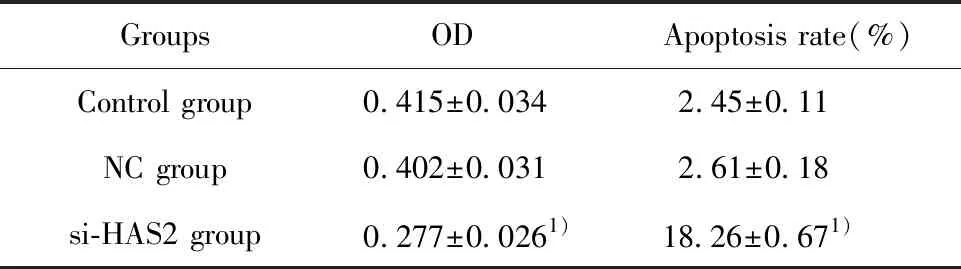
Groups ODApoptosis rate(%)Control group0.415±0.0342.45±0.11NC group0.402±0.0312.61±0.18si-HAS2 group0.277±0.0261)18.26±0.671)
Note: Vs NC group,1)P<0.05.
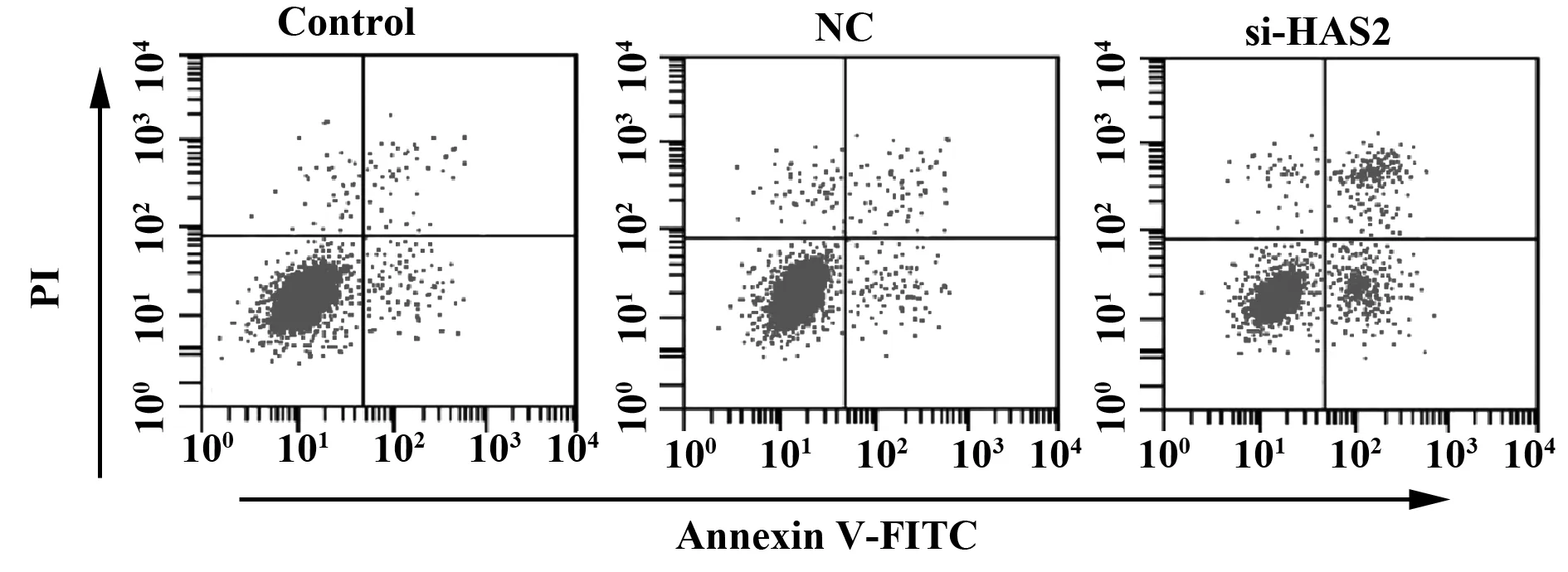
图3 si-HAS2转染对大鼠卵巢颗粒细胞凋亡的影响Fig.3 Effect of si-HAS2 transfection on apoptosis of rat ovarian granulosa cells
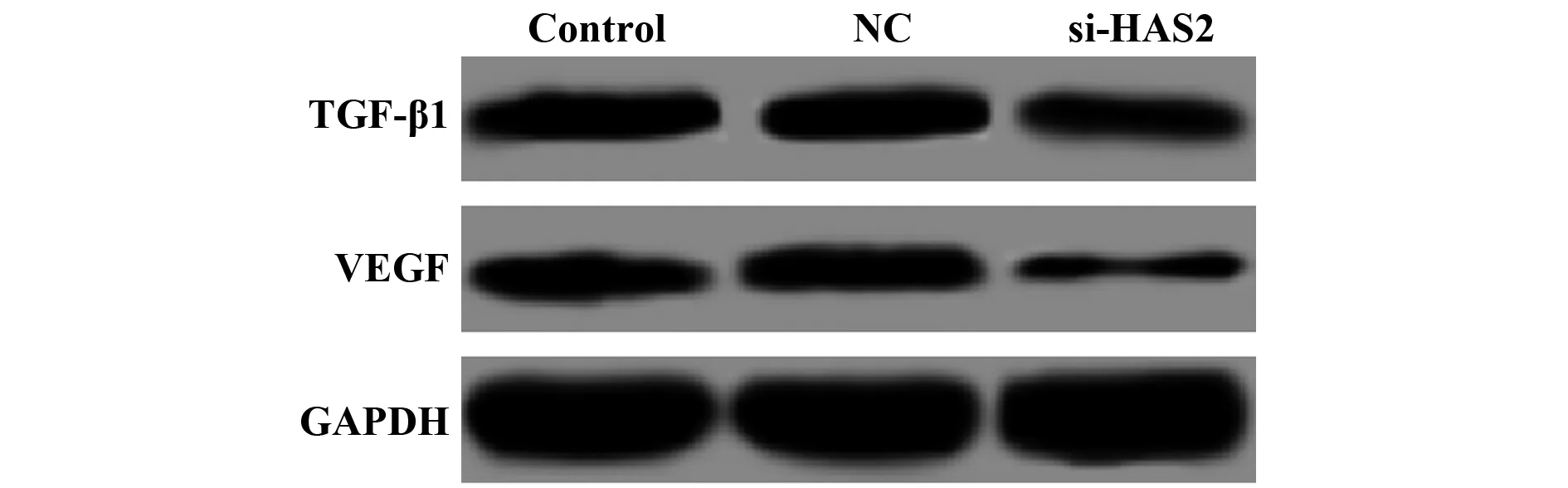
图4 si-HAS2转染对大鼠卵巢颗粒细胞免疫因子TGF-β1和VEGF表达的影响Fig.4 Effect of si-HAS2 transfection on expression of TGF-β1 and VEGF in rat ovarian granulosa cells
表2 si-HAS2转染对大鼠卵巢颗粒细胞免疫因子TGF-β1和VEGF表达的影响
Tab.2 Effect of si-HAS2 transfection on expression of TGF-β1 and VEGF in rat ovarian granulosa cells

Groups TGF-β1 VEGFControl group0.431±0.0380.311±0.028NC group0.456±0.0420.329±0.030si-HAS2 group0.115±0.0131)0.102±0.0091)
Note: Vs NC group,1)P<0.05.
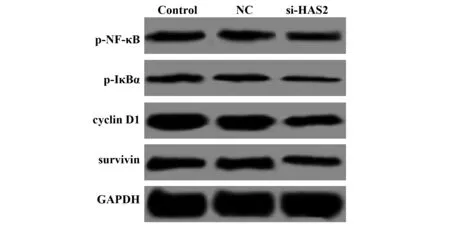
图5 si-HAS2转染对大鼠卵巢颗粒细胞NF-κB信号通路的影响Fig.5 Effect of si-HAS2 transfection on NF-κB signaling pathway in rat ovarian granulosa cells
表3 si-HAS2转染对大鼠卵巢颗粒细胞NF-κB信号通路的影响
Tab.3 Effect of si-HAS2 transfection on NF-κB signaling pathway in rat ovarian granulosa cells

Groupsp-NF-κBp-IκBαcyclinD1survivinControl group0.162±0.0140.141±0.0120.589±0.0580.196±0.023NC group0.154±0.0120.134±0.0110.552±0.0450.211±0.025si-HAS2 group0.077±0.0081)0.059±0.0071)0.187±0.0211)0.145±0.0161)
Note:Vs NC group,1)P<0.05.
3 讨论
PCOS的病因较为复杂,目前也没有公认的建立PCOS动物模型的标准,临床上多用孕激素联合人绒毛膜促性腺激素注射、DHEA肌肉注射等方法[5,6]。在本研究中使用DHEA肌肉注射方法建立PCOS大鼠模型。HA属于细胞外基质的组成结构,可通过与细胞表面受体互作影响细胞的生长、增殖、黏附等细胞行为[7]。HAS2为HA的一种异构体,过表达HAS2可引起HA的过度分泌,HAS2的表达失控可引起多种肿瘤的发生发展[8,9]。此外,有研究发现,HAS2表达会随着卵母细胞成熟而升高[10]。在PCOS中HAS2的研究较少,有研究发现,靶向抑制HAS2可增强卵巢颗粒细胞的凋亡[4]。在本研究中,通过Western blot检测PCOS大鼠模型卵巢组织中HAS2表达,发现HAS2在卵巢组织中呈现出高表达。这提示HAS2可能影响PCOS的发生发展。由于RNA干扰(RNAi)是一种新的特异性沉默基因表达的技术,具有高效特异性,且在基因功能方面应用十分广泛[11,12]。因此,本研究中通过此技术沉默PCOS大鼠卵巢颗粒细胞HAS2,(发现HAS2表达受到抑制后卵巢颗粒细胞的增殖明显,VEGF作为卵巢内的调节因子,可通过自分泌和旁分泌途径调控人体卵巢血管生成),多篇文献报道VEGF在PCOS患者卵泡中表达明显升高,且主要在卵泡颗粒细胞中表达,而在健康妇女中表达无明显变化[13,14]。也有研究表明,抑制VEGF可阻碍黄体形成及发挥功能,这提示在靶向治疗PCOS中抑制VEGF可能是一个有效的途径[15]。TGF-β1在多种组织器官中广泛分布,在细胞的免疫应答、增生、分化等过程中有双向调节作用,作为VEGF的上游因子,可促进血管的生长[16]。有研究发现,TGF-β1参与调控PCOS的卵泡发育及闭锁[17]。在本研究中抑制PCOS大鼠卵巢颗粒细胞HAS2表达后VEGF和TGF-β1的表达均显著降低。这提示HAS2可能通过抑制VEGF和TGF-β1表达影响PCOS的发生发展。NF-κB是一个核转录因子,调节炎症、免疫等过程,有研究显示,miR-146a可通过抑制TRAF6、IRAK1的转录而使NF-κB的活性受到抑制,进而诱导卵巢颗粒细胞发生凋亡[18]。在本研究中发现,抑制HAS2在卵巢颗粒细胞的表达后NF-κB信号通路中p-NF-κB、p-IκBα及下游cyclin D1和survivin的表达均明显降低。cyclin D1是一个与细胞增殖相关的蛋白,在卵巢颗粒细胞中可通过下调cyclin D1表达抑制细胞增殖[19]。survivin是一个凋亡抑制蛋白,PCOS中survivin的表达升高[20]。因此,本研究的结果提示HAS2可通过抑制NF-κB信号降低卵巢颗粒细胞增殖和诱导凋亡。
综上所述,PCOS中HAS2高表达,抑制大鼠卵巢颗粒细胞中HAS2表达可降低细胞活力,诱导细胞凋亡,机制可能与下调免疫抑制因子TGF-β1和VEGF及NF-κB信号通路表达有关。本研究可能为HAS2在PCOS中的作用研究奠定了一定的基础。