药物介导的自身免疫性肝炎1例
2019-05-08
1 病例资料
患者为男性,58岁,因“皮肤巩膜进行性黄染3个月”入院。既往身体健康,无慢性肝脏疾病史。患者入院前5个月间断服用三七粉1月余,入院前3个月出现腹胀不适,随后出现皮肤巩膜进行性黄染,尿液呈浓茶水样,于当地医院就诊,入院查肝功能显示:总胆红素(TBil)196.76 μmol/L,直接胆红素(DBil)112.4 μmol/L,丙氨酸氨基转移酶(ALT)1 426 U/L,天冬氨酸氨基转移酶(AST)781 U/L,碱性磷酸酶(ALP)136 U/L,谷氨酰转肽酶(GGT)967 U/L。肝炎病毒标志物未见明显异常。当地医院诊断为“急性黄疸型肝炎”,给予多烯磷脂酰胆碱、注射用还原型谷胱甘肽、注射用丁二磺酸腺苷蛋氨酸保肝,熊去氧胆酸胶囊利胆退黄治疗,治疗约2个月后肝功能基本恢复正常,进一步于当地医院完善肝穿刺活组织检查,结果显示:肝活组织相当于10余个肝小叶范围,小叶结构尚清晰,查见汇管区11个,小叶内肝细胞部分疏松化,散在较多点灶状坏死及中性核粒细胞浸润,未见肝细胞脂肪变性,汇管区中度淋巴细胞及数量不等的浆细胞浸润伴轻度界面性炎,似可见肝细胞花环结构,汇管区可见明显细胆管反应伴较多中性粒细胞浸润,偶见嗜酸性粒细胞浸润,汇管区纤维组织增生,纤维间隔形成(见图1)。当地医院继续给予保肝治疗1个月后复查肝功能,结果显示:TBil 174.4 μmol/L,DBil 102.8 μmol/L,ALT 160 U/L,AST 213 U/L,ALP 293 U/L,GGT 972 U/L。患者因肝功能好转不明显,进一步于上海交通大学医学院附属仁济医院消化内科就诊,入院后完善肝功能检查,结果显示:TBil 124.2 μmol/L,DBil 97.9 μmol/L,ALT 125 U/L,AST 159 U/L,ALP 245 U/L,GGT 871 U/L。免疫球蛋白(Ig)检测结果显示:IgG 22.5 g/L,IgA 7.84 g/L,IgM 3.62 g/L。自身免疫性肝病抗体显示:抗核抗体(ANA) 1∶100,抗平滑肌抗体(ASMA) 1∶100,余阴性。肝脏超声影像和瞬时弹性成像显示:肝脏硬度 66.4 kPa,脂肪衰减 212 db/m。上腹部CT血管造影(CTA)显示:肝硬化,肝脏局部灌注不均匀(见图2)。结合患者外院病理结果及病程中肝功能波动情况,提示药物介导的自身免疫性肝炎(AIH)。遂给予多烯磷脂酰胆碱、注射用还原型谷胱甘肽保肝,前列地尔注射液改善微循环,熊去氧胆酸胶囊退黄,并加用泼尼松龙30 mg/d治疗原发病,2周后患者肝功能好转不明显,Ig无明显下降趋势,予加用吗替麦考酚酯分散片0.5 g/d,泼尼松龙规律减量至20 mg/d,复查肝功能显示:TBil 74.5 μmol/L,DBil 51.2 μmol/L,ALT 104 U/L,AST 71 U/L,ALP 163 U/L,GGT 803 U/L。Ig检测结果显示:IgG 21.8 g/L,IgA 7.91 g/L,IgM 3.93 g/L。准予出院,门诊随访,2个月后患者肝功能基本恢复正常。
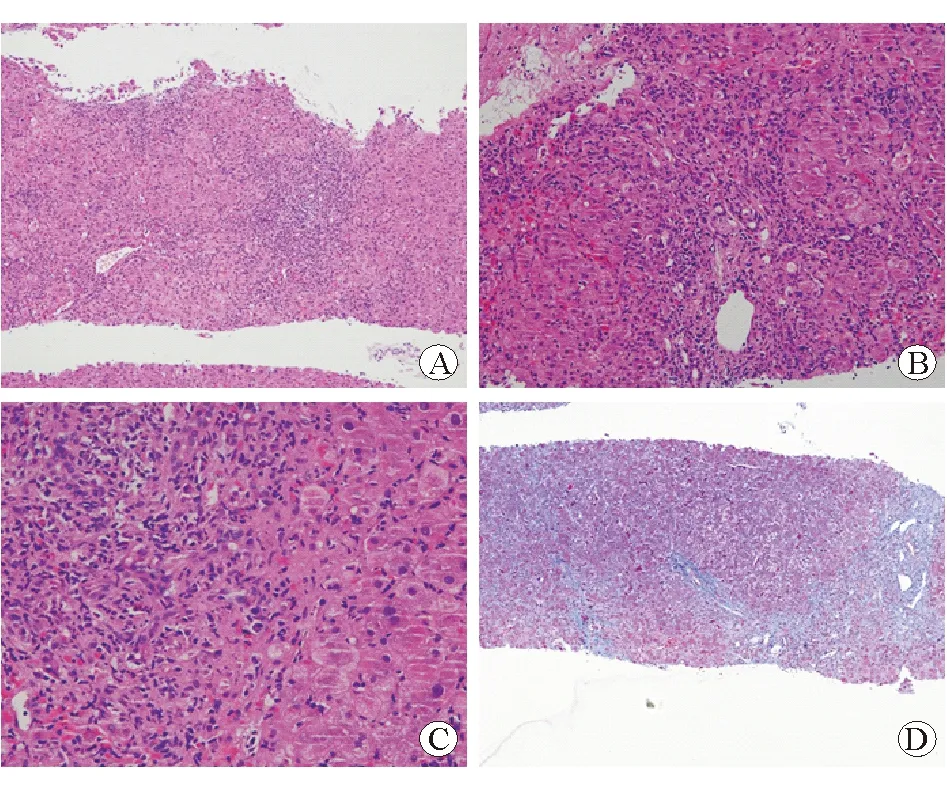
图1肝穿刺活组织病理结果A苏木精-伊红染色×100B苏木精-伊红染色 ×200C苏木精-伊红染色 ×400DMASSON染色 ×100

图2上腹部CTAA平扫期 肝脏密度不均匀减低B门脉期 肝脏局部灌注不均
2 讨论
AIH是一种由针对肝细胞的自身免疫反应所介导的肝脏实质炎性反应,以血清自身抗体阳性、高IgG和(或)高γ球蛋白血症、肝组织学上存在界面性肝炎为特点,如不治疗多可导致肝硬化或肝功能衰竭[1]。药物性肝损伤(DILI)是指在药物治疗过程中,由药物本身或其代谢产物引起的肝损伤,表现为各种类型的急性或慢性肝脏疾病,有时可伴有自身抗体阳性、血清IgG升高等现象。由于两者复杂的临床表现,一定程度上较为相似的实验室指标,诊断缺乏金标准及治疗原则不同等原因,故对于两者的鉴别、诊断和治疗存在一定困难。
一般而言,AIH与DILI之间的关系可分为3类:(1)AIH合并DILI 新使用药诱发已确诊AIH的患者出现新的肝损伤,即新发DILI。通常会导致组织学纤维化程度的进展。(2)药物介导的AIH(DI-AIH) 指患者未表现出AIH的症状,或者仅有轻度症状而未达到诊断标准,因使用药物诱导或加重症状而被诊断为AIH。(3)免疫介导的DILI 指药物导致的具有AIH特点(如自身抗体阳性、界面性肝炎等)的肝损伤,当停药后肝损伤可自发缓解或静止,又被称为自身免疫样DILI[2]。免疫介导的DILI是药物依赖性的,即用药时疾病发作,停药后一般可自行缓解,并且不会复发,本质依然是DILI;而对于DI-AIH,药物仅作为诱发因素,与病程进展无关,本质上属于AIH。由药物等相关因素触发的DI-AIH是急性肝衰竭的主要原因之一[3]。DI-AIH的临床特征与AIH相似,通常于药物暴露的2~24个月内发病,平均潜伏期为3~4个月,多有乏力、纳差、皮肤瘙痒、腹部不适及肝脾肿大等非特异性肝病表现。几乎所有的DI-AIH患者均表现为自身抗体阳性,其中ANA阳性者达50%~83%[4]。本例患者既往无慢性肝病病史,以腹胀、皮肤巩膜黄染、尿色加深起病,症状不具特异性,结合患者药物史,首先考虑DILI可能,但患者经保肝治疗后肝功能仍反复波动,此时需考虑AIH可能。进一步完善检查,患者有多项AIH抗体阳性,IgG表达较高,提示不能排除DI-AIH,需要进一步检查以明确诊断。
目前DI-AIH仍为排除性诊断,要严格排除其他原因肝病,评估用药时间与肝功能异常指标之间的关联,寻找特征性临床药物证据,观察停用肝损伤药物后肝功能指标的变化,这对于本病的诊断非常重要。组织学检查是诊断AIH的重要依据,然而通过组织学来鉴别两者仍存在一定难度。AIH和DILI的组织学均可有界面性肝炎、点灶样坏死和门管区炎性反应[5]。门管区、腺泡内浆细胞浸润、玫瑰花环和穿入现象支持AIH的诊断,而汇管区中性粒细胞浸润及肝内胆汁淤积多见于DILI。本例患者的病理表现为界面性肝炎,汇管区中性粒细胞浸润,可见到玫瑰花环等AIH特异性表现,结合患者服用三七粉1月余出现肝功能损伤后,经积极保肝治疗2个月后肝功能仍有反复波动,应考虑DI-AIH。
DI-AIH在停用肝损伤药物后病情继续进展,即使给予保肝药物干预也无法阻止,甚至可进展为失代偿性肝病,早期应用激素或免疫抑制剂会取得较好疗效,肝功能异常的指标多在治疗2周内恢复,也可能延迟至2~3个月后,且停药后无复发。而DILI在保肝药物治疗下,3个月内肝功能多可恢复至正常水平,无需激素或免疫抑制剂治疗[6]。因此,DI-AIH与DILI的鉴别亦可通过它们对糖皮质激素治疗的应答情况来判断[7-8]。诊断为AIH的患者中约有9%实际为DI-AIH,两者的肝脏炎性反应和纤维化程度的组织学特征相似,在DI-AIH急性期或AIH急性恶化时,仅提示肝脏急性炎性反应而非特异性组织学特征[3]。因此,积极寻找特征性的临床药物证据,并观察停用肝损伤药物后肝功能指标的变化尤为重要。DI-AIH停用肝损伤药物后临床状况可自行改善,而AIH缺乏此特点,单纯的DILI则往往无需激素或免疫抑制剂治疗。根据欧洲肝病学会AIH指南,所有活动性炎性反应患者均需治疗,一线治疗方案为泼尼松龙,2周后加用免疫抑制剂。初始泼尼松龙的剂量为每日0.5~1 mg/kg。理想情况下泼尼松龙治疗2周后可加用免疫抑制剂。结合本例患者的既往史、病程、肝功能波动变化、组织学表现,拟诊为DI-AIH并且已经进展至肝硬化。在应用2周激素治疗效果不明显时,加用吗替麦考酚酯分散片治疗原发病,随后患者在门诊规律随访,2个月后肝功能恢复正常,符合DI-AIH的病程变化[9]。因此,在这类DILI与AIH较难鉴别的病例中,观察停用药物后的肝功能变化情况及应用激素或免疫抑制剂后的治疗反应,是鉴别诊断的关键之一。
综上所述,AIH和DILI具有相似的临床表现,AIH自身抗体不具有特异性,且DILI缺乏可靠的诊断标准,因此两者难以鉴别。但由于两者具有不同的处理原则和预后[10],因此鉴别诊断至关重要。可采取的方法包括组织学检查及随访停药后是否复发,结合患者的病程、AIH抗体的演变等来进行判断。
