三氧化二砷联合环腺苷酸拟似物诱导骨髓瘤细胞凋亡的实验研究
2019-04-29杭海芳王莹莹励菁菁
杭海芳,王莹莹,唐 勇,庄 衍,励菁菁,朱 琦
上海交通大学医学院附属第九人民医院血液内科,上海 200011
多发性骨髓瘤(multiple myeloma,MM)是浆细胞恶性克隆增殖性疾病,近年来随着分子靶向药物及造血干细胞移植等细胞免疫疗法成功应用于MM治疗,MM患者的缓解率和无病生存率较以往显著提高,然而仍有相当一部分患者在缓解后复发并对多种药物产生耐药,属于复发/难治性病例。因此,寻找MM新型药物治疗模式有其必要性和重要的临床意义。已有研究显示,三氧化二砷(arsenic trioxide,As2O3)可以通过调节细胞内多条信号通路介导MM细胞增殖阻滞和凋亡,但As2O3单药的临床疗效有限[1]。我们的前期研究发现,提高细胞内环腺苷酸(cyclic adenosine monophosphate,cAMP)浓度不仅可以诱导MM细胞凋亡,而且能够增强MM常用临床药物(如硼替佐米)的凋亡诱导效应[2]。鉴于此,本研究以MM细胞株U266细胞为模型,探讨As2O3单独和联合cAMP拟似物8-对氯苯硫基环腺苷酸[8-(4-chlorophenylthio) adenosine 3’,5’-cyclic monophosphate,8-CPT-cAMP]处理对MM细胞的影响及其可能机制。
1 材料和方法
1.1 试剂
As2O3(由上海血液学研究所惠赠)用PBS配制成5 mmol/L储存液。8-CPT-cAMP(购自美国Abcam公司)溶于水中配制成浓度为50 mmol/L的储存液。
1.2 细胞培养与细胞形态学观察
MM细胞株U266细胞由上海交通大学医学院病理生理学教研室提供。将2×105个/mL U266细胞接种于含10%胎牛血清、100 μg/mL青霉素、100 μg/mL链霉素和2 mmol/mL谷氨酰胺的RPMI-1640培养基(购自美国Sigma公司)中,常规条件下培养(37 ℃、CO2体积分数为5%、95%湿度)48 h后抽取部分细胞用Shandon Cytospin 4细胞离心涂片机(购自美国Thermo Fisher Scientific公司)进行涂片,瑞士蓝染色,在光学显微镜下观察其细胞形态,并以Image-Pro Plus软件拍摄图像。
1.3 细胞计数试剂盒(cell counting kit-8,CCK-8)法检测细胞增殖抑制率
取对数生长期的U266细胞,按5×104个/ mL接种于96孔板,每孔100 μL。实验组分别单独及联合用0.50、1.00 μmol/L As2O3和200 μmol/L 8-CPT-cAMP处理U266细胞。同时设溶剂对照组和空白对照组,每组3个复孔。置于37 ℃、CO2体积分数为5%饱和湿度培养箱中,培养72和120 h后每孔分别加入10 μL CCK-8溶液(购自日本同仁化学研究所),混匀,继续培养4 h,酶标仪振荡,以空白对照孔调零,测450 nm处各孔吸光度(D)值。细胞生长抑制率(%)=(1-D实验组/D对照组)×100%进行计算。应用Chou-Talalay中效分析法,由CompuSyn软件计算出各处理组细胞效应分数(fraction affected,Fa,即药物处理后细胞生长抑制率)相应的药物联合指数(combination index,CI),并绘制Fa-CI曲线,当CI<1,表示两药有协同作用;CI=1,表示两药有叠加作用;CI>1,表示两药为拮抗作用。
1.4 流式细胞术检测细胞周期和凋亡率
1.4.1 细胞周期检测
分别收集上述单独及联合用0.50、1.00 μmol/L As2O3和200 μmol/L 8-CPT-cAMP处理的U266细胞,PBS洗涤后加入75%乙醇溶液,-20 ℃固定过夜;加入1×PBS 10 mL混匀,2 500 r/min离心5 min(离心半径为8.5 cm),洗涤2次,分别加入100 mg/mL核糖核酸酶(ribonuclease,RNase)37 ℃温育30 min;采用100 μg/mL碘化丙啶(propidium iodide,PI)染色后采用流式细胞术检测。所有数据用美国Beckman Coulter公司的Multicycle软件收集、存储和分析。
1.4.2 细胞凋亡率检测
根据Annexin-V/FITC凋亡检测试剂盒(购自美国BD公司)说明,将不同处理组细胞以PBS洗涤后加入1 mL结合缓冲液,漂洗细胞1次。依次加入100 μL结合缓冲液及3 μL Annexin-V/FITC,重悬混匀,避光温育15 min,再加入3 μL PI,避光温育3 min,每管加入结合缓冲液400 μL,1 h内进行流式细胞术检测。
1.5 蛋白质印迹法(Western blot)检测细胞凋亡相关蛋白表达
在PBS洗涤后的各组U266细胞中加入细胞裂解液提取总蛋白,经考马斯亮蓝定量后,取各组等量总蛋白进行十二烷基硫酸钠(sodium dodecyl sulfate,SDS)聚丙烯酰胺凝胶垂直电泳,常规转膜;膜经室温5%脱脂牛奶封闭1 h,加入相应一抗(包括Bcl-2和caspase-3),4 ℃过夜;经含0.1%Tween-20的PBS充分洗涤后与相应稀释度的二抗室温下反应1 h,应用ECL试剂盒(购自英国Amersham Pharmacia Biotech公司)显影扫描保存。所用抗体均购自美国Santa Cruz公司。
1.6 统计学处理
采用SPSS 16.0软件包进行统计分析,计量资料用x±s表示,检验方差齐性,两组均数间比较采用独立样本t检验,多组均数间比较采用单因素方差(ANOVA)分析法,P<0.05为差异有统计学意义。
2 结 果
2.1 As2O3和8-CPT-cAMP单独及联合对U266细胞生长的影响
MM细胞株U266细胞经1.00 μmol/L As2O3和200 μmol/L 8-CPT-cAMP单独及联合处理72和120 h后,联合用药组所诱导的细胞生长抑制率分别达到(18.01±0.13)%和(28.01±0.14)%,明显高于单独用药组[As2O3单药组细胞生长抑制率为(11.35±0.01)%和(16.01±0.14)%,8-C P T-c A M P单药组细胞生长抑制率为(12.26±0.30)%和(15.43±0.23)%],差异有统计学意义(P<0.05,表1)。但不同浓度As2O3(0.25、0.50和1.00 μmol/L)单独及联合8-CPT-cAMP(200、300和400 μmol/L)处理U266细胞后生长抑制率和相应药物浓度应用CompuSyn软件分析,结果显示,两药联合处理U266细胞的CI值均>1(表2和图1)。形态学观察显示,单药组及联合处理组细胞均出现细胞体积缩小、细胞质浓缩、核固缩和碎裂等典型凋亡形态学改变,单药组及联合用药组处理后细胞形态无显著变化(图2)。
表 1 As2O3单独及联合8-CPT-cAMP对U266细胞生长的影响Tab. 1 Effect of As2O3 alone or combined with 8-CPT-cAMP on the survival of U266 cells(%, ±s)

表 1 As2O3单独及联合8-CPT-cAMP对U266细胞生长的影响Tab. 1 Effect of As2O3 alone or combined with 8-CPT-cAMP on the survival of U266 cells(%, ±s)
Group Sample number n Growth inhibition rate Cell apoptotic rate 72 h 120 h 72 h 120 h Control 3 5.65±0.15 8.98±0.01 5.51±0.06 8.98±0.01 As2O3 3 11.35±0.01 16.01±0.14 10.06±0.01 12.35±0.14 8-CPT-cAMP 3 12.26±0.30 15.43±0.23 13.26±0.30 18.76±0.23 As2O3+8-CPT-cAMP 3 18.01±0.13 28.01±0.14 22.26±0.13 31.03±0.14

表 2 As2O3联合8-CPT-cAMP对U266细胞增殖的抑制效应Tab. 2 Inhibitory effects of As2O3 combined with 8-CPT-cAMP on the proliferation of U266 cells
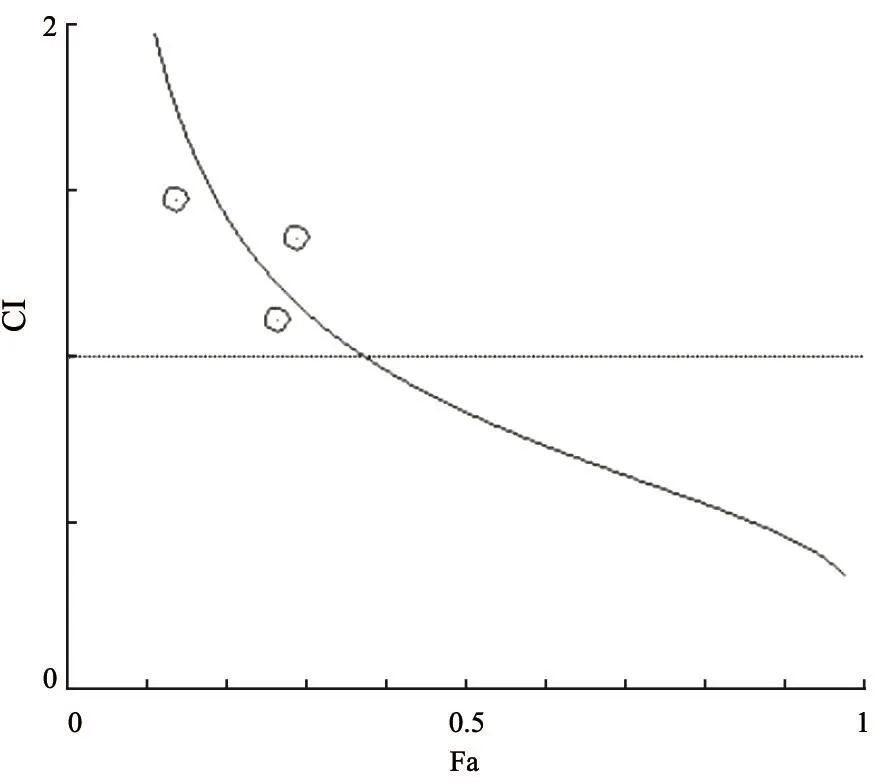
图 1 As2O3联合8-CPT-cAMP抑制U266细胞增殖的协同效应曲线Fig. 1 The Fa-CI plot of As2O3 combined with 8-CPT-cAMP on the proliferation of U266 cells

图 2 As2O3和8-CPT-cAMP单独及联合处理U266细胞后形态学变化Fig. 2 Effects of As2O3 alone and combined with 8-CPT-cAMP on the morphologic changes of U266 cells
2.2 As2O3和8-CPT-cAMP对U266细胞凋亡率的影响
Annexin-V/PI双染法流式细胞术检测细胞凋亡率的结果显示,U266细胞经1.00 μmol/ L As2O3和200 μmol/L 8-CPT-cAMP单药及联合处理72和120 h后,As2O3单药组细胞凋亡率为(10.06±0.01)%和(12.35±0.14)%,8-CPT-cAMP单药组细胞凋亡率为(13.26±0.30)%和(18.76±0.23)%,联合用药组细胞凋亡率分别达到(22.26±0.13)%和(31.03±0.14)%,显著高于单药组(P<0.05,表1)。
2.3 As2O3和8-CPT-cAMP对U266细胞内凋亡调控蛋白表达的影响
用As2O3和8-CPT-cAMP单独及联合处理U266细胞72 h后,Western blot检测细胞内caspase-3和Bcl-2蛋白的表达情况。结果显示,As2O3单药及联合8-CPT-cAMP可以使细胞内caspase-3蛋白发生剪切活化,同时下调Bcl-2蛋白表达水平,其中联合用药组caspase-3蛋白剪切活化和Bcl-2蛋白表达下调更为明显,而8-CPT-cAMP单药对细胞内caspase-3和Bcl-2表达均无明显影响(图3)。

图 3 As2O3和 8-CPT-cAMP对U266细胞内凋亡调控蛋白表达的影响Fig. 3 Effects of As2O3 and 8-CPT-cAMP on the expression of apoptosis modulator in U266 cells
3 讨 论
MM作为高度异质性浆细胞肿瘤,由于肿瘤细胞克隆演变导致疾病复发并产生对现有治疗方案的耐药[3],积极探究新型有效药物和作用模式成为进一步提高MM临床疗效和改善其预后的主要途径。我们的前期研究发现,As2O3和cAMP拟似物8-CPT-cAMP通过调节MM细胞内多个信号调控分子(如SOCS-1、Bcl-2和Bax等)诱导其增殖阻滞和凋亡,但同时也发现As2O3和8-CPT-cAMP单药作用有限及所需剂量较高等问题[4-5]。有鉴于此,本研究采用As2O3与8-CPT-cAMP联合处理MM细胞株U266细胞,观察两药联合对MM细胞生物学行为的影响。
本研究显示,As2O3与8-CPT-cAMP单药均可以抑制U266细胞生长并诱导其凋亡,这与已有的相关研究结果一致[6-7]。但两药联合对U266细胞增殖阻滞和凋亡诱导效应明显高于单独用药组,差异有统计学意义,同时应用CompuSyn软件分析,结果显示,两药联合的CI值>1,说明As2O3与8-CPT-cAMP在抑制U266细胞增殖过程中协同效应并不明显。此外,单药和两药联合处理72 h后的U266细胞形态呈现核固缩和凋亡小体等典型凋亡表现,单药组和联合用药组细胞形态也无明显变化。Western blot对凋亡相关蛋白的检测结果也进一步显示,联合用药组U266细胞内caspase-3蛋白剪切活化和Bcl-2表达下调,与As2O3和8-CPT-cAMP单药组比较有明显差异。上述结果提示,8-CPT-cAMP能够增强As2O3诱导MM细胞凋亡,但协同效应不明显。
经典细胞凋亡主要包括线粒体途径和死亡受体途径,两条途径最终都是通过激活caspases诱导凋亡,其中caspase-3是凋亡过程中重要的终末剪切酶。Bcl-2作为一种抗凋亡蛋白,与线粒体凋亡途径密切相关[8]。本实验发现,As2O3单药或联合8-CPT-cAMP能够诱导U266细胞内Bcl-2表达下调和caspase-3剪切活化,提示As2O3单药或联合8-CPT-cAMP可能是通过细胞内线粒体途径诱导细胞凋亡。前期研究也显示,As2O3和8-CPT-cAMP均可以改变MM细胞线粒体跨膜电位而通过线粒体途径诱导其凋亡[2,9],但二者合用协同效应不明显是否与线粒体作用位点叠加甚至拮抗有关,有待进一步深入研究。
综上所述,As2O3联合8-CPT-cAMP可能通过线粒体途径促使MM细胞增殖阻滞和凋亡。8-CPT-cAMP可以增强As2O3凋亡诱导效应,但协同效应不明显,有必要进一步筛选更为有效的新型组合。
