Durvalumab治疗放化疗后不可切除的局部晚期非小细胞肺癌的Ⅲ期试验—PACIFIC研究解读
2019-04-29郭兰伟,王慧娟
【简评】
Ⅲ期非小细胞肺癌(non-small cell lung cancer,NSCLC)约占初诊肺癌的30%,基于淋巴结受累情况可切除性存在很大差异。对于不可手术切除的Ⅲ期NSCLC,目前的标准治疗是同步放化疗,但是患者的5年生存率低于20%。PACIFIC研究是在过去的几十年里,Ⅲ期不可切除的NSCLC全身治疗中,第一个无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)都获得阳性结果的Ⅲ期临床研究。研究结果分别在2017年的欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)和2018年的世界肺癌大会(World Conference on Lung Cancer,WCLC)上公布,并同期在N Engl J Med上发表,代表着Ⅲ期不可切除的NSCLC治疗领域的里程碑式进展。
尽管PACIFIC研究结果为Ⅲ期不可切除的NSCLC患者同步放化疗后的免疫检查点抑制剂durvalumab巩固治疗提供了新的选择,但是仍有一些问题值得深入探讨。首先是PD-1抑制剂和放化疗的最佳结合模式,临床前的动物模型显示,PD-1抑制剂与放化疗同步治疗的疗效最好,目前正在进行中的临床研究也在探索放化疗同步PD-1抑制剂治疗Ⅲ期不可切除的NSCLC,相信未来的研究结果会给我们提供更好的临床治疗方案。其次,PACIFIC研究的亚组分析中发现PD-L1表达<1%的人群OS没有获益,治疗前是否需要进行PD-L1检测也是临床治疗中面临的问题。第三,PACIFIC研究入组人群多为高加索裔,这种治疗模式是否适合亚裔人群,对于亚裔常见的驱动基因尤其是表皮生长因子受体(epidermal growth factor receptor,EGFR)突变人群是否适合,这些都是未来需要解决的问题。
本期分享的是2018年9月发表在N Engl J Med上的PACIFIC研究,旨在比较durvalumab与安慰剂作为巩固治疗,在接受了以铂类药物为基础的放化疗后尚未出现疾病进展、不可手术切除的Ⅲ期NSCLC患者中的疗效和安全性[1]。
1 背景
大约1/3的NSCLC患者在确诊时的分期为Ⅲ期[2]。对体力状况良好、不可手术切除的Ⅲ期NSCLC患者而言,标准治疗方法是以铂类为基础的双药化疗联合同步放疗(放化疗)[3]。然而,结果并不理想,因为大多数患者在放化疗后病情恶化,15%~30%的患者能够存活5年,这相当于中位生存期不超过28个月[3]。已有多项研究检验了放化疗患者在疾病控制后给予系统性治疗的疗效。然而,迄今为止,这些治疗均被证明无效,巩固治疗后的中位生存期仅为18~23个月[4-8]。
Durvalumab是一种选择性、高亲和力、人源性IgG1单克隆抗体,能阻断PD-L1与PD-1及CD80的结合,从而使T细胞能够识别并杀灭肿瘤细胞[9-11]。已有临床前研究证据提示,化疗和放疗可能上调了肿瘤细胞中PD-L1的表达[12-14],而PD-L1的表达水平是durvalumab疗效的预测因素,因此该研究假设durvalumab可能会对放化疗后的患者带来临床获益。
PACIFIC是一项与安慰剂对照的多中心、随机、双盲Ⅲ期临床试验,评估了免疫检查点抑制剂durvalumab对接受同步放化疗后未进展的Ⅲ期不可切除NSCLC患者的疗效[15]。试验的首次数据已于2017年9月在N Engl J Med上发表[15],结果表明,与安慰剂对比,durvalumab显著延长了PFS(两个主要终点之一),中位PFS分别为16.8(95% CI:13.0~18.1)和5.6个月(95% CI:4.6~7.8),疾病进展或死亡风险比为0.52(95%CI:0.42~0.65,P<0.001)。基于这一结果,durvalumab被批准用于以铂类药物为基础的放化疗后未出现疾病进展、不可切除的Ⅲ期NSCLC的治疗[16-17]。
在此,该研究继续报告PACIFIC试验第2个主要终点OS的结果,也报告最新的PFS和次要终点的有效性和安全性。
2 研究概况
该研究入组经组织学或细胞学证实的、根据国际肺癌研究联合会(International Association for the Study of Lung Cancer)胸部肿瘤分期手册(Staging Manual in Thoracic Oncology)第7版分期为Ⅲ期不可手术切除的NSCLC患者,并且患者接受了至少2个周期以铂类为基础的化疗联合同步根治性放疗(54~66 Gy),肺组织的平均受照剂量<20 Gy或V20(接受≥20 Gy照射的肺实质体积)<35%,或同时符合以上两个条件。排除之前接受过免疫治疗或试验性药物治疗或有原发性免疫缺陷疾病的患者。
该研究为多中心、随机、双盲、与安慰剂对照的Ⅲ期试验,在26个国家的235个研究中心中完成。患者在放化疗结束后的1~42 d内,以患者的年龄、性别及吸烟史作为分层因素,以2∶1的比例随机分组,分别每两周1次静脉给予durvalumab(10 mg/kg)或安慰剂作为巩固治疗,最长持续12个月。接受研究药物治疗的患者可持续治疗至疾病进展,如果在12个月治疗结束时能够达到疾病控制,但在随后的随访中出现疾病进展,可以再次接受该研究药物治疗(图1)。
该研究主要终点为意向性治疗(intentionto-treat,ITT)患者分析集的OS及通过独立、盲法集中审核的PFS。次要研究终点包括24个月的生存率、客观缓解率(objective response rate,ORR)、缓解持续时间、12~18个月的无进展生存率、死亡或远处转移的时间、第2次进展的时间、缓解持续时间和安全性。
3 统计学设计特点
本研究设置了2个共同主要研究终点,统计检验水准α基于成组序贯Holm设计,并基于近似于O’Brien-Fleming方法的Lan-DeMets消费函数(包含期中分析)进行多重比较的计算[18]。总的一类错误概率设双侧0.050,针对OS和PFS均设0.025,其中任何一个终点经比较检验后,若拒绝无效假设,则相应的α可以传递给另一个终点(图2)。
按照该设计,如果两个联合主要终点(PFS、OS)中的一个,在durvalumab组较安慰剂组有显著改善,则认为该研究结果为阳性。按2∶1的随机分组,约需要702例患者,以获得458例无进展生存事件和491例总生存事件。对于每项联合主要终点,基于双侧显著性水平2.5%的时序检验,估计该研究有至少95%的功效检测出0.67的疾病进展或死亡风险比,并有至少85%的功效检测出0.73的死亡风险比。
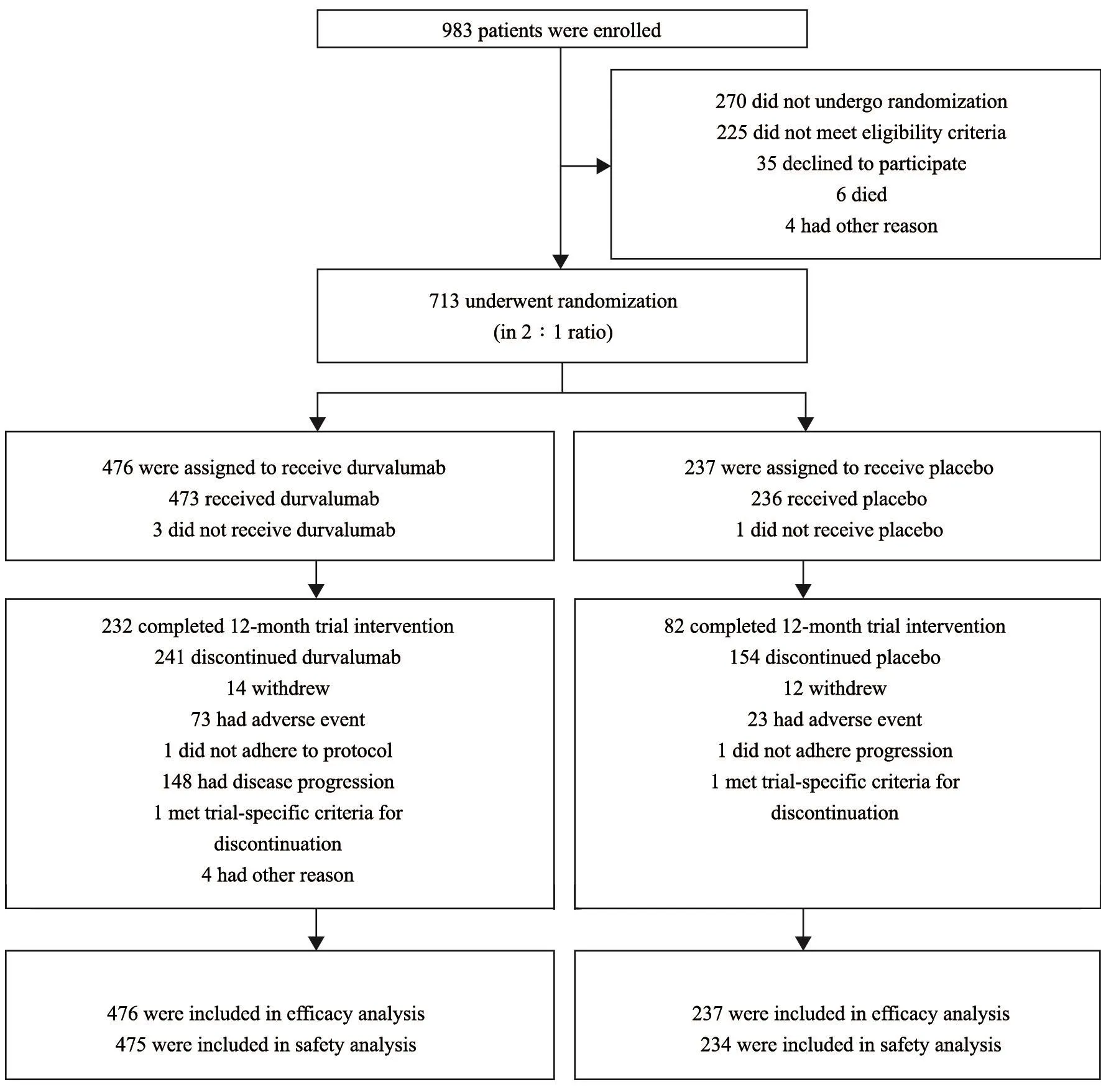
图 1 试验患者入组结果Fig. 1 Trial enrollment and outcomes of the patients

图 2 成组序贯Holm设计示意图Fig. 2 Group sequential Holm procedure
研究计划在285和393例死亡事件时进行2次OS期中分析,提前终止的检验水准为α=0.002 74;实际发生299例死亡事件时(2018年3月22日)进行数据锁定,作为OS第1次期中分析的结果。由于该试验在中期分析的基础上就达到差异有统计学意义,因此本文提供的结果被认为是OS的最终结果。
对于OS和PFS的组间定性比较均采用分层Log-rank检验。定量比较采用分层COX回归分析计算HR[包括相应的中期分析调整后的100(1-α)%CI或95%CI和P值],分层因素与Log-rank检验保持一致。Kaplan-Meier方法用于计算中位时间及其相关的95% CI。对于亚组分析,因为亚组分析是为了显示疗效的一致性,而没有进行多重性校正。使用Clopper-Pearson法对缓解率进行估算,并使用Fisher精确检验进行了对比。
4 研究结果
2014年5月—2016年4月,研究共入组713例患者,有709例患者(99.4%)接受了至少1次研究药物作为巩固治疗(473例患者接受了durvalumab,236例患者接受了安慰剂)(图1)。所有患者的中位年龄为64岁,大部分为男性(70.1%)及现在或既往吸烟者(91.0%);45.7%患者的组织学类型为鳞癌。两组患者对先前的放化疗产生相似的应答(完全缓解:durvalumab组为1.9%,安慰剂组为3.0%;部分缓解:durvalumab组为48.7%,安慰剂组为46.8%);分别有475例(99.8%)和234例(98.7%)患者纳入安全性分析。
患者年龄、性别、吸烟状态及先前使用化疗的情况等基线特征在两组间分布均衡(表1)。
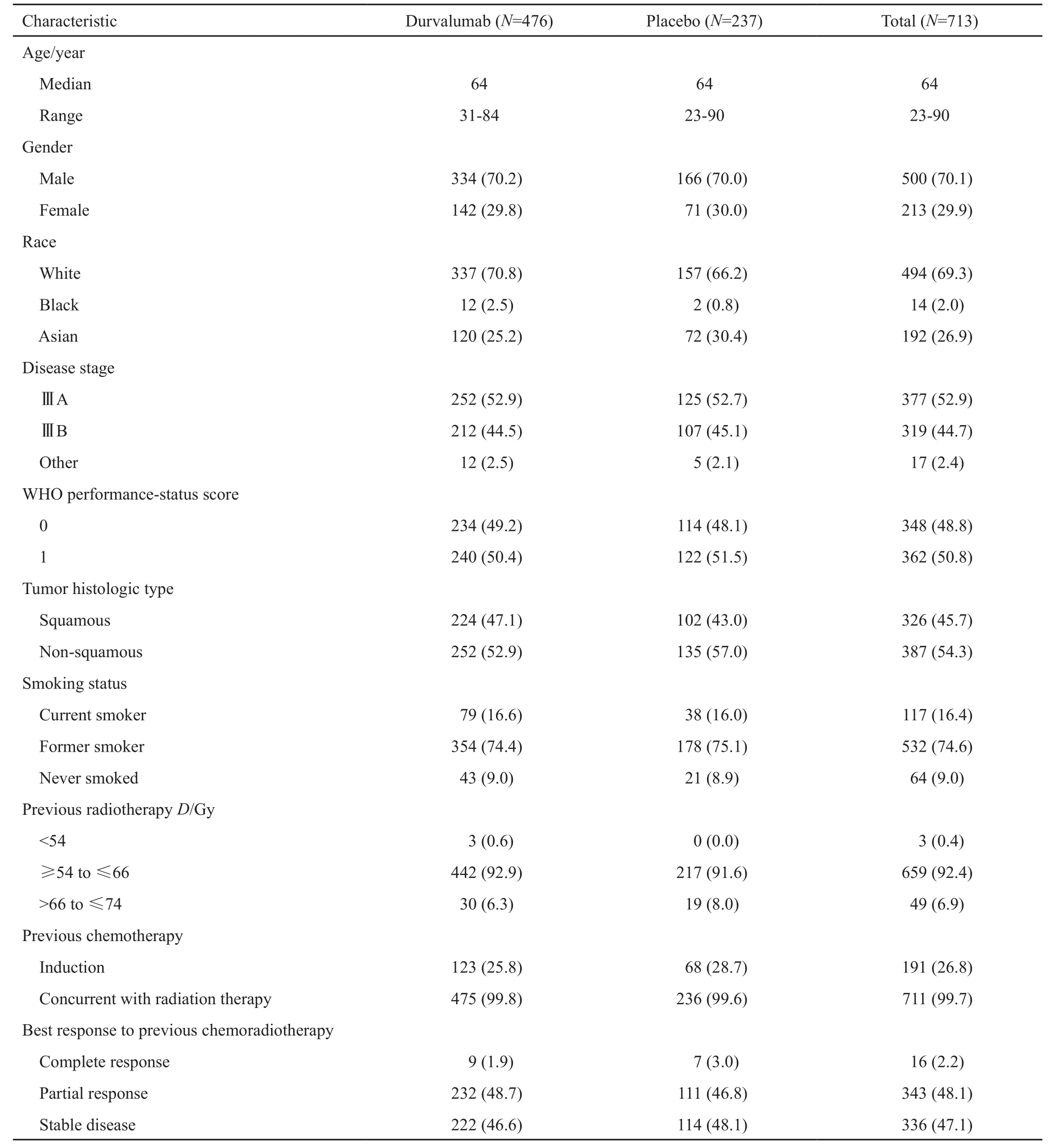
表 1 ITT人群的基线特征、分层因素和既往治疗Tab. 1 Baseline characteristics, stratification factors and prior therapy in the ITT population[n (%)]
结果显示,299例患者(durvalumab组183例,安慰剂组116例)发生死亡,OS的中位随访时间为25.2个月。与安慰剂相比,durvalumab显着延长了OS(HR=0.68;99.73%CI:0.470~0.997;P=0.002 5),达到了研究预设的OS期中分析检验水准0.002 74,durvalumab组较安慰剂组死亡风险降低了32%(图3)。两组中位PFS分别为17.2和5.6个月(HR=0.51;95% CI:0.41~0.63)。此外,durvalumab组1年OS率(83.1% vs 75.3%)和2年OS率(66.3% vs 55.6%)同样具有明显优势。
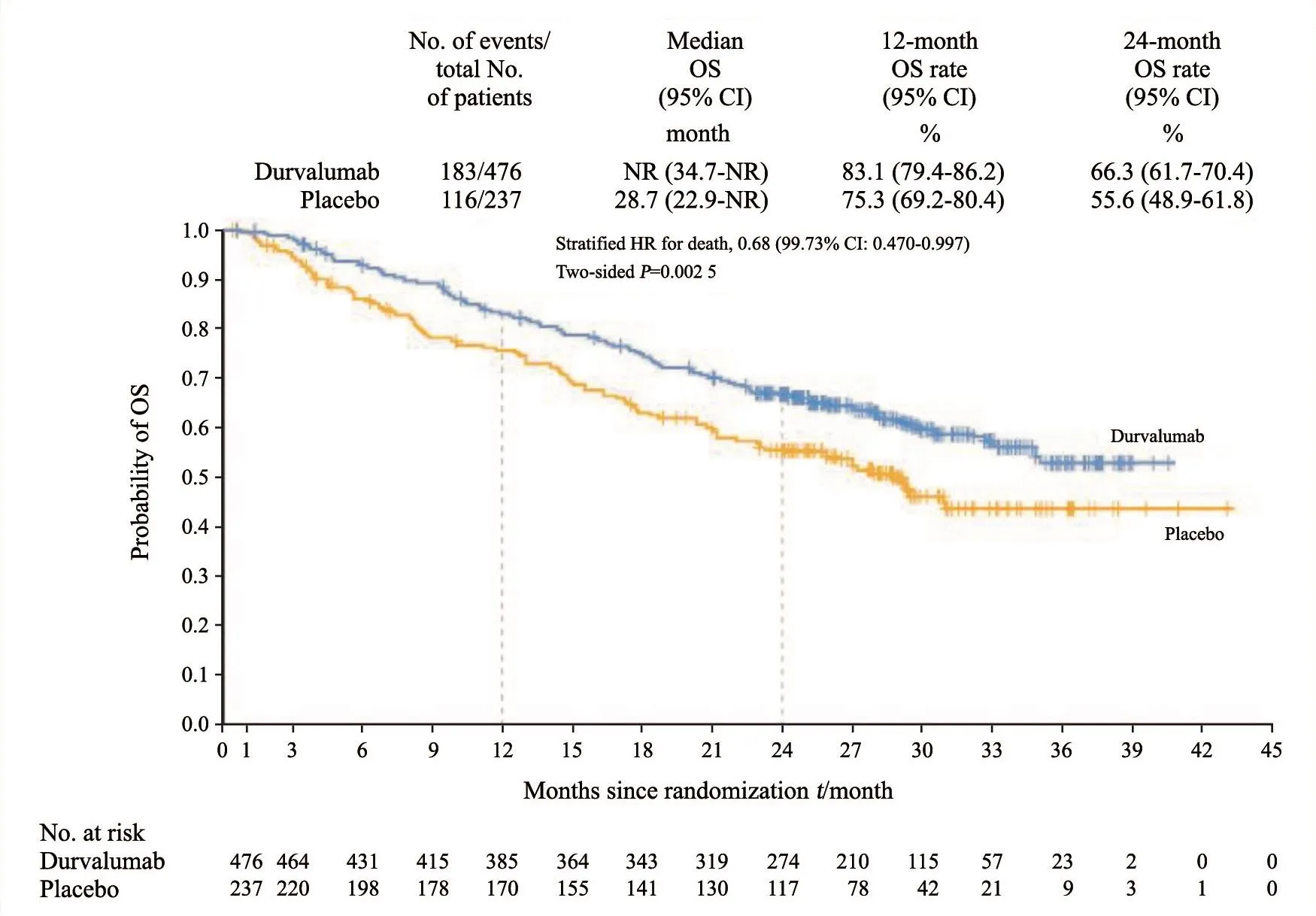
图 3 ITT人群的OSFig. 3 OS in the ITT population
Durvalumab组的远处转移或死亡时间长于安慰剂组,中位数分别为28.3和16.2个月(HR=0.53;95% CI:0.41~0.68,图4)。Durvalumab组出现新病变的频率(22.5% vs 33.8%)和发生新发脑转移的频率(6.3% vs 11.8%)也比安慰剂组低。此外,两组的ORR分别为30.0%和17.8%(P<0.001)。18个月时持续缓解率分别为73.5%和52.2%。
安全性分析显示,两组不良反应的发生率差异无统计学意义,安全性与先前报道的一致。两组最常见的3/4级不良事件是非感染性肺炎(4.8% vs 2.6%)、放射性肺炎(1.3% vs 1.3%)和感染性肺炎(1.1% vs 1.3%)。两组分别有29.1%和23.1%的患者出现严重不良反应,不良反应导致死亡分别为4.4%和6.4%。
5 讨论与思考
在PACIFIC试验的最新分析中,对于无法手术切除的Ⅲ期NSCLC患者,durvalumab的主要终点OS明显长于安慰剂。两组之间的中位PFS差异仍然超过11个月,OS分析结果表明,PFS获益已转化为OS的显著延长。该结果与先前报道的Ⅲ期NSCLC患者的PFS与OS之间的关联一致[19]。此外,在所有预先指定的亚组中观察到durvalumab均延长OS。
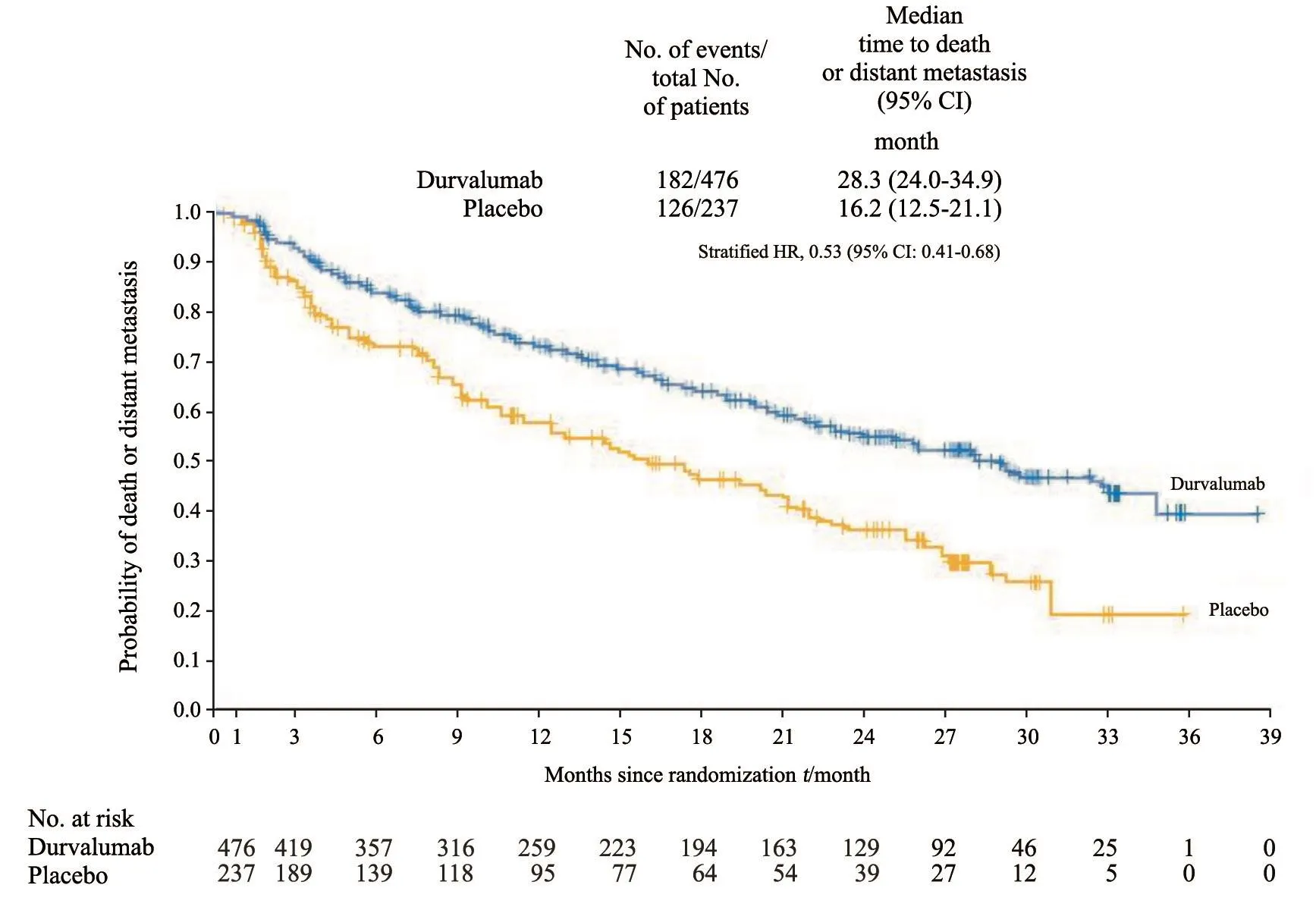
图 4 ITT人群中死亡或远处转移时间的最新分析Fig. 4 Updated analysis of time to death or distant metastasis in the ITT population
次要终点的最新结果包括死亡或远处转移时间、新病变的发生率和ORR,与先前报道的一致,并继续显示诱导治疗后患者使用durvalumab治疗的抗癌活性及其预防远处转移扩散的有效性,这可能有助于解释观察到的生存获益。此外,durvalumab治疗的患者出现第2次进展或死亡的时间更长,第1次后续治疗或死亡的时间更长及第2次后续治疗或死亡的时间更长,这些结果显示durvalumab治疗的长期获益。
Durvalumab在该人群中的安全性与其他免疫治疗的安全性一致,并与其作为单药治疗用于分期更晚(ⅢB期或Ⅳ期NSCLC)的患者后获得的安全性一致[20]。在该研究中,尽管因任何原因所导致的某些不良反应(包括非感染性肺炎或放射性肺炎)的发生率在durvalumab组和安慰剂组中均有所增加,但这符合确定性放化疗后的预期状况。而且durvalumab组患者的非感染性肺炎或放射性肺炎大部分为低级别,具有临床意义的3/4级非感染性肺炎或放射性肺炎的发生率在2组中相似,且比对相同疾病进行的其他研究中的发生率低[8,21]。综上,这些数据提示,在放化疗后使用durvalumab,其不良反应是可控制的。尽管由于先前试验在区分或分配某些不良事件的因果关系或确定其发生的风险因素方面受到限制,导致其治疗的数据不完整,但这些发现有助于定义在放化疗后使用durvalumab的安全范围。
尽管PACIFIC研究获得了OS和PFS双阳性的结果,但该研究并非完美无瑕。首先,Ⅲ期NSCLC面临的一大挑战是缺乏“局部晚期”和“不可切除”的标准定义,依据目前Ⅲ期NSCLC的实践指南[22-23],本研究中不确定是否所有患者均接受了适当的评估,包括支气管镜检查或纵隔镜检查、PET/CT检查、纵隔淋巴结病理学检查和脑部MRI,鉴于这组患者的临床和预后异质性以及分期,多学科评估和治疗方法的局部变化,尚不能确定该试验是否包括隐匿性Ⅳ期疾病的患者,在这种情况下,关于durvalumab的疗效证据或缺乏证据的任何结论都可能因为纳入患有临床隐匿性Ⅳ期疾病的患者而受到影响。其次,PD-L1检测并非本研究所必需,亚组分析中37%的患者因为没有提供肿瘤组织样本而使PD-L1表达状态未知,其他有组织标本的PD-L1<1%和EGFR阳性的患者似乎不能从durvalumab治疗中获益,由于例数太少,仍需后续研究证实。第三,Adams等[24]发现约30%的NSCLC患者在放疗后14~21 d外周血的循环肿瘤细胞中PD-L1表达显著增加,提示本研究中随机化时间与PD-L1表达存在相关性,尤其是安慰剂组中的ORR(17.8%)和不良反应发生率(49.1%)可能更会受到最近的放化疗影响,在这种情况下,可以考虑在放化疗后14~21 d内重新评估PD-L1表达水平,以确定可能受益于durvalumab的患者。
总之,该试验显示在无法手术切除的Ⅲ期NSCLC患者中,同步放化疗后使用durvalumab治疗可获得生存优势,且没有带来新的不良反应。这些阳性结果是在未经选择的患者人群中获得的,且与基线时肿瘤细胞的PD-L1表达水平无关,因此提示durvalumab可能可以作为Ⅲ期患者接受标准治疗后的一个有效的巩固治疗手段。免疫治疗与放化疗发生交互作用的潜在机制尚不明确,仍需更多研究。
