RNAi沉默rictor基因表达抑制人膀胱癌T24细胞体内外生长
2019-04-29何春锋张青川
何春锋,张青川,刘 永
1.上海中医药大学附属普陀医院泌尿外科,上海 200062;
2.上海交通大学附属第一人民医院泌尿外科,上海 200080
膀胱癌是泌尿系统常见的恶性肿瘤,其发病率呈逐年上升趋势。移行细胞癌占90%以上,具有多发性和易复发等特点。新发膀胱癌70%~80%为浅表性膀胱癌,其中10%~15%不可避免地发展为浸润性膀胱癌。研究表明,p53和PTEN基因缺失或突变导致哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的紊乱[1-2],从而引起浅表性膀胱癌的发生和促进原位癌的浸润及转移。mTOR信号通路被认为是一个调节细胞周期进程和细胞生长的信号汇聚点。mTOR在肿瘤细胞生存、生长、蛋白合成、细胞代谢及血管生成等方面发挥了关键的作用。mTOR存在形式主要有2种:mTOR复合物1(mTOR complex 1,mTORC1)和mTOR复合物2(mTOR complex 2,mTORC2)。药物雷帕霉素可阻断mTORC1,从而抑制肿瘤的生长,但其效果仍不满意。mTORC2的发现晚于mTORC1,两者共同含有哺乳动物酵母同源致命因子Sec13蛋白8(mammalian lethal with SEC13 protein 8,mLST8)和mTOR。mTORC2对雷帕霉素不敏感。mTORC2功能的发挥离不开其必需成员之一的rictor。抑制rictor的表达,从而可间接抑制mTORC2功能的发挥[3-5]。由于rictor的发现较晚,因而对mTORC2的结构和功能仍在进一步的研究中。Sarbassov等[6]发现,mTORC2复合物能够磷酸化蛋白激酶B(protein kinase B,AKT)分子中一系列的氨基酸残基,进而激活AKT。AKT在细胞分化和存活过程中扮演重要角色,许多恶性肿瘤细胞中AKT的活性都有异常升高。在体外实验中,mTOR与rictor结合后能直接磷酸化AKT的Ser473位点,与重组人丙酮酸脱氢酶激酶同工酶1(pyruvate dehydrogenase kinase isozyme 1,PDK1)一起完成对AKT的激活[6]。如果能找到一种分子来阻断肿瘤细胞中mTORC2的形成,则能够抑制AKT的激活,并阻止肿瘤的进一步形成和生长,这可能是今后肿瘤治疗的新途径。本研究以人膀胱癌细胞株T24为研究对象,采用siRNA技术抑制rictor基因表达,从而抑制mTORC2的功能,进而观察其对膀胱癌T24细胞在体内外生长的影响,进一步揭示rictor在膀胱癌进程中的作用,旨在为治疗膀胱癌寻找一种新的策略。
1 材料和方法
1.1 细胞株、菌株和质粒
人膀胱癌T24细胞株(p53缺失,G3)购自中国科学院典型培养物保藏委员会细胞库。细胞株按常规方法进行培养,采用含10%胎牛血清的RPMI-1640培养基,取对数生长期细胞进行实验。质粒载体pGCSIL-PUR购自上海吉凯基因化学技术有限公司。载体pGCSIL-PUR含嘌呤霉素的耐药基因,可在嘌呤霉素作用下筛选稳定转染的细胞株。大肠杆菌DH5α由复旦大学遗传所赠送。
1.2 真核表达载体的构建和鉴定
Rictor基因按照RNA干扰(RNA interference,RNAi)的条件设计三对干扰不同基因位点的RNA片段,分别取名为1#、2#和3#,GC%均为42.10%,该工作由上海吉凯基因化学技术有限公司负责合成。siRNA靶序列如下:1#为CAGACATAGTCCAGATACA,2#为GCCAAGTC CTTCAACATAA,3#为GCAGCCTTGAAC TGTTTAA。将目的片段插入到用AgeⅠ和EcoRⅠ进行酶切处理过的线性载体pGCSIL-PUR中获得重组载体。重组载体转化大肠杆菌,提取阳性克隆,酶切鉴定。
1.3 细胞瞬时转染
将膀胱癌细胞株T24接种于24孔板中。细胞培养使细胞密度达90%~95%。分别取1#、2#、3#和阴性对照(negative control,NC)质粒按LipofectamineTM2000说明书进行转染,转染4 h,更换培养液继续培养。检测各转染组RNA表达差异需继续培养36~48 h,检测各转染组rictor蛋白的表达差异需继续培养48~72 h。
1.4 细胞稳定转染及单克隆的扩增,稳定细胞株的筛选
将上述检测最有效干扰2#质粒与NC质粒稳定转染入膀胱癌T24细胞株中,并分别命名为RNAi组和NC组,未转染细胞命名为空白组。进而采用实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)和蛋白质印迹法(Western blot)筛选出干扰效果明显的单克隆稳定细胞株。
1.5 RTFQ-PCR和Western blot检测RNAi后rictor的表达
RTFQ-PCR按照TRIZOL试剂盒说明书进行。用RIPA裂解液提取各组细胞的总蛋白,然后采用Western blot检测细胞中rictor蛋白的表达情况。实验重复3次,结果取平均值。Rictor基因定量PCR引物由上海吉凯基因化学技术有限公司合成。上游引物:5’-AATTGGAAAAGTGGCACAGG-3’;下游引物:5’-GGCAGCCTGTTTTATGGTGT-3’。
1.6 细胞计数试剂盒(cell counting kit-8,CCK-8)实验检测细胞增殖
取96孔板按照实验分组培养细胞,细胞分为空白组(T24)、NC组、2#-1组和2#-2组。每组设6个平行样本,结果取平均值。取细胞贴壁后0、24、48和72 h等时间点检测吸光度(D)值。置酶标仪上测各孔D值,空白对照孔调零,滤过波长为450 nm。以下列公式计算抑制率:抑制率(CI,%)=(对照组D值-实验组D值)/对照组D值×100%。
1.7 细胞划痕实验
细胞划痕实验是指将细胞培养在培养皿或平板上,待细胞融合后用细胞刮在中央区域画一条线,这条线内的细胞被机械力去除掉,然后将细胞继续培养,观察细胞向无细胞的划痕区域迁移的情况,来判断细胞的迁移能力。刮细胞的过程要注意保持无菌操作。
1.8 细胞周期分析及细胞存活率分析
取对数生长期的细胞,调整细胞密度为1×105个/mL。实验分为T24组、NC组、2#-1组和2#-2组。将细胞接种于6孔板中培养。在细胞汇合度约70%时处理细胞。按规定设置好仪器各参数,用流式细胞仪自带cell cycle检测软件检测细胞周期,用流式细胞仪自带cell death检测软件检测细胞的存活率,并用其自带软件进行数据分析。
1.9 裸鼠皮下移植瘤生长情况
BALB/c裸小鼠(均为雌鼠)分为4组(T24组、NC组、2#-1组和2#-2组),每组8只,分别接种4种细胞,每只裸鼠于一侧臀部接种5×106个细胞,观察裸鼠皮下肿瘤生长情况,接种后第10天开始测量,每3天测量1次瘤体长短径,并根据公式V=1/2ab2(V为体积,a为长径,b为短径)计算肿瘤体积。
1.10 统计学处理
2 结 果
2.1 成功构建真核表达载体
将筛选获得的克隆送上海吉凯基因化学技术有限公司进行测序分析证实已将针对rictor基因序列设计的3条寡核苷酸双链克隆入pGCSIL-PUR真核表达载体(图1)。
图 1 3种质粒测序图Fig. 1 Sequencing map of 3 plasmids
2.2 细胞瞬时转染筛选最有效干扰质粒2#
分别取1#、2#、3#和NC质粒各0.4 μg,分别加入无血清及无抗生素的OPTI-MEM培养液25 μL。取LipofectamineTM2000 0.7 μL各加入无血清及无抗生素的OPTI-MEM培养液100 μL,温育5 min。将上述质粒分别与LipofectamineTM2000小心混匀,室温静置20 min,形成质粒-脂质体混合物各50 μL。将上述重组质粒-脂质体混合物50 μL加入细胞培养皿中进行转染。检测各转染组rictor蛋白的表达差异。1#组、2#组和3#组rictor蛋白表达水平均降低,分别降低(28.36±5.40)%、(90.30±5.23)%和(64.90±2.74)%,与NC组和空白组相比差异有统计学意义(P<0.05,图2),其中2#的抑制最为明显。
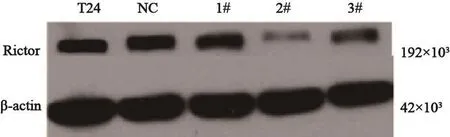
图 2 Rictor-siRNA瞬时转染后各组细胞rictor蛋白表达Fig. 2 Protein expression of rictor after transient transfection
2.3 筛选出最有效干扰质粒稳定细胞株的筛选2#-1及2#-2
将2#质粒与NC质粒转染入膀胱癌T24细胞株中,转染4~6 h后更换培养液继续培养24~48 h。1∶10传代,接着换含600 ng/μL嘌呤霉素的10%胎牛血清的RPMI-1640培养基进行筛选20 d左右,空白组细胞全部死亡,RNAi组和NC组均有细胞克隆形成。当细胞克隆长至直径约0.5 cm时,挑取单细胞阳性克隆继续在含600 ng/mL嘌呤霉素和10%胎牛血清的RPMI-1640培养基中扩大培养。
2.3.1 Western blot 检测rictor蛋白水平
将2#质粒进行稳定细胞转染,筛选了两株单克隆细胞,分别命名为2#-1组和2#-2组。Western blot结果显示,2#-1组和2#-2组rictor蛋白水平均降低,分别降低(95.71±2.40)%和(78.89±4.80)%,与NC组和空白组相比差异有统计学意义(P<0.01)。其中2#-1稳定株的抑制最为明显,其次为2#-2稳定株(图3)。
2.3.2 RTFQ-PCR检测rictor mRNA表达
对所采集的各数据以空白组为参照,用2-△△Ct的方法进行相对定量分析,2#-1组和2#-2组rictor mRNA表达量分别为0.103±0.035和0.287±0.030,与NC组和空白组相比差异有统计学意义(P<0.01);NC组和空白组相比差异无统计学意义(P>0.05,图4)。
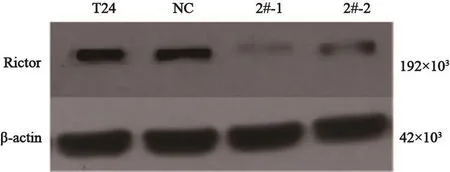
图 3 Rictor-siRNA稳转后各组细胞rictor蛋白水平Fig. 3 Protein level of rictor after stable transfection
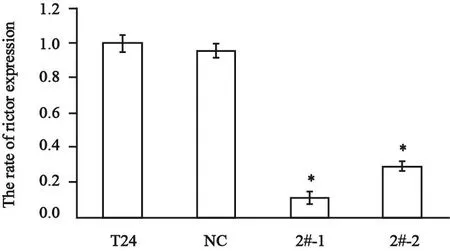
图 4 Rictor-siRNA稳转后各组细胞rictor的mRNA表达Fig. 4 The mRNA expression of rictor after transient transfection
2.4 沉默rictor基因显著抑制膀胱癌T24细胞株的体外增殖
将4组细胞分别接种于4块96空板中,每孔加入100 μL 3 000个细胞。每个固定时间点检测1块96空板。使用酶标仪在450 nm波长时测定D值。2#-1细胞株体外增殖最慢,2#-2次之,空白组(T24)和NC组无显著差异(图5)。观察发现在48 h时细胞抑制率最高,2#-1和2#-2抑制率分别达到(42.68±4.57)%和(33.94±2.06)%。由此可见,沉默rictor基因表达能显著抑制膀胱癌T24细胞株的体外增殖。

图 5 Rictor-RNAi对T24细胞株体外增殖的影响Fig. 5 The effects of rictor-RNAi on cell proliferation in T24 cell lines
2.5 沉默rictor基因表达显著抑制膀胱癌T24细胞株的迁移能力
在6孔板每孔中加入约5×105个细胞,过夜能铺满。第2天用移液器吸嘴比着直尺,尽量垂至于背后的横线划痕。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入培养箱培养,按0、12和24 h取样,在倒置显微镜下观察刮痕内细胞。4组比较,空白组和NC组24 h时可见刮痕内细胞已与周边基本融合,刮痕边界消失;而2#-1组和2#-2组仍可见清晰刮痕(两者相比,2#-2组迁移较快),说明rictor-RNAi可明显抑制T24细胞的迁移率。不同时间点所拍摄细胞迁移图片见图6。
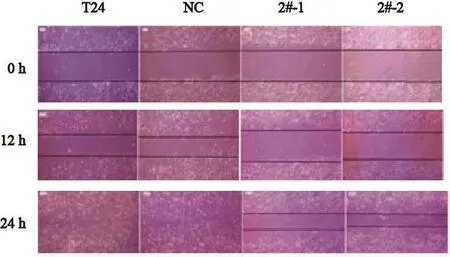
图 6 Rictor-RNAi对细胞迁移的影响Fig. 6 The effect of cell migration after rictor-RNAi
2.6 沉默rictor基因表达有效阻滞膀胱癌T24细胞株细胞周期的进展
实验分为空白组、NC组、2#-1组和2#-2组。取对数生长期的细胞,胰酶消化,制成细胞密度为1×105个/mL悬液。将细胞接种于6空板中,在细胞汇合度约70%时收集细胞并处理。按规定设置好仪器各参数,用流式细胞仪自带Cell circle检测软件检测细胞周期,并用其自带软件进行数据分析。Rictor-RNAi可抑制mTORC2功能的发挥,使靶细胞停滞于G1期,最高达(62.22±4.22)%。与空白组和NC组相比,2#-1组和2#-2组G1期细胞比例显著增加(P<0.05,图7,表1),提示rictor-RNAi能有效阻滞细胞周期的进展,从而抑制细胞增殖。
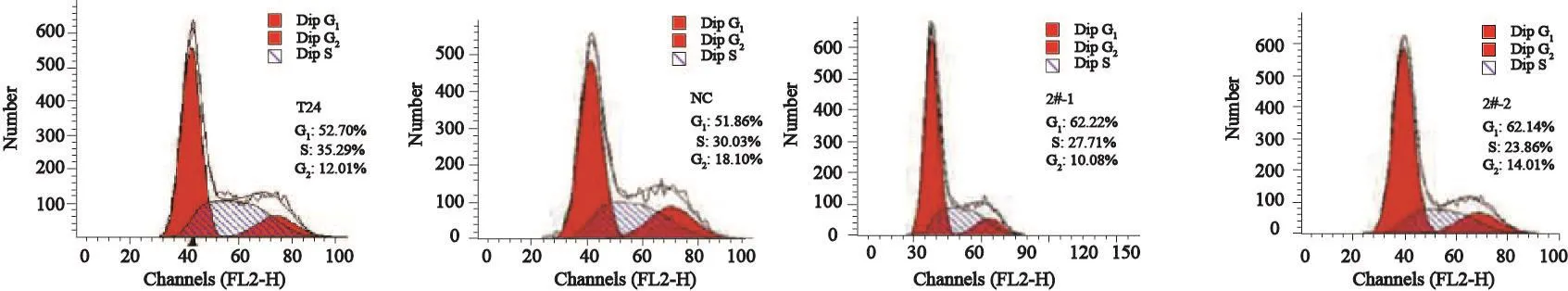
图 7 Rictor-RNAi对T24细胞周期的影响Fig. 7 The effect of rictor-RNAi on cell cycle in T24 cells

表 1 Rictor-RNAi对T24细胞G1期的影响Tab. 1 The effect of rictor-RNAi on G1 phase in T24 cells
2.7 沉默rictor基因表达显著提高膀胱癌T24细胞死亡率
取对数生长期的细胞,调整细胞密度为1×105个/mL。实验分为空白组、NC组、2#-1组和2#-2组。将细胞接种于6空板中培养。在细胞汇合度约70%时收集并处理细胞。按规定设置好仪器各参数,用流式细胞仪自带Cell Death检测软件检测细胞的存活率,并用其自带软件进行数据分析。Rictor-RNAi单独作用可明显抑制细胞存活,细胞死亡率最高达(21.42±3.60)%,较空白组(9.85±2.50)%及NC组(9.78±3.45)%明显升高(P<0.05,图8,表2)。提示沉默rictor基因表达显著提高膀胱癌T24细胞死亡率。
2.8 沉默rictor基因表达显著减缓裸鼠皮下移植瘤生长速率
裸小鼠皮下移植瘤生长31 d时,移植瘤的平均体积,2#-1组[(200±10.99)mm3]和2#-2组[(294.71±33.43)mm3]明显低于空白组[(1 3 8 6.7 6±9 8.8 0)m m3]和N C组[(1 375.00±100.04)mm3],2#-1组和2#-2组与空白组和NC组比较,差异有统计学意义(P<0.001),而空白组与NC组组间差异无统计学意义(P>0.05,图9~10),说明所用质粒在体内亦没有明显影响细胞的生长。实验证明沉默rictor基因表达能够显著减缓裸鼠皮下移植瘤生长。
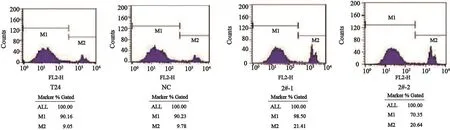
图 8 Rictor-RNAi对T24细胞死亡的影响Fig. 8 The effect of rictor-RNAi on cell death in T24 cells

表 2 rictor-RNAi对T24细胞死亡的影响Tab. 2 The effect of rictor-RNAi on cell death in T24 cells
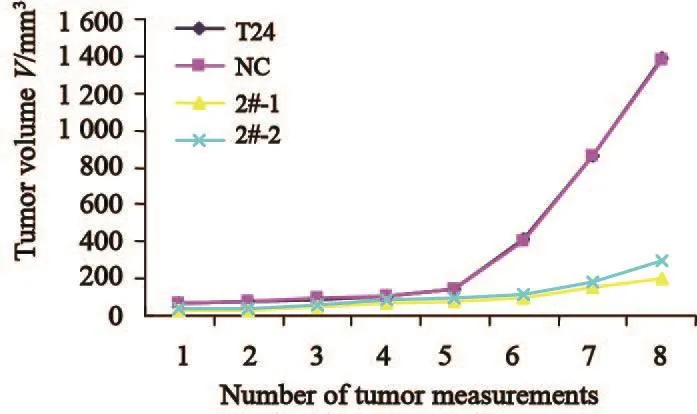
图 9 裸鼠皮下移植瘤生长曲线Fig. 9 The growth curve of subcutaneous xenograft tumor in nude mice
3 讨 论
雷帕霉素靶蛋白(target of rapamycin,T O R)属于磷酸肌醇激酶相关蛋白激酶(phosphoinositide kinase-related kinase,PIKK)超家族,作为丝氨酸/苏氨酸蛋白激酶发挥作用,首先在酵母中发现,随后在哺乳动物中也发现其同源物,即mTOR。mTOR信号通路控制细胞内mRNA的翻译,参与膜蛋白转运、蛋白质降解、蛋白激酶C信号转导和核糖体合成等一系列生理病理过程[7-9]。mTOR形成mTORC1和mTORC2两种复合物发挥生理病理作用。mTORC2包含mLST8、mTOR、rictor蛋白等[10-11]。其中rictor为mTORC2行使功能所必需的分子。因FKBP12-雷帕霉素复合物不能够结合在mTORC2上,mTORC2对雷帕霉素的治疗不敏感[12-13]。目前研究表明,mTORC2参与细胞骨架蛋白的构造[14-15]、维持细胞生存及参与细胞代谢等。目前仅能推测调节mTORC1的因素,如生长因子和营养水平,并不影响mTORC2的活性。mTOR复合物的总量保持相对稳定,提示二者之间可能存在某种相互制约的关系[6]。对mTORC2功能的研究有助于进一步了解肿瘤的发病机制,从而有助于设计新的治疗这些疾病的药物。

图 10 裸鼠皮下移植瘤实验瘤体图Fig. 10 The tumor diagram of subcutaneous xenograft tumor in nude mice
本研究以人膀胱癌T24细胞株为研究对象,采用siNRA技术抑制rictor基因表达,可间接抑制mTORC2功能的发挥,从而观察其对膀胱癌T24细胞在体内外生长的影响。本研究显示,RNAi组细胞增殖及细胞迁移明显减慢,rictor基因表达抑制比例增加,其细胞增殖和迁移减慢比例亦增加。同时RNAi组G1期细胞比例增加,RNAi后死亡细胞比明显增加,约21.42%。裸鼠皮下移植瘤生长实验示接种31 d时,移植瘤的平均体积,2#-1组和2#-2组明显低于空白组和NC组。
综上所述,rictor-RNAi沉默膀胱癌细胞rictor基因的表达能抑制膀胱癌细胞的增殖、迁移,促进细胞死亡,并使细胞停滞在G1期,并能有效地抑制裸鼠移植瘤的生长,这为膀胱癌的基因治疗或药物治疗提供了一定的实验依据,同时为以mTORC2为靶标治疗膀胱癌的策略提供了新思路。
