阿帕替尼联合吉西他滨对Lewis肺癌的实验研究
2019-04-01秦蓉声
李 源,秦蓉声,范 娟
(西南医科大学附属医院肿瘤科,四川 泸州 646000)
血管内皮生长因子(vascular endothelial growth factor,VEGF)又称血管通透因子,是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用,因此VEGF信号通路在血管生成过程中发挥重要作用[1]。多项研究显示[1-2],血管生成是肿瘤生长和转移的必要条件,抑制肿瘤血管形成,阻断肿瘤营养的供给,即可达到抑制肿瘤生长的目的,因此抑制肿瘤新生血管生成已成为目前治疗肿瘤相关疾病的重要手段之一。阿帕替尼,一种口服的新型的小分子酪氨酸激酶抑制剂,主要与血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)结合,从而抑制VEGFR-2磷酸化,以达到抑制血管生成的目的[3-4]。阿帕替尼主要用于晚期胃癌的治疗,但相关研究已证明其对肺癌具有明显的抑制作用[5]。肺癌作为一种常见的恶性肿瘤,发病率及病死率长期居第1位[6]。肺癌的常见治疗手段包括手术、放疗、化疗及靶向治疗,其中化疗是大多数晚期肺癌的主要治疗手段,吉西他滨、紫杉醇、顺铂等均是肺癌常用的化疗药物,尽管可选择的化疗方案多样,但由于患者不耐受以及耐药问题的出现,单纯化疗疗效仍欠佳。目前国内外有关阿帕替尼联合化疗治疗肺癌的研究较少,本实验旨在阿帕替尼联合吉西他滨作用于Lewis肺癌的抑制作用及可能机制,为临床研究提供理论依据。
1 材料与方法
1.1材料 Lewis细胞由西南医科大学附属医院实验中心提供。C57/BL6小鼠28只,雌性,6~8周龄,体重18~22 g,购自重庆腾鑫生物生物技术有限公司,在无特定病原体级条件下统一饲养[实验动物许可证编号:SYXK(渝)2015-0002]。RPMI-1640培养基购自美国Sigma公司,甲磺酸阿帕替尼片由江苏恒瑞医药股份有限公司提供,VEGFR-2抗体购自德国Bio-world公司。
1.2方法
1.2.1Lewis肺癌模型建立与实验设计 取处于对数期Lewis肺癌细胞,调整细胞浓度至1×106个/mL,以0.1 mL/只接种于C57/BL6小鼠右大腿。肿瘤体积增长到100~200 mm3(接种前通过细胞计数板对细胞悬液计数,接种时确保细胞悬液无外渗,以确保每只小鼠成瘤;接种后隔天观察小鼠,用游标卡尺测量小鼠瘤体积,约10 d 28只小鼠均成瘤),采用随机数字法分为空白对照组、阿帕替尼组、吉西他滨组、阿帕替尼联合吉西他滨组,每组7只。空白对照组:0.9%氯化钠注射液0.2 mL/d,灌胃,第1~7天;阿帕替尼组:阿帕替尼200 mg/(kg·d),灌胃,第1~7天;吉西他滨组:吉西他滨50 mg/(kg·d),腹腔注射,每周2次;阿帕替尼联合吉西他滨组:阿帕替尼200 mg/(kg·d),灌胃,第1~7天,吉西他滨50 mg/(kg·d),腹腔注射,每周2次。成瘤后隔天采用游标卡尺测量肿瘤的最长径及最短径,根据公式V=1/2ab2(a:最长径,b:最短径)计算瘤体积[7]。治疗结束次日每组随机选取3只行小动物正电子发射计算机断层显像(positron emission tomography,PET)/CT。治疗后第13天采用颈椎脱臼法处死所有小鼠,处死后取出肿瘤组织,行免疫组织化学法检测,计算肿瘤生长抑制率:(对照组平均瘤体积-治疗组平均瘤体积)/对照组平均瘤体积(×100%)[7]。
1.2.2PET/CT扫描 治疗结束次日,每组随机选取3只,禁食6~8 h,次日予以1%戊巴比妥钠腹腔注射麻醉,麻醉满意后,经尾静脉注氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)150~200 uCi 30 min后,固定于PET扫描架上扫描,获得衰减校正后小鼠18F-FDG 分布融合图像,沿肿瘤边缘勾画感兴趣区后通过计算机测出肿瘤最大标准化摄取值(standardized uptake value max,SUVmax)。
1.2.3免疫组织化学检测 小鼠处死后立即取出肿瘤组织,用4%甲醛溶液固定、石蜡包埋,采用链霉素抗生物素蛋白-过氧化物酶链免疫组织化学法检测VEGFR-2,所有操作严格按照试剂何说明书进行。结果判定[8]:以VEGFR-2阳性所占百分比作为标准,在低倍镜(×100)下随机选择5个VEGFR-2密集分布区域,再在高倍镜(×400)下计数,棕黄色或棕褐色为阳性,淡黄色或无色为阴性。

2 结 果
2.1荷瘤小鼠一般情况 阿帕替尼组、吉西他滨组、阿帕替尼联合吉西他滨组小鼠肿瘤生长均受到不同程度抑制,见图1。空白对照组、阿帕替尼组一般情况可,饮食,大便正常,未见消瘦、皮下脂肪减少,吉西他滨组、阿帕替尼联合吉西他滨组出现一过性消瘦,皮下脂肪减少,但整个实验期间未出现小鼠死亡事件。
2.2小鼠肿瘤生长情况 空白对照组、吉西他滨组、阿帕替尼组、阿帕替尼联合吉西他滨组肿瘤体积分别为(5 010±334) mm3、(3 101±217) mm3、(3 413±349) mm3、(2 063±289) mm3,各组比较差异有统计学意义(F=114.393,P<0.01),吉西他滨组、
阿帕替尼组、阿帕替尼联合吉西他滨组肿瘤体积小于空白对照组(P<0.01),阿帕替尼联合吉西他滨组小于吉西他滨组和阿帕替尼组(P<0.01),而阿帕替尼组和吉西他滨组肿瘤体积比较差异无统计学意义(P>0.05)。吉西他滨组、阿帕替尼组、阿帕替尼联合吉西他滨组抑制率分别为38.1%、31.9%、58.5%。见图1。

图1 各组小鼠肿瘤生长曲线图
2.3PET/CT扫描结果 空白对照组、吉西他滨组、阿帕替尼组、阿帕替尼联合吉西他滨组SUVmax值分别为4.08±0.26、3.53±0.19、3.33±0.22、2.28±0.18,各组比较差异有统计学意义(F=36.914,P<0.01),吉西他滨组、阿帕替尼组、阿帕替尼联合吉西他滨组SUVmax值均低于空白对照组(P<0.01),阿帕替尼联合吉西他滨组低于吉西他滨组和阿帕替尼组(P<0.01),而阿帕替尼组与吉西他滨组比较差异无统计学意义(P>0.05)。见图2。
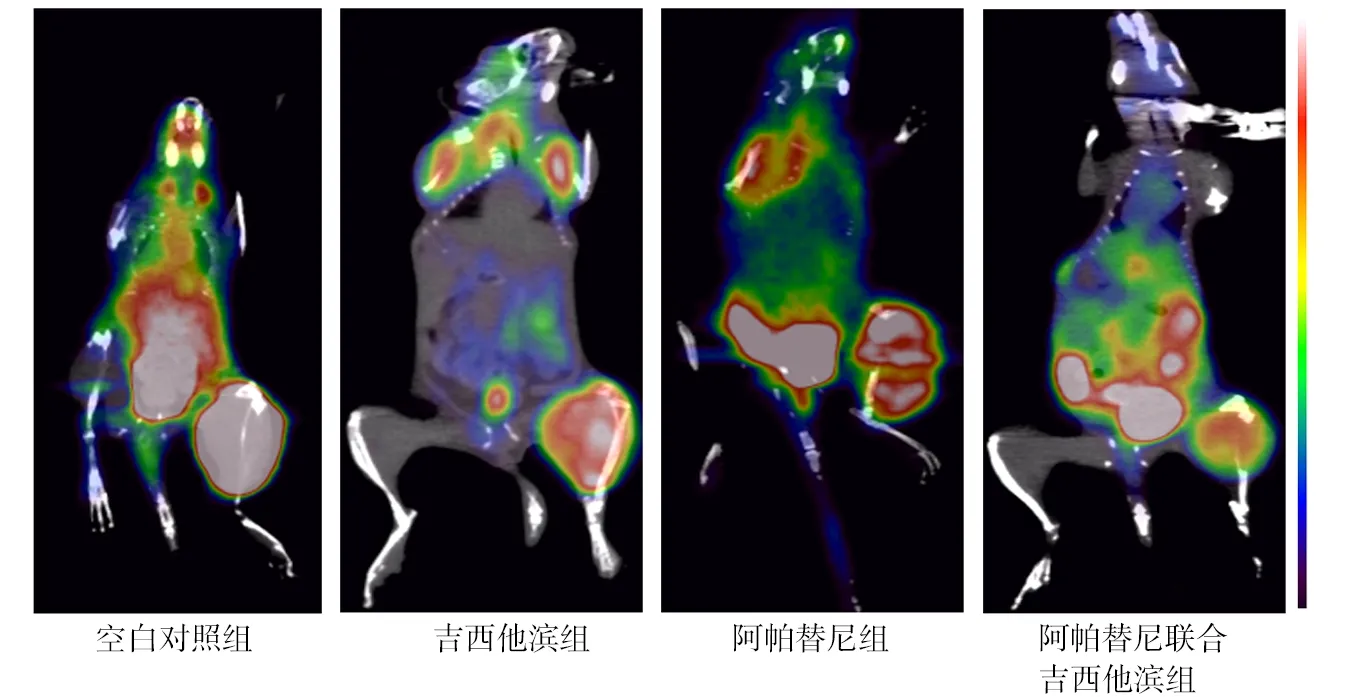
图2 各组荷瘤小鼠PET/CT图像
2.4免疫组织化学结果 空白对照组、阿帕替尼组、吉西他滨组、阿帕替尼联合吉西他滨组VEGFR-2阳性表达率平分别为(90±6)%、(61±8)%、(86±6)%、(29±7)%,各组比较差异有统计学意义(F=117.293,P<0.01),阿帕替尼组、阿帕替尼联合吉西他滨组低于空白对照组和吉西他滨组(P<0.01),阿帕替尼联合吉西他滨组低于阿帕替尼组(P<0.01),但吉西他滨组与空白对照组比较差异无统计学意义(P>0.05)。见图3。
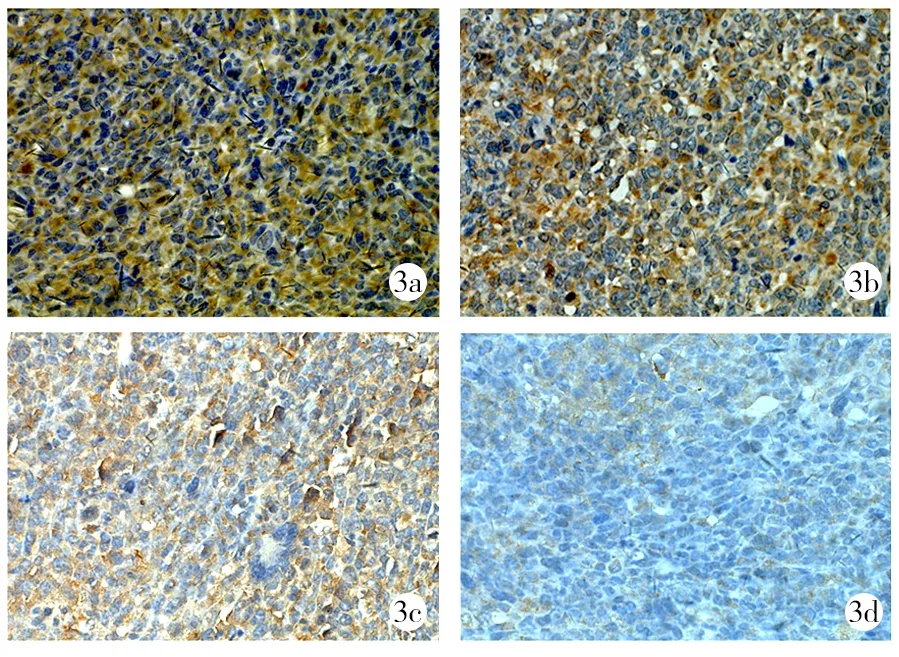
3a:空白对照组;3b:吉西他滨组;3c:阿帕替尼组;3d:阿帕替尼联合吉西他滨组
图3各组免疫组织化学血管内皮生长因子受体2阳性表达(×400)
3 讨 论
长期以来,肺癌的发病率居我国第1位,其中80%为非小细胞肺癌[6],由于其恶性程度高,且大部分患者发现时已处于晚期,化疗成为大部分肺癌患者的主要治疗手段,然而由于化疗药物的不良反应以及肿瘤血管的无序性阻碍了化疗药物进入肿瘤组织等使化疗的治疗效果受到一定程度的限制[9-10]。
随着Folkman“饿死肿瘤”理论的提出[1,11],发现肿瘤血管形成可以为肿瘤提供营养,这成为肿瘤生长、侵袭、转移的重要条件,因此抑制肿瘤血管生成即可达到抑制肿瘤生长的目的。Escudier等[12]研究发现索拉菲尼可以延长晚期肾癌患者的无进展生存率,相关研究也表明舒尼替尼可明显提高肿瘤患者的生活质量[10],由此可见抗血管生成治疗在肿瘤的治疗中取得了良好的疗效。阿帕替尼作为我国自主研发的新型抗血管生成药物,在晚期胃癌的治疗中取得良好疗效。而相关研究表明,阿帕替尼对非小细胞肺癌、乳腺癌、肝癌、结肠癌也表现出显著的疗效[13-16]。目前晚期非小细胞肺癌的主要治疗手段包括化疗及酪氨酸激酶抑制剂靶向治疗,吉西他滨作为非小细胞肺癌一线用药,为细胞周期特异性抗代谢药物,主要作用于DNA合成期,常与铂类药物联合化疗,然而部分患者身体不能耐受联合化疗,因此降低了肺癌患者的疗效。研究证实抗血管生成可以提高化疗疗效[17],因此本研究将阿帕替尼与化疗药物吉西他滨联合应用,初步探讨其对非小细胞肺癌移植瘤的治疗效果。
本研究结果显示,阿帕替尼组肿瘤生长曲线较空白对照组明显延缓,与Wu等[18]关于阿帕替尼Ⅱ期临床试验结论类似,均证实了阿帕替尼对晚期非小细胞肺癌治疗有效。从本研究中的肿瘤生长曲线中可以看出,阿帕替尼组和吉西他滨组较空白对照组肿瘤生长得到明显延缓,这也证实了单用阿帕替尼可以抑制肿瘤的生长,同时,阿帕替尼联合吉西他滨组肿瘤生长抑制较单药组更显著,充分说明阿帕替尼联合吉西他滨治疗可明显提高抗肿瘤效应。18F-FDG是目前临床最常用的PET显像剂,18F-FDG可反映肿瘤细胞糖代谢水平,通过PET/CT探测18F-FDG SUV的大小可以反映肿瘤恶性程度。SUV值越高,糖代谢水平越高,提示肿瘤的恶性程度越高,疗效越差,否则反之[19-20]。本研究结果显示,阿帕替尼组和吉西他滨组SUVmax较空白对照组明显降低,表明在单阿帕替尼、单吉西他滨的治疗下肿瘤代谢降低,单药治疗有一定抗的肿瘤效应,而阿帕替尼联合吉西他滨组中SUVmax最低,较其他各组差异有统计学意义,再次证明阿帕替尼联合化疗药物吉西他滨具有协同抗肿瘤效应。这与Qiu等[21]的阿帕替尼联合紫杉醇在宫颈癌移植瘤治疗中产生协同效应类似。
肿瘤血管的生成受到许多促血管生成因子的调控,其中VEGF/VEGFR成为肿瘤血管生成的关键因素,通过抑制VEGF/VEGFR即可抑制肿瘤生长。VEGFR家族包括VEGFR-1、VEGFR-2、VEGFR-3,其中VEGFR-2在血管生成中发挥重要作用。阿帕替尼对细胞内VEGFR-2高度亲和,通过抑制VEGF与VEGFR-2结合,进而达到抑制血管生成“饿死肿瘤”的目的[22-24]。本研究结果显示,阿帕替尼组和阿帕替尼联合吉西他滨组VEGFR-2阳性表达率均低于空白对照组,且阿帕替尼联合吉西他滨组较阿帕替尼组降低更显著(P<0.01)。由此表明,阿帕替尼通过下调VEGFR-2表达,从而抑制肿瘤的生长,同时说明联合用药可产生联合效应,增强抗肿瘤的效果。
综上所述,阿帕替尼联合吉西他滨可以明显缩小Lewis肺癌的肿瘤体积,降低SUVmax值,两者具有协同作用,这为今后临床治疗非小细胞肺癌提供了新思路。然而,受限于研究时间、研究条件,本研究未进一步探讨其分子机制,但课题组通过查阅文献推测此种协同作用可能与阿帕替尼可以使肿瘤血管正常化有关,因为已有研究表明,肿瘤血管畸形生长可导致肿瘤组织间压力和乏氧增加,从而降低肿瘤组织对化疗药物的敏感性[25-27]。此外,本研究样本量较少,研究结论需更多大样本、多中心研究进一步论证。
