JAK2/STAT3信号转导通路在子宫内膜异位症发病过程中的作用
2019-03-07陈建梅杨蕊蕊刘洪恩刘洪欣史文新刘姣
陈建梅,杨蕊蕊,刘洪恩,刘洪欣,史文新,刘姣,4△
Janus激酶/信号转导与转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信号转导通路是近年来发现的细胞内信号转导通路,在细胞的增殖、分化以及免疫调节等生物学过程中起重要作用[1]。在STAT家族的7个成员中,对STAT3的研究最为明确。细胞质中的STAT3被JAK2激活后,进入细胞核,可通过对相关基因的直接和间接调控作用促进血管新生,诱导细胞增殖、分化或凋亡[2]。目前,关于JAK2/STAT3与肿瘤的关系受到广泛关注。子宫内膜异位症(Endometriosis,EMS)是育龄期妇女的常见疾病,近年来发病率逐年增高。EMS的发病机制至今不明,但其血管新生、细胞增殖、侵袭等生物学特性与肿瘤相似[3-4]。EMS异位内膜细胞的增殖、迁移和侵袭等可能与STAT3信号通路有关。本研究应用JAK2的特异性磷酸化抑制剂AG490干预JAK2/STAT3的激活,观察大鼠EMS异位内膜的生长情况,明确JAK2/STAT3信号通路是否参与EMS的发病过程。
1 材料与方法
1.1 材料
1.1.1 动物 Wistar大鼠,清洁级,雌性,体质量180~200 g,购自河北省实验动物中心,实验动物使用许可证:SYXK(冀)2016-0047。饲养于温度20~23℃,湿度45%~60%,过氧乙酸溶液消毒环境,标准大鼠饲料和水喂养。
1.1.2 主要试剂与仪器 AG490(JAK2/STAT3通路阻断剂,批号:T3434,Santa Cruz Biotechnology,Inc.),孕三烯酮胶囊(2.5 mg,批号:53140701,华润紫竹药业有限公司),硫酸庆大霉素注射液(2 mL,8万单位,批号:1607201,山东华鲁制药有限 公 司),雌二醇片(2 mg,批 号 :340436,Solvay Pharmaceuticals B.V.,雌二醇磨去糖衣后碾碎,用1%羧甲基纤维素钠溶液溶解),兔抗人JAK2(phospho Y1007+Y1008)多克隆抗体(ab32101,Abcam Ltd),兔抗人JAK2多克隆抗体(ab39636,Abcam Ltd),小鼠抗人STAT3(phospho Y705)单克隆抗体(SC-8059,Santa Cruz Biotechnology,Inc.),兔抗人STAT3单克隆抗体(ab68153,Abcam Ltd),兔抗小鼠GAPDH单克隆抗体(ab181602,Abcam Ltd),HRP标记兔抗小鼠IgG二抗(ab6728,Abcam Ltd),HRP标记山羊抗兔 IgG 二抗(ab97051,Abcam Ltd)。电泳仪及电泳槽(北京六一仪器厂),凝胶成像系统(BIO-RAD PACIFIC Limited)。
1.2 方法
1.2.1 造模 大鼠腹腔注射10%水合氯醛(3 mL/kg体质量),麻醉后,剖开腹部找到子宫,将右侧子宫周围组织分离,用手术线将子宫的两头结扎,两结扎处之间相距大约1 cm,剪取。把切取的子宫内膜竖向剪开,在左侧腹部的腹壁上内膜向里用缝合针和手术线打结钉上,再缝合大鼠腹部。假手术组仅进行右侧子宫的结扎和剪取,不缝合于腹壁上,其余操作同上。手术后对每只大鼠进行腹腔注射硫酸庆大霉素注射液,用药量为0.4万U/只,连续注射5 d。进行手术的次日,为加快移植子宫内膜的生长,对每只大鼠灌胃雌二醇,假手术组则灌胃等量1%羧甲基纤维素钠溶液,用药量为10 mL/kg体质量,每5 d 1次,共3次。末次灌胃雌二醇4 d后,再次麻醉大鼠,开腹后观察子宫内膜组织移植部位,若肉眼可见内膜组织生长且内有液体积聚的透明小囊,则为造模成功。
1.2.2 分组及给药 将造模成功的40只大鼠按体质量分为4个区组,然后将每个体质量范围内的大鼠采用随机数字表分为2组,分别为模型组、JAK2/STAT3通路抑制剂组(AG组),每组20只,另设假手术组大鼠20只。AG组于造模前5 min腹腔注射AG490(1 mg/kg体质量),手术后按4 mg/kg体质量注射,每周2次,连续6周,模型组给予生理盐水。
1.2.3 取材 末次给药后禁食12 h,麻醉大鼠,剖开腹部,以游标卡尺测量异位子宫内膜的长径(a)和短径(b)后取材,假手术组剪取正常子宫组织,部分组织在10%福尔马林溶液中固定,剩余组织于-80℃冻存。
1.3 检测指标
1.3.1 异位内膜体积和生长抑制率 分别按照下列公式计算异位内膜体积和生长抑制率。异位内膜体积(V)=a×b2×0.52。抑制率=(模型组平均体积-AG组平均体积)/模型组平均体积×100%。
1.3.2 组织形态学分析 取异位子宫内膜组织或正常子宫组织,常规石蜡包埋,连续切片,苏木精-伊红染色(HE),光镜观察。
1.3.3 蛋白印迹法(Western blot)检测组织中蛋白表达 取大约500 mg异位内膜组织,加入1 mL裂解液匀浆,冰上静置消除泡沫后,4℃,12 000 r/min离心5 min,取上清液加入SDS Loading Buffer,沸水浴加热5 min变性。蛋白样品进行SDSPAGE电泳,每孔上样等量总蛋白。电泳结束后,将蛋白转到PVDF膜上,5%BSA封闭2 h。随后分别加入1∶2 000的p-JAK2、JAK2、P-STAT3和STAT3多克隆抗体,以GAPDH为内参,4℃冰箱过夜。次日加入1∶2 000的HRP标记二抗,室温孵育1 h,洗膜,经ECL化学发光检测并记录各目的条带及内参条带灰度值,以目的条带与内参条带灰度比值为各目的蛋白的相对表达量。
1.4 统计学方法 采用SPSS 18.0统计学软件进行分析,正态分布的计量数据以均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠异位内膜体积的差异以及生长抑制率 模型组大鼠子宫内膜移植物体积增大,呈半透明的囊状,囊内有液体积聚,表面有血管分布,盆腔有广泛粘连;AG组大鼠子宫内膜移植物体积较小,囊内仅有少量液体或无液体,盆腔粘连轻微,见图1。测量并计算各组大鼠异位内膜体积,模型组为(155.69±137.57)mm3,AG组为(53.46±49.96)mm3,较模型组体积显著减小(t=2.210,P<0.05),异位内膜组织生长的抑制率为65.66%。
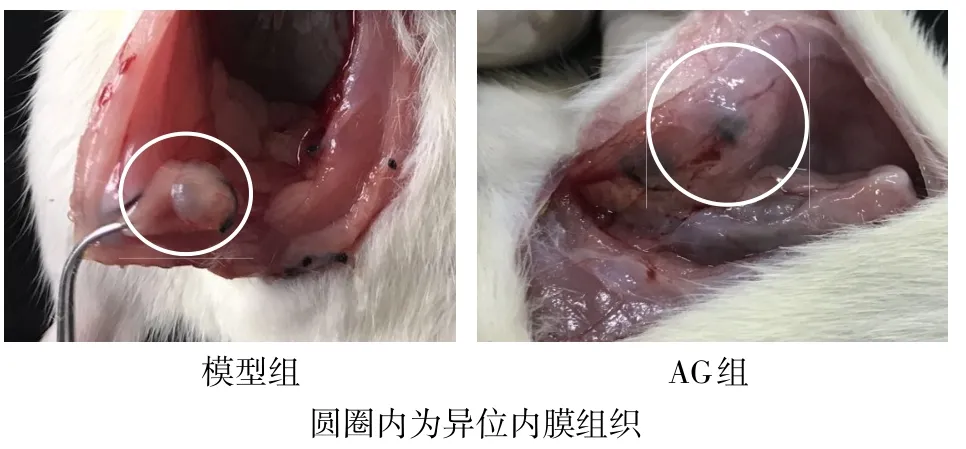
Fig.1 The appearance of rat endometrial graft图1 各组大鼠子宫内膜移植物外观
2.2 各组大鼠异位内膜组织病理形态学差异 假手术组子宫内膜被覆单层柱状上皮,排列整齐,肌层较厚;模型组异位子宫内膜被覆上皮细胞呈扁平状,腔体内有中性粒细胞聚集,血管较为丰富;AG组大鼠异位内膜表现出不同程度的变薄萎缩,上皮细胞缺失,见图2。
2.3 各组大鼠子宫内膜组织中JAK2、STAT3磷酸化水平比较 与假手术组相比,模型组大鼠异位内膜组织中JAK2、STAT3总蛋白及其磷酸化水平(p-JAK2/JAK2、p-STAT3/STAT3)均显著升高(P<0.05);与模型组相比,AG组大鼠异位内膜组织中STAT3总蛋白及其磷酸化水平均明显降低(P<0.05),AG组大鼠异位内膜组织中JAK2磷酸化水平较模型组明显降低,但其总蛋白表达与模型组相比差异无统计学意义,见表1,图3。
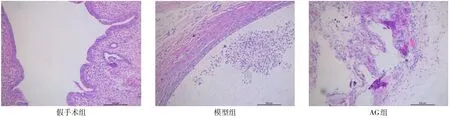
Fig.2 Pictures showing pathological morphology of ectopic endometrium in three groups(HE staining,×100)图2 各组大鼠异位内膜组织的病理形态(HE染色,×100)
Tab.1 The protein expressions of p-JAK2,JAK2,p-STAT3 and STAT3 in the endometrium tissues of rats表1 各组大鼠内膜组织中p-JAK2、JAK2、p-STAT3、STAT3的蛋白表达 (n=3,±s)

Tab.1 The protein expressions of p-JAK2,JAK2,p-STAT3 and STAT3 in the endometrium tissues of rats表1 各组大鼠内膜组织中p-JAK2、JAK2、p-STAT3、STAT3的蛋白表达 (n=3,±s)
**P<0.01;a与假手术组比较,b与模型组比较,P<0.05
p-JAK2 0.25±0.02 0.63±0.03a 0.31±0.01ab 199.89**组别假手术组模型组AG组F JAK2 0.42±0.07 0.65±0.05a 0.57±0.01a 17.43**p-JAK2/JAK2 0.61±0.13 0.97±0.12a 0.55±0.03b 14.55**p-STAT3 0.11±0.01 0.66±0.07a 0.33±0.02ab 131.90**STAT3 0.52±0.01 0.86±0.07a 0.70±0.01ab 46.02**p-STAT3/STAT3 0.21±0.01 0.77±0.02a 0.47±0.02ab 774.99**
3 讨论
EMS是一种常见的妇科疾病,在育龄期妇女中多发。由本病引起的盆腔痛、痛经、不孕等问题,给患者的工作和生活带来极大的困扰。EMS虽为良性疾病,却具有迁移、侵袭、种植、复发等类似于肿瘤的恶性生物学特征[3-4]。多年来,国内外学者一直在努力探索EMS的发病机制,以利于这一疾病的治疗。1921年Sampson提出的“经血逆流”学说,被作为经典理论,该学说认为脱落的子宫内膜碎片流入腹腔,种植在盆腔脏器表层,并在雌、孕激素的作用下不断发展形成病灶[5]。而子宫内膜能否在“异域”生长以至发病,要经过黏附、侵袭和血管形成三个复杂的病理生理过程,涉及到细胞黏附因子、侵袭因子、血管生成因子,并与信号转导密切相关[6-7]。信号转导的关键点是转录因子,这些转录因子通过调控下游基因的表达,形成与子宫内膜细胞的迁移、侵袭等生物学行为相关基因启闭的“总阀门”。如果找到某些关键的转录因子靶点,就可以阻断下游基因,引发“级联式”阻断,抑制多种基因表达,进而达到抗异位内膜细胞生长的目的。
JAK/STAT信号通路,与细胞分化、增殖、侵袭、凋亡抵抗和免疫抑制均密切相关[1-2]。STAT3是STAT家族的重要成员,受JAK2的作用,形成信号转导通路,其过度表达与肿瘤的发展密切相关。病理状态下,大量干扰素、白细胞介素-6(IL-6)、生长因子等与细胞膜上相应的受体结合,可引起细胞内JAK2的聚集、相互作用,并发生磷酸化。活化后的JAK2与细胞质内的STAT3结合,引起STAT3磷酸化[8]。STAT3被激活后,进入核内,直接或间接调控相关基因诱导细胞增殖、分化,形成新生血管。
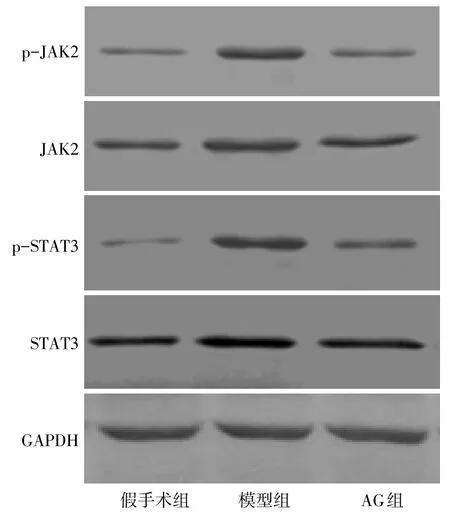
Fig.3 The protein expressions of p-JAK2,JAK2,p-STAT3 and STAT3 in the endometrium tissues of rats图3 各组大鼠子宫内膜组织中p-JAK2、JAK2、p-STAT3、STAT3的蛋白表达
为证实JAK2/STAT3信号通路在EMS发展过程中的作用,本研究采用自体移植法复制大鼠EMS模型,检测JAK2和STAT3总蛋白及其磷酸化水平,结果表明异位病灶部位JAK2和STAT3总蛋白及其磷酸化水平明显高于正常子宫组织。有研究证实,激活后的STAT3能以二聚体的形式持续进入核内,对血管内皮生长因子(VEGF)、B淋巴细胞瘤-2(Bcl-2)、基质金属蛋白酶(MMPs)等下游靶基因进行调控,导致其高表达[9-10]。VEGF能促使血管异常增生,MMPs也可在新血管生成的初期加强原有血管的重构,Bcl-2使细胞抗凋亡能力增强[11-12]。三者的高表达促进了局部病灶血管的生成和细胞增殖、侵袭和迁移,有利于EMS的发生[10]。本研究以AG490干预后,通过对这一通路的抑制,JAK2和STAT3的磷酸化水平显著降低,模型大鼠表现出异位病灶体积明显减小,病理改变情况减轻。因此推测,JAK2/STAT3信号通路在EMS的发展过程中发挥了重要作用,而抑制JAK2/STAT3信号通路则能够对EMS的治疗产生积极作用,本研究为探讨EMS的发病机制提供了实验依据,也为EMS的治疗用药研发提供了新的思路。
