大鼠Adrb3基因重组慢病毒干扰载体的构建及其对血管平滑肌细胞Adrb3表达的影响
2019-03-07宋衍秋毛用敏秦勤丛洪良
宋衍秋,毛用敏,秦勤,2,丛洪良,2
心力衰竭是各种心脏病的终末阶段,是威胁全球性公众健康的主要原因,病死率高、预后差,传统药物治疗虽能有效缓解心力衰竭的症状,降低患者住院率,但其5年病死率仍超过50%[1],未达到理想的治疗效果。β-肾上腺素受体(β-AR)是交感神经系统的重要成员,近年来在人类和动物模型中均证实衰竭心脏β3-AR表达较非衰竭心脏升高2~3倍,具有负性肌力作用[2-3],提示β3-AR可能在心力衰竭的发生发展过程中具有一定的作用。然而β3-AR在心力衰竭中具体作用尚未阐明。目前尚鲜见应用慢病毒RNA干扰(RNAi)技术研究β3-AR的相关报道。本研究旨在构建携带大鼠β3-AR基因(Adrb3)慢病毒干扰载体,可用于后续体内外实验,为进一步研究Adrb3在心力衰竭中的作用提供实验基础。
1 材料与方法
1.1 材料 慢病毒干扰载体(GV248)、慢病毒包装质粒混合物(Lenti-Easy Packaging Mix)由上海吉凯基因技术有限公司提供;293T细胞由天津市心血管病研究所保存;大鼠血管平滑肌细胞(vascular smooth muscle cells,VSMC)购自北纳创联生物技术有限公司;T4DNA ligase、AgeⅠ、EcoRⅠ核酸内切酶 、GeneJET Plasmid Miniprep Kit、RevertAid First Strand cDNA Synthesis Kit,HG-DMEM(GIBCO)、0.5%胰蛋白酶-EDTA(GIBCO)、青霉素/链霉素及胎牛血清(GIBCO)、Opti-MEM(GIBCO),LipofectamineTMLTX Reagent(Invitrogen)购自美国 Thermo Fisher Scientific公司;RNAisoTMPlus、SYBR Green qPCR MasterMix购自宝生物工程(大连)有限公司;总蛋白提取试剂盒购自北京普利莱基因技术有限公司;引物委托北京奥科鼎盛生物科技有限公司合成;小鼠抗大鼠Adrb3抗体购自美国Santa Cruz Biotechnology公司;GAPDH抗体购自武汉三鹰生物技术有限公司;羊抗小鼠HRP-IgG二抗购自武汉博士德生物工程有限公司;LumiGLO Chemiluminescent Substrate购自美国KPL公司。超滤浓缩管(Millipore,MilliporeSigma公司,美国)、核酸蛋白定量检测仪(BioPhotometer,Eppendorf公司,德国),PCR 仪(PE 9600,Eppendorf公司,德国)、低温高速离心机(5417R,Eppendorf公司,德国)、台式高速离心机(5415DR,Eppendorf公司,德国)、倒置荧光显微镜(NiKon公司,日本)、成像分析软件(SPOT Imaging公司,美国)、CO2细胞培养箱(Thermo Fisher Scientific公司,美国)、层流超净工作台、实时定量PCR仪(7500,ABI公司,美国),电泳系统(Bio-Rad公司,美国),ChemiDOCTMXRS+System(Bio-Rad公司,美国)。
1.2 方法
1.2.1 慢病毒载体质粒的构建 根据GenBank中大鼠Adrb3基因序列(NM_013108.2)设计合成2个编码短发夹RNA(short hairpin RNA,shRNA)和单链DNA寡核苷酸序列,见表1、2,由上海吉凯基因技术有限公司合成。单链DNA寡核苷酸序列退火形成双链DNA寡核苷酸序列(含有与GV248质粒AgeⅠ、EcoRⅠ双酶切后匹配的粘性末端),退火产物与AgeⅠ、EcoRⅠ双酶切线性化的GV248质粒经T4DNA ligase连接,连接产物转化DH5α感受态细胞,挑选阳性克隆,测序鉴定,测序正确者严格按照GeneJET Plasmid Miniprep Kit说明书操作,提取慢病毒载体质粒。

Tab.1 Target sequence information of rat Adrb3 gene sequence(NM_013108.2)表1 大鼠Adrb3基因序列(NM_013108.2)Target序列信息
1.2.2 慢病毒的包装、收集、浓缩 常规复苏培养293T细胞,细胞计数5×106细胞传至100 mm2培养皿,37℃、5%CO2继续培养,待293T细胞密度90%左右,拟行转染。转染前2 h更换细胞培养基为Opti-MEM。取慢病毒载体质粒Adrb3-RNAi-1、Adrb3-RNAi-2及Adrb3-RNAi-control各16 μg与25 μL Lenti-Easy Packaging Mix、12.5 μL PLUSTMReagent及相应体积Opti-MEM混合均匀,总体积为1.5 mL,室温下温育10 min。LipofectamineTMLTX Reagent 30 μL加至上述混合液中,混匀,室温静置30 min。上述转染体系混合液加至293T细胞100 mm2培养皿中,混匀,37℃、5%CO2细胞培养箱中培养。培养8 h后,弃培养基,10 mL PBS洗涤1次。更换常规DMEM培养基10 mL,继续培养。倒置荧光显微镜观察细胞形态及绿色荧光蛋白(Green fluorescent protein,GFP)表达。
转染72 h后(转染即时为0 h),分别收集293T细胞上清,获得携带rAdrb3基因慢病毒干扰载体1(Lv-rAdrb3-shRNA-1),携带rAdrb3基因慢病毒干扰载体2(Lv-rAdrb3-shRNA-2)及空载慢病毒(Lv-rAdrb3-shRNA-control);4℃、1 000 r/min离心5 min,去除细胞碎片;使用0.22 μm的滤器过滤慢病毒上清液;加入到50 mL规格的超滤浓缩管中;4℃、4 000 r/min离心30 min;所得慢病毒浓缩液分装,-80℃保存。
1.2.3 慢病毒的滴度测定 293T细胞常规培养,测定前1 d96孔细胞板铺板,每孔细胞计数5×103个,体积100 μL,拟行感染;感染前,对待测病毒进行10倍梯度稀释。8个无菌0.5 mL EP管,每管加入10%FBS的DMEM 90 μL,第1个EP管加入待测病毒原液10 μL,混匀后,从第1个管中取10 μL加入到第2个管中,以此类推直至最后1管,第1~8个EP管中加入的病毒原液量依次为:10、1、10-1、10-2、10-3、10-4、10-5、10-6μL。待感染细胞孔吸取90 μL培养基,分别加入相应量的Lv-rAdrb3-shRNA-1、Lv-rAdrb3-shRNA-2、Lv-rAdrb3-shRNA-control病毒原液,37℃、5%CO2培养;48 h后加入100 μL培养基,96 h后,观察荧光表达情况。根据慢病毒感染293T细胞第7天GFP表达情况计算病毒滴度。病毒滴度=表达GFP细胞数/病毒原液量(TU/mL)。
Tab.2 The oligonucleotide sequence of rat Adrb3 gene shRNA表2 大鼠Adrb3基因shRNA寡核苷酸序列
1.2.4 慢病毒感染VSMC 目的细胞VSMC常规培养,设置正常对照组(Normal组),空载慢病毒组(Lv-rAdrb3-shRNA-control组),携带rAdrb3基因慢病毒干扰载体1组(LvrAdrb3-shRNA-1组),携带rAdrb3基因慢病毒干扰载体2组(Lv-rAdrb3-shRNA-2组),实验前1 d,以3×105个细胞/mL接种于6孔培养板中,每孔体积为2.5 mL,37℃、5%CO2培养,感染时细胞密度达30%左右。以感染复数(Multiplicity of infection,MOI)为 10,Lv-rAdrb3-shRNA-control组、LvrAdrb3-shRNA-1组、Lv-rAdrb3-shRNA-2组分别加入50 μL相应慢病毒原液,Normal组未做任何处理。感染24 h后,更换完全培养基,感染72 h后,更换含有嘌呤霉素(5 mg/L)的培养基,继续培养;感染第5天,收集细胞到离心管中,10 000 r/min、4℃离心5 min,弃上清,1 mL PBS洗细胞2次,弃上清,细胞在-80℃冻存。
1.2.5 实时定量PCR(Real-time PCR)检测VSMC细胞Adrb3 mRNA表达水平 采用宝生物工程(大连)有限公司的UNIQ-10柱总RNA抽提试剂盒提取VSMC细胞总RNA,应用RevertAid First Strand cDNA Synthesis Kit逆转录得到cDNA。在GenBank上查找相关基因序列,按照引物设计原则设计引物序列,由北京奥科鼎盛生物科技有限公司合成,引物序列见表3。反应体系(20 μL):2×SYBR Green Mix 10 μL,ROX 0.4 μL,上下游引物(5 μmol/L)各 0.5 μL,ddH2O 7.6 μL,cDNA 1.0 μL。反应条件:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;熔解曲线分析。采用2-ΔΔCt法计算大鼠Adrb3 mRNA相对表达量。

Tab.3 The sequences and Tm of Real-time PCR primers表3 Real-time PCR引物序列及退火温度
1.2.6 Western blot检测VSMC细胞Adrb3蛋白表达水平 提取VSMC细胞总蛋白,严格按照总蛋白提取试剂盒说明书操作。BCA法测定蛋白浓度,蛋白均一化至终浓度1 g/L。配制10%SDS-聚丙烯酰胺分离胶,5%SDS-聚丙烯酰胺浓缩胶,40 μL蛋白样本,80 V进行电泳,待样品进入分离胶后,电压调至100 V,直至溴酚蓝泳至靠近凝胶下缘1.5 cm处,停止电泳;350 mA湿转100 min。5%脱脂奶粉封闭3 h;TBST洗膜3次,每次5 min;用5%脱脂奶粉稀释一抗(小鼠抗大鼠Adrb3抗体),稀释比例1∶100,4℃孵育过夜;TBST洗膜3次,每次5 min;用5%脱脂奶粉稀释二抗(羊抗小鼠HRP-IgG),稀释比例 1∶10 000,37℃孵育 2 h;TBST洗膜3次,每次5 min。LumiGLO显色。计算大鼠VSMC中Adrb3蛋白相对表达量。
1.3 统计学方法 应用SPSS 16.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒干扰质粒Adrb3-shRNA序列测序 测序结果表明,2个大鼠Adrb3-shRNA序列完全正确,无碱基丢失、错配,见图1。
2.2 慢病毒的包装 荧光显微镜下观察GFP表达,转染后第2天即可见较强的荧光表达,转染第3天,细胞产生明显皱缩变圆,出现细胞病变效应。见图2、3。
2.3 慢病毒的滴度测定 在10-5μL病毒原液孔中观察到,Lv-rAdrb3-shRNA-1组、Lv-rAdrb3-shRNA-2组均有2个表达GFP细胞,Lv-rAdrb3-shRNA-control组有5个表达GFP细胞。最终各慢病毒滴度为:Lv-rAdrb3-shRNA-1组为2×108TU/mL、Lv-rAdrb3-shRNA-2组为2×108TU/mL、Lv-rAdrb3-shRNA-control组为5×108TU/mL。见图4。
2.4 慢病毒感染大鼠VMSC 慢病毒感染VMSC后,随MOI值增加,绿色荧光表达增加,细胞病变效应增强。当MOI为10时,感染后第3天能达到80%以上的感染效率,细胞贴壁良好,未见明显病变效应。见图5、6。
2.5 Real-time PCR检测Adrb3 mRNA的表达水平 各组VSMC rAdrb3 mRNA相对表达量差异有统计学意义(P<0.05)。Lv-rAdrb3-shRNA-1组、LvrAdrb3-shRNA-2组Adrb3 mRNA水平为Normal组的 12.82%、34.73%(P<0.05);Lv-rAdrb3-shRNA-control组与Normal组相比无明显抑制作用(P>0.05)。见图7。
2.6 Western blot检测Adrb3蛋白表达水平 各组大鼠VSMC Adrb3蛋白相对表达量差异有统计学意义(P<0.05)。Lv-rAdrb3-shRNA-1组、Lv-rAdrb3-shRNA-2组Adrb3蛋白水平为Normal组的14.43%、29.96%(P<0.05);Lv-rAdrb3-shRNA-control组与Normal组相比无明显抑制作用(P>0.05)。见图8。

Fig.1 Adrb3-shRNA sequencing图1 慢病毒干扰质粒Adrb3-shRNA序列测序

Fig.2 The expression of GFP in 293T cells 2 days after transfection with Adrb3-shRNA plasmid observed by fluorescence microscopy(×40)图2 荧光显微镜观察慢病毒载体质粒转染293T细胞第2天GFP表达(×40)
Fig.3 The cell morphology of 293T cells 3 days after transfection with Adrb3-shRNA plasmid(×200)图3 慢病毒载体质粒转染293T细胞第3天细胞形态(×200)
Fig.4 The expression of GFP in 293T cells 7 days after infection with Lv-rAdrb3-shRNA observed by fluorescence microscopy(×200)图4 慢病毒滴度测定-荧光显微镜观察慢病毒感染293T细胞第7天GFP表达(×200)
Fig.5 The expression of GFP in rat VSMC cells 7 days after infection with Lv-rAdrb3-shRNA observed by fluorescence microscopy(×200)图5 荧光显微镜观察慢病毒感染VSMC第7天GFP表达(×200)

Fig.6 The cell morphology of rat VSMC cells 7 days after infection with Lv-rAdrb3-shRNA(×200)图6 慢病毒感染VSMC第7天细胞形态(×200)
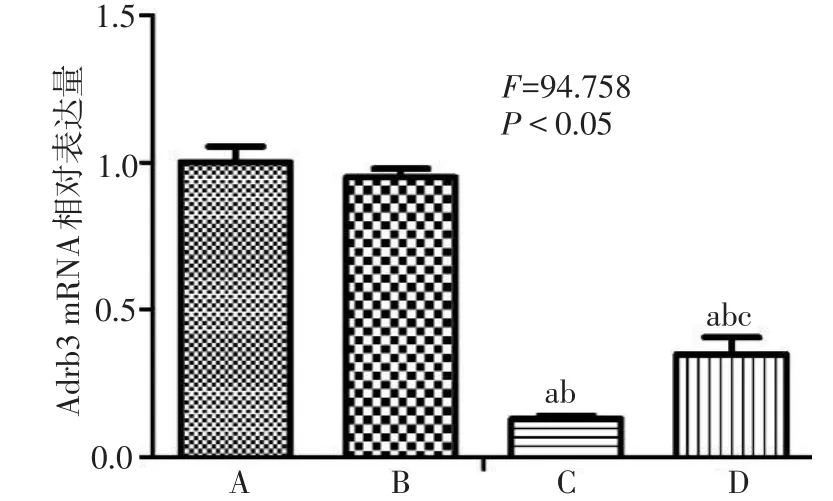
Fig.7 Adrb3 mRNA expression of rat VSMC infected with Lv-rAdrb3-shRNA图7 慢病毒感染大鼠VSMC Adrb3 mRNA表达
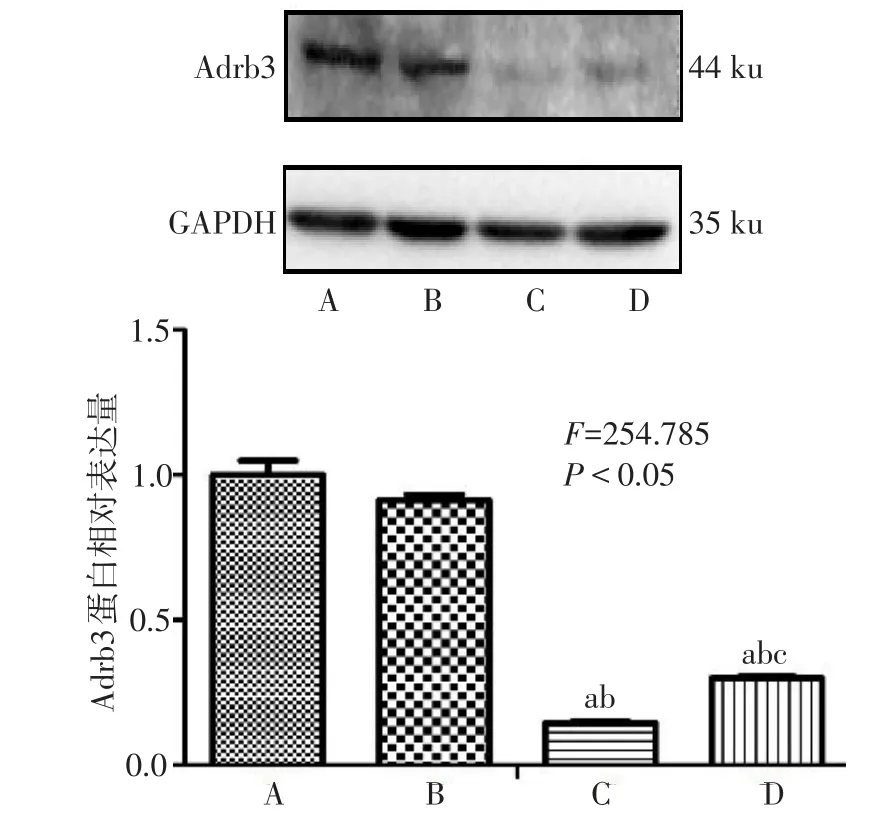
Fig.8 Expressions of Adrb3 protein of rat VSMC infected with LvrAdrb3-shRNA图8 慢病毒感染大鼠VSMC Adrb3蛋白表达
3 讨论
β3-AR与心力衰竭的发生发展密切相关,阐明β3-AR在心力衰竭中的具体作用机制,有望成为治疗心力衰竭的一个新靶点。研究证实β3-AR过表达,导致持续负性肌力作用可能是心力衰竭发生的基础。选择性β3-AR受体拮抗剂能够改善心力衰竭大鼠的心功能[4]。心肌细胞特异性过表达β3-AR转基因小鼠表现为心肌细胞肥大,心肌收缩幅度下降[5]。降低β3-AR受体活性可能是心力衰竭的一种治疗方法。然而,也有研究证实心肌细胞特异性高表达β3-AR转基因小鼠在异丙肾上腺素诱导的心衰模型中较野生型小鼠心功能改善,左室肥厚减轻[6]。可见β3-AR在心力衰竭中到底发挥何种作用尚未阐明。
RNAi是生物进化过程中出现的一种分子生物学上由双链RNA诱发的基因沉默现象,通过阻碍特定基因的转录或翻译达到抑制该基因表达的目的。随着RNAi技术的不断完善成熟,目前该技术已在疾病的诊断和治疗方面发挥着巨大的作用[7-8]。RNAi的关键因素之一就是选择合适的载体使双链RNA进入宿主细胞。常用的载体系统有病毒载体和非病毒载体。而病毒载体具有高效、低毒、大容量等一系列优点,是近年来研究的热点。主要包括:逆转录病毒载体、腺病毒载体及腺相关病毒载体等[9]。慢病毒属于逆转录病毒科,慢病毒载体具有可插入外源基因容量大,对于分裂和不分裂细胞均有感染性,能够长期稳定表达病毒基因等优点而得到广泛应用。慢病毒介导的RNAi可达到持续而稳定的目的基因沉默效应。本研究应用第三代慢病毒载体系统,由GV248、pHelper 1.0和pHelper 2.0这3个质粒共同组成。GV248质粒中含有HIV的基本元件5′LTR和3′LTR。pHelper 1.0质粒含有HIV病毒的gag基因,编码主要的结构蛋白;pol基因,编码病毒特异性酶;rev基因,编码调节gag和pol基因表达的调节因子。pHelper 2.0含有单纯疱疹病毒来源的VSV-G基因,提供病毒包装所需要的包膜蛋白。该载体系统安全性高,对分裂细胞和非分裂细胞均具有较强的感染能力,并可在体内较长期表达[10]。
目前尚未见应用慢病毒构建β3-AR干扰载体的相关报道。本研究设计2个shRNA寡核苷酸序列,应用慢病毒载体系统成功构建2个携带rAdrb3基因的慢病毒干扰载体及对照慢病毒,滴度均达到108TU/mL,并从基因、蛋白水平检测慢病毒对大鼠VSMC Adrb3表达的影响,Real-time PCR结果显示,Lv-rAdrb3-shRNA-1及Lv-rAdrb3-shRNA-2均可显著抑制Adrb3 mRNA表达,沉默效率为87.18%、65.27%;Western blot结果显示,Lv-rAdrb3-shRNA-1、Lv-rAdrb3-shRNA-2均可显著抑制Adrb3蛋白表达,沉默效率为85.57%、70.04%。
综上所述,本研究应用第三代慢病毒载体系统成功构建rAdrb3基因重组慢病毒干扰载体,其中LV-rAdrb3-shRNA-1对靶基因的抑制效率达85%以上,滴度达2×108TU/mL,LV-rAdrb3-shRNA-1能明显下调大鼠VSMC Adrb3的表达水平,为进一步研究Adrb3提供了有效的实验工具。
