新化合物OSU-03012对结肠癌细胞增殖、迁移以及凋亡的影响
2019-03-07李玉琴施建平金怒云步丽梅王凯田培营
李玉琴,施建平,金怒云,步丽梅,王凯,田培营
结肠癌(colorectal cancer,CRC)是临床上常见的消化道恶性肿瘤之一,全球每年发病例数超过100万,且大多数CRC患者确诊时已发展到疾病中晚期,即使进行手术和放化疗,远期生存率仍不乐观[1],所以从细胞分子生物学角度寻找抑制结肠癌发生、发展的方法具有一定临床意义。环氧合酶-2(cyclooxygenase-2,COX-2)是前列腺素E2合成的限速酶,通过介导磷酸肌醇3激酶/磷脂酰肌醇依赖性激酶1/蛋白激酶 B(phosphoinositide-3 kinase/phosphoinositide-dependent kinase 1/protein kinase B,PI3K/PDK1/AKT)信号通路,从而促进结肠癌发生,被视作潜在的治疗靶点[2]。新化合物OSU-03012是COX-2抑制剂Celecoxib的衍生物。研究显示,OSU-03012可在不损伤正常组织的情况下杀灭肿瘤细胞[3]。本研究拟从体外研究OSU-03012对结肠癌细胞增殖和凋亡的影响,并初步探讨其分子机制,从而为拓展OSU-03012的抗肿瘤治疗谱和研发结肠癌新的治疗策略提供参考。
1 材料与方法
1.1 主要材料 人结肠癌细胞株HCT-116购自中国科学院上海细胞库;DMEM/F-12培养液、胎牛血清购自GBICO公司;Annexin V-FITC试剂盒、Trizol试剂购自Invitrogen公司;反转录试剂盒购自Takara公司;鼠源B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体购自美国Abcam公司;CCK-8试剂盒、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记山羊抗小鼠IgG、花青素(cyanidin3,Cy3)标记山羊抗小鼠IgG等二抗购自碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养和分组 人结肠癌细胞株HCT-116以含有10%胎牛血清的高糖培养基,置于37℃、5%CO2细胞培养箱中培养,待细胞生长至70%~80%时,换不含血清的DMEM高糖培养基。分别用1、3、5和10 μmol/L OSU-03012干预(分别命名为1 μmol/L组、3 μmol/L组、5 μmol/L组和10 μmol/L组),以等体积二甲基亚砜(DMSO)处理的细胞作为对照组。
1.2.2 CCK-8法检测细胞增殖情况 HCT-116细胞用胰酶消化后离心,用完全培养基重悬,接入96孔板中,共4块,每块板铺3×5个孔,5 000个细胞/孔。按1.2.1分组以对应的药物浓度加药,200 μL/孔,对照组加入等体积的DMSO,放入含5%CO2,37℃培养箱中分别培养0、24、48、72 h;到达预定的时间后,每孔加入20 μL CCK-8溶液;37℃、5%CO2细胞培养箱内继续孵育2 h;测定450 nm处光密度(OD)值,计算抑制率。抑制率=1-实验组OD值/对照组OD值。
1.2.3 划痕实验 Marker笔在6孔板背后用直尺均匀地划横线,每隔0.5~1 cm一道,横穿过孔,每孔至少穿过5条线;在孔中加入约8×105个细胞,接种原则为过夜后融合率达到100%;次日用200 μL枪头比着直尺,尽量垂直于背后的横线划痕,枪头垂直,不能倾斜(不同孔之间最好用同一枪头);磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗细胞3次,去除划下的细胞,加入无血清培养液;对照组加入等体积DMSO、其余处理组以不同浓度的OSU-03012干预;放入37℃,5%CO2培养箱继续培养,0、24、48、72及 96 h时间点取样拍照。
1.2.4 Transwell实验 取生长状态良好的HCT-116细胞,采用不完全培养基培养细胞12 h,使细胞处于饥饿状态,收集细胞,调整细胞浓度至2×105个/mL。Transwell上室中加入150 μL细胞悬液,下室中加入600 μL含不同浓度OSU-03012的培养液,每组设置3个复孔,在培养箱中培养24 h后弃去培养液,用棉签将小室内残留细胞擦净。固定10 min后,采用结晶紫染色20 min并封片。显微镜下(×200)观察穿过滤膜的细胞,随机读取6个视野统计细胞数量。
1.2.5 细胞流式实验 收集分组处理24 h后的细胞,PBS重悬细胞并计数,取(5~10)×104个细胞,1 000 r/min离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞;加入5 μL Annexin V-FITC,轻轻混匀;室温避光孵育10 min,1 000 r/min离心5 min,弃上清,加入190 μL Annexin V-FITC结合液轻轻重悬细胞;加入10 μL碘化丙啶染色液,轻轻混匀,冰浴避光放置;流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.2.6 荧光共聚焦实验 将分组处理24 h后的细胞接种到预先放置有盖玻片的6孔板中,待细胞密度达到85%~90%后取出盖玻片,PBS洗2次;多聚甲醛固定30 min,PBS洗涤3次,每次5 min;采用通透剂处理细胞5~15 min,通透后用PBS洗涤3次,每次5 min;使用封闭液封闭细胞30 min,加入一抗,室温孵育1 h,采用加入Tween-20的PBS缓冲液(PBSTween-20,PBST)漂洗3次,每次5 min,加入二抗,室温避光孵育1 h,PBST漂洗3次,每次5 min,蒸馏水漂洗1次;封片后,采用荧光显微镜(×200;封片)观察并拍照。
1.2.7 Real-time PCR实验检测Caspase-3和Bcl-2mRNA表达情况 收集分组处理后的各组HCT-116细胞,采用Trizol试剂提取细胞总RNA,根据逆转录试剂盒说明书步骤将总RNA逆转录为cDNA,根据SYBR GREEN定量PCR说明书步骤进行PCR扩增。实时荧光PCR扩增条件:95℃30 s;95℃5 s,60℃ 34 s,共42个循环;95℃ 15 s,60℃ 60 s,95℃ 15 s。计算各组2-ΔΔCt值,内参基因为GAPDH。各检测基因引物序列见表1。
1.2.8 Western blot检测Bcl-2和Caspase-3蛋白表达情况 收集分组处理后的各组HCT-16细胞,提取细胞总蛋白后,采用BCA法进行蛋白定量,制作SDS-PAGE凝胶,每孔加入蛋白样品30 μg进行电泳,电泳完毕后转膜,再在常温下封闭2 h,加入一抗,低温孵育过夜,膜洗净后,加入二抗常温孵育1 h,膜洗净后,在暗室滴加显影液显影并拍照,采用Quantity one v4.6.6软件分析条带灰度。
1.3 统计学方法 采用SPSS 20.0软件分析。符合正态分布的计量数据用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
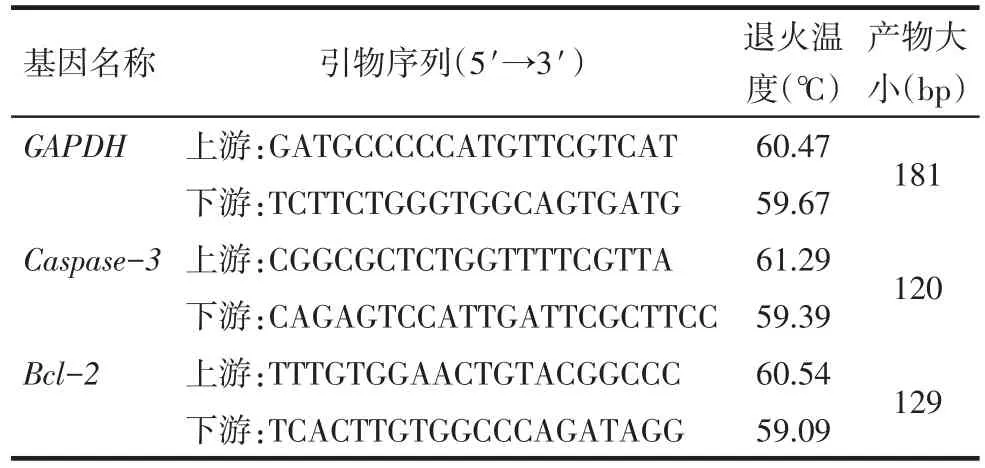
Tab.1 Primer sequence of each gene表1 各基因引物序列
2 结果
2.1 OSU-03012对HCT-116细胞增殖能力的影响 24、48及72 h时,除24 h 3 μmol/L组与1 μmol/L组比较差异无统计学意义外,抑制率均随浓度增加呈逐渐增加趋势(P<0.05),见表2。
Tab.2 The inhibition rate of HCT-116 cells after treatment with OSU-03012表2 OSU-03012作用HCT-116细胞后抑制率(n=3,±s)
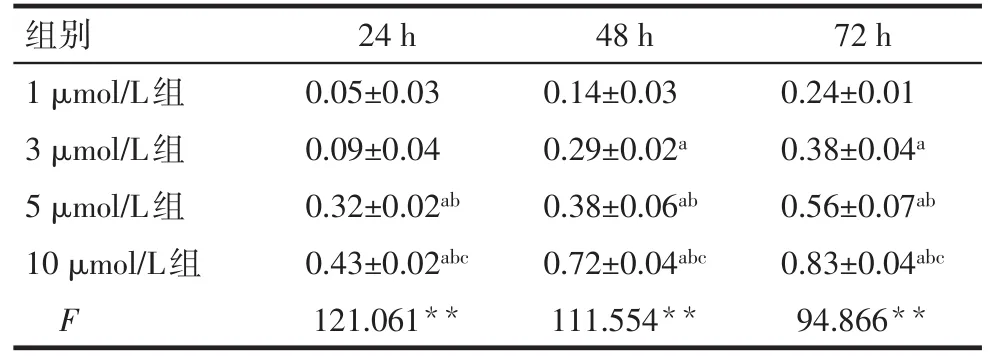
Tab.2 The inhibition rate of HCT-116 cells after treatment with OSU-03012表2 OSU-03012作用HCT-116细胞后抑制率(n=3,±s)
**P<0.01;abc分别与1、3、5 μmol/L组比较,P<0.05
组别1 μmol/L组3 μmol/L组5 μmol/L组10 μmol/L组F 24 h 0.05±0.03 0.09±0.04 0.32±0.02ab 0.43±0.02abc 121.061**48 h 0.14±0.03 0.29±0.02a 0.38±0.06ab 0.72±0.04abc 111.554**72 h 0.24±0.01 0.38±0.04a 0.56±0.07ab 0.83±0.04abc 94.866**
2.2 OSU-03012对结肠癌细胞迁移能力的影响 不同时间点,各组细胞迁移情况见图1,细胞迁移距离,对照组>1 μmol/L组>3 μmol/L组>5 μmol/L组>10 μmol/L组。Transwell实验检测结果显示,对照组、1 μmol/L组、3 μmol/L组、5 μmol/L组和10 μmol/L组细胞迁移数目分别为(62±10)个、(51±8)个、(45±6)个、(40±3)个和(23±6)个,呈逐渐降低趋势(n=3,F=12.716,P<0.05),见图2。
2.3 OSU-03012对结肠癌细胞凋亡的影响 对照组、1 μmol/L组、3 μmol/L组、5 μmol/L组及10 μmol/L组凋亡率分别为(1.86±0.55)%、(3.08±0.33)%、(5.65±0.22)%、(11.20±0.20)%及(20.63±4.23)%,呈逐渐增加趋势(n=3,F=48.120,P<0.05),见图3。
2.4 免疫荧光检测OSU-03012对Bcl-2和Caspase-3表达的影响 1、3、5、10 μmol/L组Bcl-2蛋白表达弱于对照组,而Caspase-3蛋白表达强于对照组,见图4、5。
2.5 OSU-03012对Bcl-2和Caspase-3表达的影响 3、5、10 μmol/L组Bcl-2 mRNA和蛋白表达量低于对照组,而Caspase-3 mRNA和蛋白表达量高于对照组(均P<0.05),见表3、图6。

Fig.1 The migration ability of HCT-116 cells detected by scratch test(×200)图1 划痕实验检测HCT-116细胞迁移能力(×200)
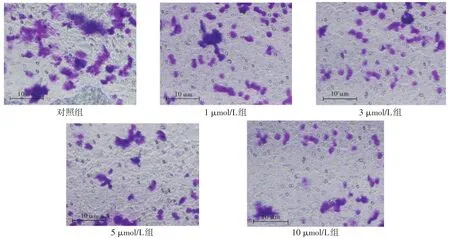
Fig.2 The migration ability of HCT-116 cells detected by Transwell test(crystal violet staining,×200)图2 Transwell实验检测HCT-116细胞迁移能力(结晶紫染色,×200)
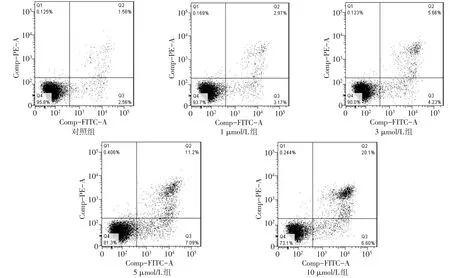
Fig.3 Apoptosis rates of cells detected by cellular flow experiment图3 细胞流式实验检测凋亡率
3 讨论
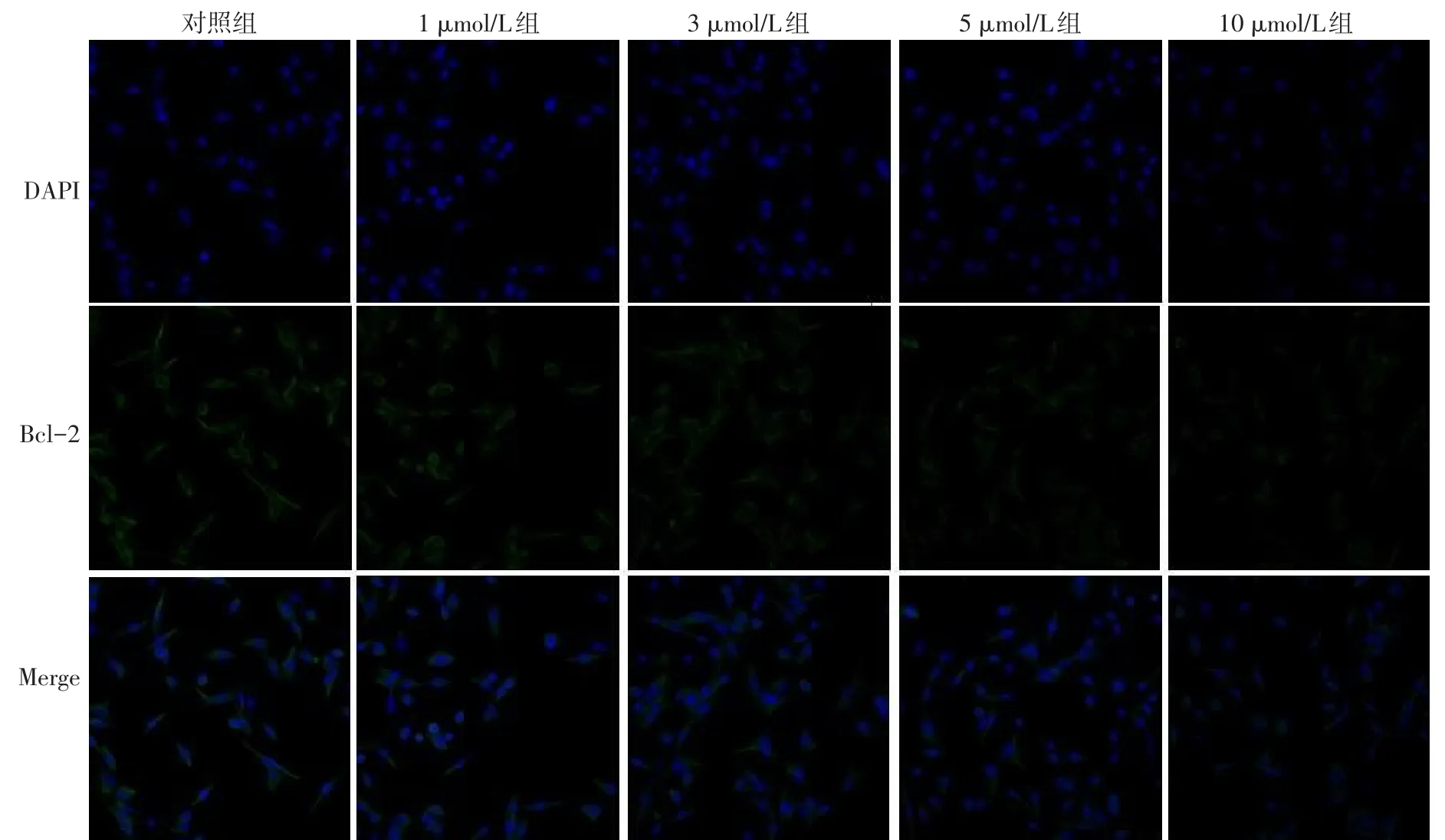
Fig.4 The expression of Bcl-2 detected by immunofluorescence assay(×200)图4 免疫荧光实验检测Bcl-2表达情况(×200)
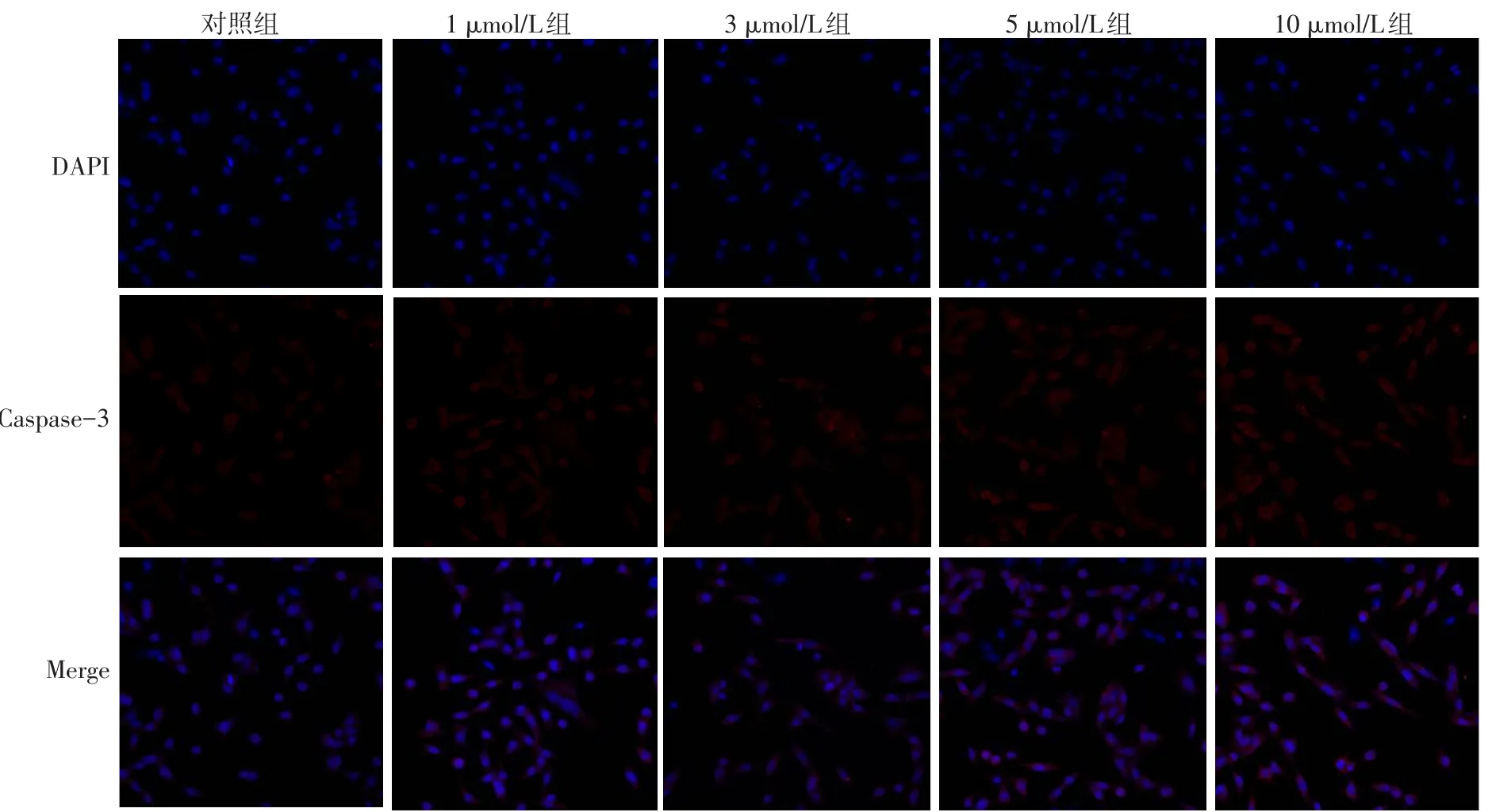
Fig.5 The expression of Caspase-3 detected by immunofluorescence assay(×200)图5 免疫荧光实验检测Caspase-3表达情况(×200)
COX-2在前列腺素合成中起关键作用,是前列腺素E2合成的限速酶。COX-2活性增加可促进前列腺素E2合成,进而抑制机体免疫功能,诱导血管生成,诱导K-ras、Bcl-2等促癌基因表达,抑制癌细胞凋亡,利于肿瘤生长[4]。流行病学调查显示,阿司匹林和其他非甾体类抗炎药能通过抑制COX-2活性,使结肠癌发病率、死亡率明显降低[5]。OSU-03012是COX-2抑制剂的衍生物,在人体内生物活性高,虽缺乏COX-2抑制活性,但在动物实验中发现其具有比COX-2抑制剂更强的抗癌作用[6]。另有研究显示,OSU-03012可增强拉帕替尼抗肿瘤作用,而拉帕替尼也可增强OSU-03012的杀灭肿瘤细胞的毒性作用,且两者抗肿瘤具有协同作用,当联合作用于癌细胞时,可协同使AKT和ERK1/2活性降低[7]。本研究结果发现,对照组、1 μmol/L 组、3μmol/L组、5 μmol/L组和10 μmol/L组细胞抑制率呈逐渐升高趋势,细胞迁移距离及细胞迁移数目呈逐渐减小或降低趋势,提示OSU-03012干预后细胞增殖和迁移能力明显受到影响,且OSU-03012浓度越高,细胞增殖和迁移抑制越明显,考虑这可能与细胞周期的阻滞在G0~G1期以及迁移相关蛋白表达抑制有关。
Tab.3 Comparison of Bcl-2,Caspase-3 protein and mRNA between five groups表3 各组Bcl-2、Caspase-3蛋白和mRNA表达情况比较(n=3,±s)
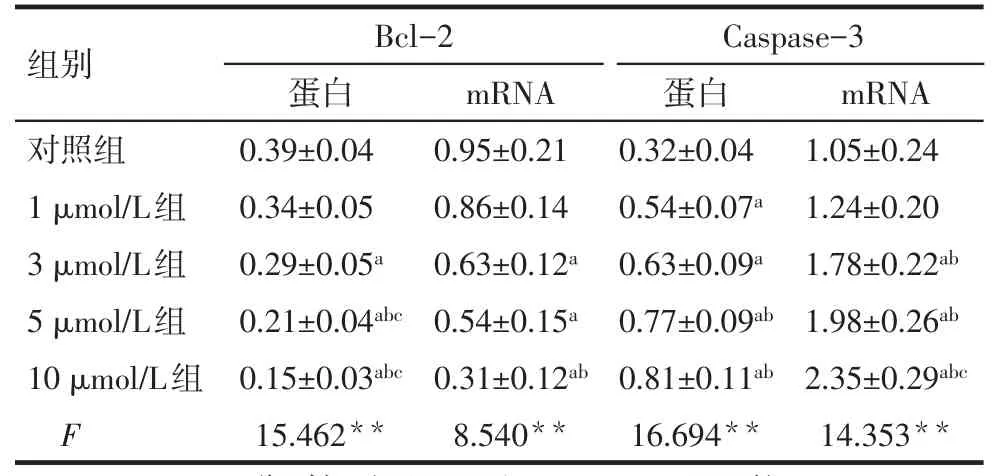
Tab.3 Comparison of Bcl-2,Caspase-3 protein and mRNA between five groups表3 各组Bcl-2、Caspase-3蛋白和mRNA表达情况比较(n=3,±s)
**P<0.01;abc分别与对照组以及1、3 μmol/L组比较,P<0.05
组别对照组1 μmol/L组3 μmol/L组5 μmol/L组10 μmol/L组F Bcl-2蛋白0.39±0.04 0.34±0.05 0.29±0.05a 0.21±0.04abc 0.15±0.03abc 15.462**mRNA 0.95±0.21 0.86±0.14 0.63±0.12a 0.54±0.15a 0.31±0.12ab 8.540**Caspase-3蛋白0.32±0.04 0.54±0.07a 0.63±0.09a 0.77±0.09ab 0.81±0.11ab 16.694**mRNA 1.05±0.24 1.24±0.20 1.78±0.22ab 1.98±0.26ab 2.35±0.29abc 14.353**
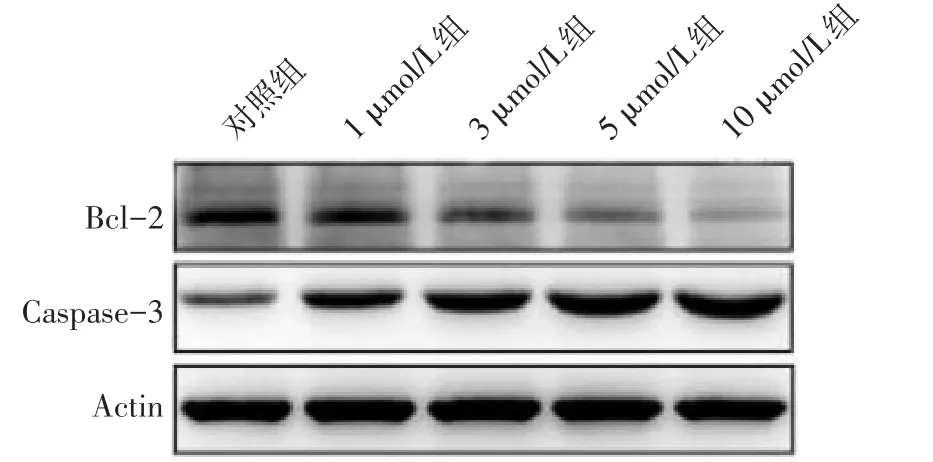
Fig.6 The expressions of Bcl-2 and Caspase-3 detected by Western blot assay图6 Western blot检测Bcl-2和Caspase-3表达情况
细胞凋亡是细胞程序性死亡的过程,凋亡细胞染色质凝集,DNA片段化,被巨噬细胞吞噬,此过程中不产生炎症反应[8-9]。Bcl-2是调节细胞凋亡的主要因子,可抑制细胞凋亡,提高细胞存活率,其作用机制是阻断凋亡信号转导的最后共同通路,从而发挥抑制凋亡作用,对正常细胞周期不产生影响[10-11]。Caspase-3是Caspase家族中的一员,存在形式多为非活性酶原,在凋亡信号作用下激活,可将细胞周期进一步阻滞,最终导致核皱缩、染色体聚集、凋亡小体形成,是细胞凋亡的执行蛋白,常用作细胞凋亡程度的评估指标之一[12]。本研究结果显示,对照组、1 μmol/L组、3 μmol/L组、5 μmol/L组及10 μmol/L组凋亡率呈逐渐上升趋势;整体而言,随浓度增加Bcl-2蛋白表达呈逐渐下降趋势,Caspase-3蛋白表达呈逐渐上升趋势,提示OSU-03012可能通过下调Bcl-2表达,上调Caspase-3表达实现促进结肠癌细胞凋亡作用,且OSU-03012浓度越高,促凋亡作用越明显,其作用机制考虑与OSU-03012抑制PI3K/PDK1/AKT信号通路中PDK1和AKT活性有关。研究显示,被激活的PI3K可激活PDK1,PDK1通过磷酸化使部分活化的AKT达到完全活化的状态,进而间接或直接调控Bcl-2和Caspase-3蛋白表达,发挥促进癌细胞凋亡的作用[3,13]。
综上所述,新化合物OSU-03012抗结肠癌的机制可能与抑制结肠癌细胞增殖、迁移,促进结肠癌细胞凋亡有关,而OSU-03012促进结肠癌细胞凋亡可能通过下调Bcl-2表达、上调Caspase-3表达实现,且其抑制癌细胞增殖、迁移、促进细胞凋亡方面具有一定的剂量依懒性。
