NMDA受体2A亚基磷酸化对幼鼠肝缺血再灌注后脑损伤及远期认知功能障碍的影响
2019-03-07王希辉于向洋喻文立杜洪印
王希辉,于向洋,喻文立△,杜洪印
肝移植术是终末期肝病最有效的治疗方案[1]。然而,小儿肝移植术后神经系统并发症的发生率高达46%,且与成人相比有更高的病死率[2-4]。小儿肝移植甚至可诱发远期认知功能障碍[5-6]。肝脏缺血再灌注(HIR)是肝移植过程中不可避免的病理生理过程,涉及血管活性因子、自由基和促炎性细胞因子的释放,不仅可造成肝损害,还可影响远隔脏器的功能[7-8]。最近证据表明,HIR可损伤成年小鼠中枢神经系统,导致神经元凋亡和认知功能障碍[7,9-10],但机制尚不清楚。N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体是广泛存在于脑的兴奋性谷氨酸受体,与学习记忆能力关系密切,其介导的兴奋性毒性是脑损伤的关键机制之一[11-12]。NMDA受体2A亚基(NR2A)酪氨酸磷酸化可上调NMDA受体活性,导致大量钙离子内流及钙超载,介导兴奋性毒性[13]。本研究拟评价HIR对幼鼠海马以及远期认知功能的影响,探讨NR2A磷酸化在其中发挥的作用。
1 材料与方法
1.1 实验动物及分组 健康C57小鼠54只,2周龄,体质量6~9 g,无特定病原体(SPF)级,购自解放军军事医学科学院实验动物中心,环境温度23~24℃,自由进食、饮水。采用随机数字表法分为3组(n=18):假手术组(S)、HIR组(I)和NR2A抑制剂NVP-AAM077预处理组(N)。
1.2 试剂与仪器 兔源cleaved caspase-3一抗、兔源NR2A一抗(1∶1 000,Abcam,美国);兔源p-NR2A Y1325、β-actin一抗(1∶1 000,Cell Signaling Technology,美国);NVPAAM077(PEAQX,Med-ChemExpress,美国);辣根过氧化物酶标记的羊抗兔IgG二抗(中杉金桥,北京);血清S100β和神经元特异性烯醇化酶(NSE)酶联免疫吸附测定(ELISA)试剂盒(武汉华美生物工程有限公司);Morris水迷宫视频分析系统(淮北正华生物仪器设备有限公司)。
1.3 HIR模型的制备 参考文献[10]的方法建立模型。术前禁食6 h,不限制饮水。腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉,灯照保温。皮肤消毒,取腹正中纵行切口,暴露肝门区,小心分离肝脏周围血管及韧带;采用血管夹夹闭肝左、中叶脉管(门脉、动脉与胆道)的共干以达到70%的肝脏缺血;确认血流阻断成功后,以湿纱布遮盖腹壁切口,缺血60 min时松开血管夹,冲洗腹腔后关腹。S组仅进行开腹、游离第一肝门以及关腹等操作,不进行脉管夹闭;N组于术后连续3 d每天予NVP-AAM077(10 mg/kg)腹腔注射;S组和I组以相同方式腹腔注射等体积生理盐水。
1.4 标本采集 再灌注3 d后,每组取5只小鼠同上述方式麻醉,迅速开胸,经左心室采血0.5 mL,离心取血清;经心脏由主动脉灌注预冷的肝素化生理盐水20 mL冲洗,断头取脑,置于4%多聚甲醛溶液中保存;另取5只小鼠,以相同方式断头取脑,剥离海马组织,置于-80℃保存。
1.5 ELISA检测血清S100β和NSE水平 使用商业化ELISA试剂盒检测血清脑损伤标志物S100β和NSE水平,具体实验步骤参照试剂盒说明书。
1.6 HE染色观察海马组织病理形态脑组织石蜡包埋,制备4 μm病理切片,二甲苯脱蜡,先后经苏木紫、伊红染色后于光镜下观察海马组织病理形态。
1.7 Western blot检测海马组织蛋白表达水平 取海马组织,称质量、研磨、裂解、离心、提上清,用BCA试剂盒进行蛋白定量。聚丙烯酰胺凝胶变性电泳(SDS-PAGE)后将蛋白转至PVDF膜上,以β-actin为内参,分别用cleaved caspase-3、NR2A、p-NR2A Y1325特异性一抗4℃孵育过夜,二抗室温孵育1 h。经KODAK IS440自显影系统曝光显影,使用Image J软件处理数据,以目的蛋白条带灰度值与内参条带灰度值的比值反映各蛋白的表达水平。
1.8 Morris水迷宫检测小鼠认知功能 每组取8只小鼠同上述造模后继续饲养30 d,然后参照文献[14]进行水迷宫测试。该装置为直径120 cm,高50 cm的圆形水池。根据直角坐标,水池被等分为4个象限,在任一象限中心放一直径9 cm的透明圆形平台,平台顶部低于水面1 cm,并保持平台位置不变。于HIR手术30 d后进行水迷宫实验。(1)定位航行实验:实验历时5 d,将小鼠分别从池壁4个象限的中点头朝池壁放入水中,记录小鼠找到并爬上平台的时间(逃逸潜伏期)和平均游泳速度,规定每次训练的时间为60 s,如果小鼠在规定的60 s找不到平台,须将其引导至平台上,让其学习10 s(此时潜伏期记为60 s)。(2)空间探索试验:于水迷宫实验第6天,撤去水下平台,小鼠自由游泳60 s并记录平台所在象限滞留时间。
1.9 统计学方法 采用SPSS 22.0软件进行分析,正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 血清S100β、NSE水平比较 与S组比较,I组和N组血清S100β、NSE水平升高(P<0.05);与I组比较,N组血清S100β、NSE水平降低(P<0.05),见表1。
Tab.1 Comparison of the serum concentrations of S100β,NSE and the expression levels of cleaved caspase-3,NR2A and p-NR2A between the three groups表1 各组小鼠血清S100β、NSE水平,海马组织Cleaved Caspase-3、NR2A、p-NR2A表达水平的比较(n=5,±s)
**P<0.01;a与S组比较,b与I组比较,P<0.05
S100β(ng/L)1.02±0.28 2.67±0.33a 1.83±0.30ab 36.821**组别S组I组N组F NSE(ng/L)12.24±3.23 33.52±2.81a 21.51±3.43ab 56.740**Cleaved Caspase-3 0.20±0.03 0.52±0.05a 0.32±0.03ab 91.163**NR2A 0.34±0.03 0.38±0.04 0.35±0.03 1.912 p-NR2A 0.16±0.03 0.37±0.04a 0.27±0.04ab 40.366**
2.2 海马组织病理形态 光镜下,S组海马神经元结构完整,排列整齐;I组海马组织明显水肿,细胞排列紊乱;N组海马病理变化情况较I组明显改善,但未达到S组水平,见图1。
2.3 海马组织cleaved caspase-3、NR2A、p-NR2A表达水平 与S组比较,I组与N组cleaved caspase-3、p-NR2A水平明显增加(P<0.05);与I组比较,NVPAAM077显著降低了cleaved caspase-3、p-NR2A水平(P<0.05)。3组之间NR2A表达水平差异无统计学意义,见表1,图2。
2.4 小鼠远期认知功能 定位航行实验中逃逸潜伏期3组之间差异无统计学意义。空间探索实验中,与S组比较,I组与N组平台所在象限滞留时间缩短,与I组比较,N组平台所在象限滞留时间延长(均P<0.05),见表2。

Fig.1 The pathological morphology in the hippocampal CA1 region for the three groups(HE staining,×400)图1 各组小鼠海马组织CA1区病理形态(HE染色,×400)
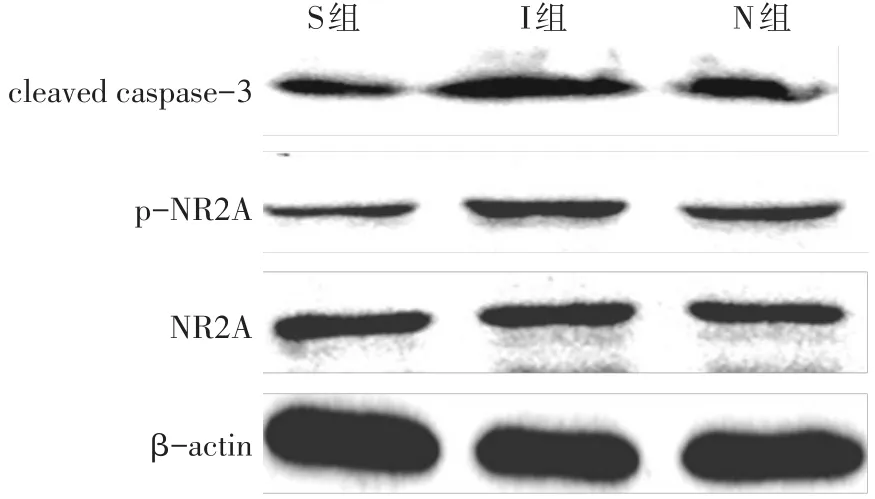
Fig.2 Comparison of the expression levels of cleaved caspase-3,NR2A and p-NR2A between the three groups图2 各组小鼠海马组织Cleaved Caspase-3、NR2A、p-NR2A蛋白表达水平
3 讨论
人类神经系统发育期是从妊娠末期6个月至出生后4岁,啮齿类动物约在出生后4~5周内[15]。在这个阶段,神经系统非常脆弱,极易受到外界刺激的伤害,甚至可能留下远期神经系统后遗症[16]。动物研究表明,HIR导致成年小鼠海马组织病理改变和术后认知功能障碍[7,9-10]。但是HIR是否可影响幼鼠远期认知功能尚未证实。本研究选择2周龄C57小鼠,观察HIR对幼鼠海马神经元和远期认知功能的影响,并探讨相关机制。
S100β蛋白是神经胶质细胞的标志蛋白,脑损伤发生时,S100β从胶质细胞透过血脑屏障进入外周血液,导致血清浓度升高,是评判血脑屏障开放以及胶质细胞损伤的重要指标[17-18]。NSE特异地存在于神经元胞浆中,可在脑损伤时穿过受损的血脑屏障导致血清浓度升高,是评价神经元损伤的常用标志物[18-19]。本研究结果显示,I组血清S100β与NSE浓度较S组升高,海马组织明显水肿,细胞排列紊乱,说明HIR可诱导脑损伤,与以往研究[7,10]得出了相似的结论。
Tab.2 Comparison of the escape latency and the time spent in the target quadrant in the Morris water maze test between the three groups表2 各组小鼠水迷宫实验逃逸潜伏期与平台所在象限滞留时间的比较 (n=8,±s)
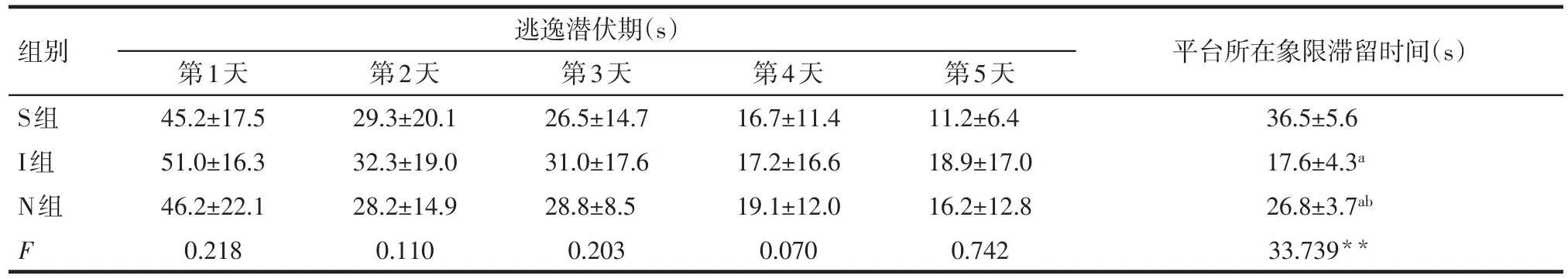
Tab.2 Comparison of the escape latency and the time spent in the target quadrant in the Morris water maze test between the three groups表2 各组小鼠水迷宫实验逃逸潜伏期与平台所在象限滞留时间的比较 (n=8,±s)
**P<0.01;a与S组比较,b与I组比较,P<0.05
第2天29.3±20.1 32.3±19.0 28.2±14.9 0.110组别S组I组N组F逃逸潜伏期(s)第1天45.2±17.5 51.0±16.3 46.2±22.1 0.218第3天26.5±14.7 31.0±17.6 28.8±8.5 0.203第4天16.7±11.4 17.2±16.6 19.1±12.0 0.070第5天11.2±6.4 18.9±17.0 16.2±12.8 0.742平台所在象限滞留时间(s)36.5±5.6 17.6±4.3a 26.8±3.7ab 33.739**
NMDA受体是具有离子通道特性的谷氨酸受体,NMDA受体亚基NR2A的酪氨酸磷酸化可上调NMDA受体活性,导致大量Ca2+内流及钙超载,介导兴奋性毒性[11]。研究表明NR2A的酪氨酸磷酸化与脑缺血[20]、抑郁[21]、癫痫[22]、脑出血[23]等多种病理模型关系密切,而NR2A是否参与HIR后海马损伤尚无研究证实。NR2A Y1325磷酸化位点是主要的酪氨酸残基之一,其磷酸化水平被认为是反映NMDA受体活性的良好指标[24]。本研究结果显示,与S组比较,I组NR2A Y1325的磷酸化水平上调,但NR2A总蛋白水平未见改变,提示HIR并不影响NR2A的表达,而是通过上调NR2A磷酸化水平提高NMDA受体活性;NVP-AAM077后处理不仅降低了HIR后NR2A的磷酸化水平,而且抑制了凋亡蛋白cleaved caspase-3的表达,并且降低了血清S100β、NSE浓度,缓解了脑损伤。因此,笔者推断海马神经元NR2A Y1325过度磷酸化通过介导细胞凋亡途径参与HIR后海马损伤。
Morris水迷宫是用于鼠类空间学习记忆研究的装置,广泛应用于动物行为学实验研究[7,14]。应用HIR 30 d小鼠进行远期认知功能评价是本研究的创新之处,选择HIR30 d小鼠进行水迷宫实验出于两方面的考虑,一方面HIR 30 d小鼠相当于青春期末期,此时小鼠神经系统功能趋于稳定,可有效反映HIR对小鼠认知的长期影响;另一方面只有大于6周龄的小鼠才有足够体力完成水迷宫实验。研究结果表明HIR可损害小鼠远期认知功能,NVPAAM077后处理明显改善了小鼠远期认知功能。基于以上研究,推断幼鼠HIR可引起脑损伤和远期认知功能障碍,且NR2A Y1325过度磷酸化与HIR后脑损伤及远期认知功能障碍关系密切。
综上所述,幼鼠HIR可导致脑损伤和远期认知功能障碍,其机制可能与NR2A Y1325过度磷酸化介导的兴奋性毒性和细胞凋亡有关。
