脑梗死后吞咽障碍患者脑功能成像与吞咽功能相关性研究
2019-02-27龙耀斌黎伟雄黄雅琳黄福灵
龙耀斌,黎伟雄,黄雅琳,黄福灵
吞咽障碍是脑卒中后常见并发症,发生率高达44%~55%[1]。患者进食过程中出现流口水、呛咳、误吸、呕吐等障碍,进而引发严重并发症如吸入性肺炎、营养不良等。脑卒中后吞咽障碍患者需要长期留置胃管甚至胃造瘘,其对生活质量影响较大。因此,了解脑结构和功能、吞咽过程及其机制有助于指导康复治疗。脑卒中后吞咽障碍多以外周刺激(如手法、电刺激或针灸等)为主进行治疗,如何直接刺激皮质吞咽中枢从而精准快速治疗仍是康复研究的热点。大脑皮质及皮质下组织对吞咽功能起控制作用[2-3],但其与吞咽障碍临床病变程度的关系尚有待研究。研究显示,静息态功能性磁共振成像(rsfMRI)技术能反映脑功能区和区间功能连接的活动情况[4-5]。因此,本文通过研究脑梗死后吞咽障碍患者静息态脑功能情况,分析吞咽相关脑区低频振幅(ALFF)值变化及其与Rosenbek渗透/误吸分级的相关性,并探讨脑梗死后吞咽障碍的发生机制,旨在为临床提供帮助。
1 资料与方法
1.1 一般资料 选取2016年3—12月广西医科大学第一附属医院神经内科收治的脑梗死后吞咽障碍患者20例为病例组,其中女9例,男11例;年龄55~72岁,平均年龄(2.5±3.2)岁。选取同期本院体检健康的20例健康志愿者为对照组,性别、年龄均与病例组匹配﹝其中女10例,男10例;年龄55~70岁,平均年龄(61.2±2.4)岁﹞。对照组均为右利手,无脑卒中病史,无明显系统性疾病和神经系统疾病,能配合检查。本研究经本院伦理委员会批准,均签订知情同意书。
1.1.1 病例组纳入标准 (1)符合脑梗死诊断标准[6];(2)经颅脑CT或磁共振成像(MRI)确诊,首次发病,病灶位于左侧大脑半球,病程3 d~2周;(3)意识清晰,生命体征平稳;(4)肢体功能障碍较轻,合并吞咽障碍为主,并经视频透视吞咽检查(VFSS)[7]明确;(5)右利手,能配合研究。
1.1.2 病例组排除标准 (1)既往有脑创伤、脑血管疾病;(2)存在药物和酒精依赖史;(3)神经或精神疾病(包括癫痫发作、认知障碍、失语、忽视、严重的抑郁或幽闭恐惧症);(4)有rsfMRI扫描禁忌证:如佩戴心脏起搏器、人工耳蜗,脑内有金属夹子等;(5)合并肺炎或严重肝肾功能不全;(6)其他疾病造成的吞咽困难。
1.2 方法 两组均予以颅脑MRI及rsfMRI检查,并运用对照分析法进行研究。
1.2.1 数据收集 采用Siemens 3.0 T进行检查,扫描前嘱受试者安静平躺且避免思考问题,尽量保持头部不动,加用泡沫垫固定头部,戴眼罩闭眼、全身放松。rsfMRI首先进行SmartBrain扫描定位,其次为RefScan扫描。参数设计采用单次激发平面回波的梯度回波序列:TR 3 000 ms,TE 35 ms,矩阵 128×128,视野 23 cm×23 cm,翻转角 90°,层厚4 mm,无间距隔层扫描38层;采用梯度回波序列获得全脑高分辨三维 T1 加权像,参数:TR 8.2 ms,TE 3.2 ms,矩阵512×512,翻转角 12°,视野 24 cm×24 cm,分辨率 1 mm。
1.2.2 数据处理 (1)应用Matlab2009b平台预处理数据,并结合SPM8、DPARSF、REST软件[8]。确认扫描过程中没有受试者进入睡眠状态。先对前5个时相的采集图像进行去除,然后对剩余180个时相的数据进行头动校正和图像配准、去线性漂移和低频(0.01~0.08 Hz)滤波。预处理去除头动的三维检测数据:病例组中旋转超出2°,平移超过2 mm;对照组旋转超出1°;平移超出1 mm。按照Talairach空间标准化将功能像和解剖像进行配准。(2)通过DPARSF软件分析ALFF值。(3)两组相关数据通过REST软件进行双样本t检验,双侧检验水准α=0.05(Alphasim校正)。
1.3 临床吞咽评估指标 病例组均进行VFSS,在X线透视下让患者吞咽钡剂,观察钡剂由口咽到食管的整个运动过程,记录在口腔期、咽期及误吸状态,评估吞咽功能。采用Rosenbek渗透/误吸分级评估患者渗透/误吸发生率与程度[9]。钡剂进入喉前庭后,直接通过声襞以下则造成误吸,声襞以上残留为渗透。Rosenbek渗透/误吸分级共8级:重度误吸为8级,中度误吸为7级,轻度误吸为6级,重度渗透为3~5级,轻度渗透为2级,正常为1级。
以病例组患者ALFF值减低的脑区作为感兴趣区(ROI),分析ROI与Rosenbek渗透/误吸分级的相关性。
1.4 统计学方法 采用SPSS 13.0统计学软件进行数据分析。相关性分析采用Pearson相关分析。双侧检验水准α=0.05。
2 结果
2.1 病例组临床资料 剔除rsfMRI检查过程中不合格的研究对象,实际进入研究病例组12例(详细临床资料见表1),对照组18例。
2.2 病例组与对照组ALFF值比较 与对照组比较,病例组左侧中央前回、中央后回、岛叶、壳核ALFF值降低,差异有统计学意义(P<0.05,见表2、图1);与对照组比较,病例组右侧后扣带回、岛叶、视觉中枢、初级听皮质ALFF值升高,差异有统计学意义(P<0.05,见表3、图1,本文图1彩图见本刊官网www.chinagp.net电子期刊相应文章)。
2.3 病例组ROI与Rosenbek渗透/误吸分级的相关性分析 病例组左侧中央前回、中央后回、岛叶、壳核的ROI分别记为ROI1、ROI2、ROI3、ROI4。Preason相关分析结果显示,病例组ROI1、ROI2、ROI3、ROI4与Rosenbek渗透/误吸分级呈正相关(rROI1=0.45,P=0.006;rROI2=0.34,P=0.017;rROI3=0.24,P=0.035;rROI4=0.18,P=0.043)。
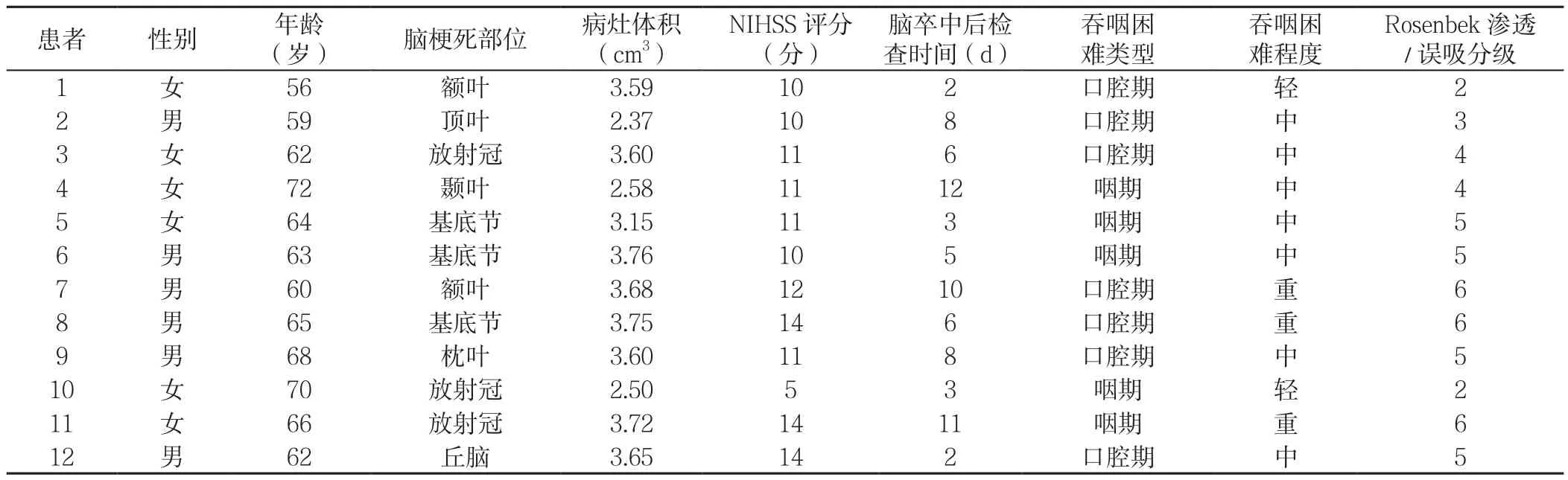
表1 病例组临床资料Table 1 Clinical information of patients
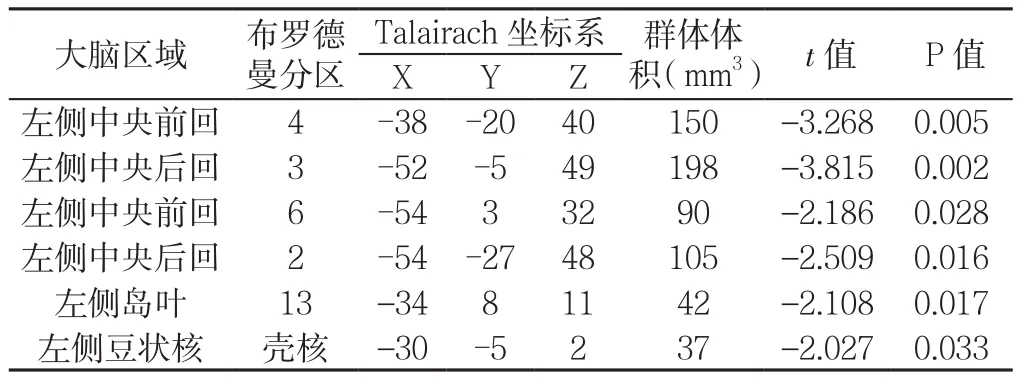
表2 病例组左侧脑区ALFF值与对照组比较Table 2 Comparison of ALFF values in left brain regions between patients and controls
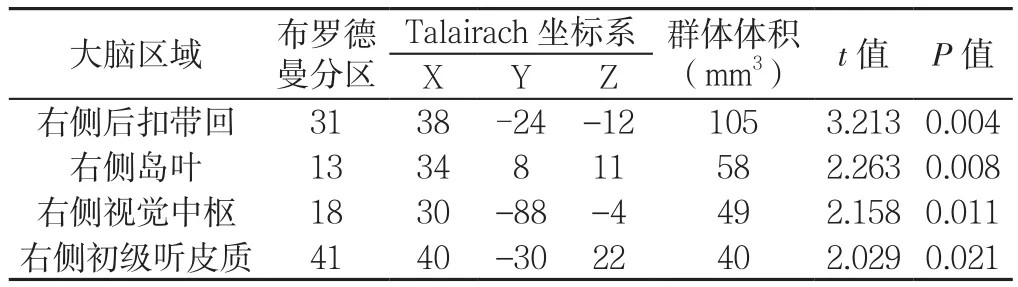
表3 病例组右侧脑区ALFF值与对照组比较Table 3 Comparison of ALFF values in right brain regions between patients and controls
3 讨论
吞咽的生理过程非常复杂,低位吞咽中枢位于延髓,由高位皮质与皮质下中枢发出下行纤维共同调节,激活吞咽运动神经元[10]。由于脑干卒中引起的吞咽困难一般较重,因此本课题组重点研究皮质及皮质下结构在吞咽控制中的作用。考虑到双侧或多发病灶导致吞咽障碍机制复杂,本组病例均为左侧单发责任病灶,常见部位为额顶叶、基底核区、岛叶等。传统观点认为只有脑干或双侧半球的病变才会导致吞咽困难,但随着临床及影像学技术的发展,单侧脑的病变可引发吞咽障碍的观点已逐渐被接受[11]。自主吞咽运动的大脑皮质中枢调控无论是启动还是运动规划、运动执行等方面均有明显偏侧性,即主要由左侧优势半球相关脑皮质中枢进行调控[12]。这种自主吞咽运动大脑皮质中枢支配偏侧的成因可能与语言中枢偏侧性原因类似。大脑的功能执行总是依赖于多个脑区之间广泛的交互,关于脑电图、rsfMRI等影像技术的许多研究均指出人脑可以被看作是一个复杂的网络[13]。在脑网络中,神经元或宏观皮质区对应网络的节点,轴突、宏观白质路径、区域间功能耦合水平则对应网络的边,其可以不同尺度来描述大脑的组织模式和运行机制[14]。由于现有成像技术的限制,目前脑连接的研究主要集中在大尺度(脑区)水平,即选取ROI作为脑连接网络中的网络节点。静息态下的脑功能网络连接反映了大脑固有的、自发的神经活动时的脑功能活动模式,在脑功能机制研究中广泛运用,并且具有很好的临床适用性。ALFF值是一种有效的静息态功能数据分析值,通过具体计算每个体素ALFF值的大小来反映局部神经元自发活动水平。ALFF值降低反映脑神经元自发活动的减弱,而ALFF值升高反映脑功能的代偿作用[15]。
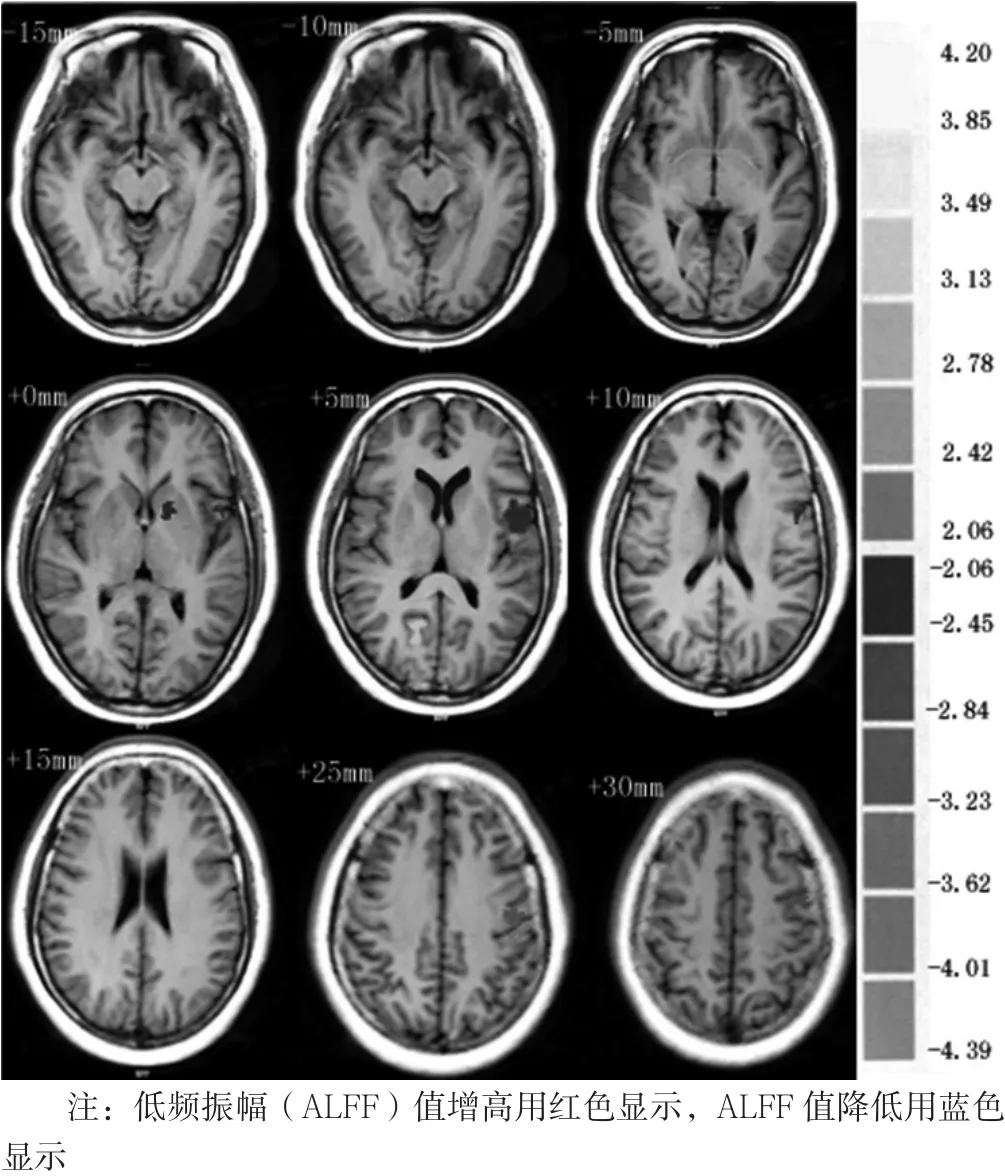
图1 脑梗死后吞咽障碍患者静息态功能成像Figure 1 The resting-state brain activity in patients with dysphagia after stroke
脑梗死后大脑皮质出现明显的功能和结构变化,不仅发生在病灶周围,而且也发生在远隔部位,包括双侧运动、感觉和视觉皮质、基底核、丘脑和小脑等相关结构,还可以观察到病灶周围及相关皮质兴奋性增高,原有中枢代表区范围改变和/或出现邻近皮质新的中枢代表区[16]。本研究结果显示,与对照组比较,病例组左侧中央前回、中央后回、岛叶、壳核的脑区激活减弱,右侧后扣带回、岛叶、视觉中枢、初级听皮质的脑区激活增强。人类大脑两侧皮质均有吞咽中枢,其主要的吞咽代表区位于感觉运动区尾侧和运动前区外侧、基底节、岛叶、丘脑、额下回前部、额顶岛盖和小脑。初级运动区(M1)和辅助运动皮质(SMA)参与喉咽吞咽的运动控制[17],M1与吞咽诱发有关,控制舌、面部活动;SMA其实与运动计划有关,特别是口咽吞咽发生的顺序。其中初级感觉运动区皮质稳定性最好、体积激活最大、信号最强[18]。各皮质区既有特定的功能又相互联系,形成一个神经网络,共同支配吞咽运动。这些吞咽皮质形成一个广泛的神经网络(运动皮质、辅助运动皮质和基底节、岛叶、基底节的壳核之间有可能存在一个神经网络)[19]。有研究选用rsfMRI中的种子相关分析法,对脑卒中后吞咽障碍患者和健康对照进行研究,发现由感觉运动皮质(包括中央前、后回)、岛叶、壳核组成的运动环路,且其间的功能连接降低,本研究结果与其相似,提示吞咽障碍患者左侧中央前回、中央后回、岛叶、壳核这些减弱的脑区与运动环路功能连接减低或消失有关,可能是吞咽障碍发生机制之一[5]。VFSS是目前唯一可以直观看到误吸的检查,其结果不受患者症状和体征的干扰或影响,其判断患者是否存在误吸较临床评估可靠,是世界公认的诊断误吸的金标准[20]。Rosenbek渗透/误吸量表是在VFSS基础上产生的评估量表,此量表量化误吸的严重程度比其他临床评价工具更客观可靠[9]。本研究结果显示,左侧中央前回、中央后回、岛叶、壳核与患者Rosenbek渗透/误吸分级呈正相关,由此可得出左侧中央前回、中央后回、岛叶、壳核的ALFF值越接近正常,Rosenbek渗透/误吸分级越低;ALFF值越弱,Rosenbek渗透/误吸分级越高。
M1和SMA共享扣带回皮质相当大的公共信息,包括扣带回皮质运动区的头部和尾部。扣带后回激活约在吞咽前2 000 ms左右开始,早于其他脑区,扣带回皮质参与吞咽困难中处理运动选择。目前扣带回与岛叶及杏仁核之间的联系已经十分明确,正是由于这种联系才使得主体能意识到自主神经功能活动状态,所以推测扣带回能有意识地重复吞咽动作,在吞咽启动中被激活[21]。有研究显示,急性右侧非优势侧脑梗死后吞咽障碍患者的脑功能网络中,患侧的吞咽皮质中枢的激活强度降低,而健侧前额叶、后扣带回和视听皮质等被激活,启动吞咽中枢的代偿性功能重组[22]。因此,在对此类中枢性吞咽障碍患者进行治疗时,应选择患者爱吃的、颜色鲜艳的食物,通过视听觉镜像神经元系统来刺激吞咽相关的神经,以有利于大脑皮质吞咽中枢功能重组,提高治疗效果;而正常成人自主吞咽过程中90%受试者可发现,参与味觉、嗅觉、内脏感觉等多种感觉处理的岛叶和扣带回皮质激活[23],说明在吞咽功能的自主启动过程中优势半球的脑区和扣带皮质起着关键作用。本研究吞咽障碍患者ALFF值升高的脑区有右侧后扣带回、岛叶、视觉中枢、初级听皮质,这可以理解为适应病理机制的右侧大脑代偿,可能参与吞咽功能的恢复,与相关报道的结果一致[24-26]。
综上所述,左侧脑梗死后吞咽障碍患者左侧中央前回、中央后回、岛叶、壳核脑区的ALFF值明显减低,且与Rosenbek渗透/误吸分级呈正相关,可能是吞咽障碍的发生机制之一;而右侧后扣带回、岛叶、视觉中枢、初级听皮质脑区的ALFF值明显增高,可能与吞咽功能的恢复有关,仍有待进一步研究。
本研究局限性:
本研究只关注左侧脑中动脉梗死后吞咽困难患者,但样本量较小;此外未精确测量生理噪声如心跳、呼吸等;还有由于本研究时间相对不足,没有纵向随访患者脑功能的动态变化,下一步将进行适当的队列研究并加以改善。
作者贡献:龙耀斌对文章项目实施整体负责管理、论文的修订;黄福灵负责fMRI的检查,数据分析;黎伟雄进行吞咽评估,数据收集整理;黄雅琳进行统计学处理,撰写论文。
本文无利益冲突。
