烟秆高效复合降解菌群的筛选、鉴定及组合应用
2019-02-07李春黎李文豪余君孙敬国王昌军陈守文杨勇
李春黎 李文豪 余君 孙敬国 王昌军 陈守文 杨勇

摘 要:為提高烟草秸秆中木质素和纤维素降解效率,缩短烟草秸秆腐熟时间,通过平板筛选和酶活测定试验筛选出具有木质素和纤维素降解能力的菌株,并探讨了不同菌株组合对烟草秸秆的降解程度。结果表明,所筛选获得的梭形芽胞杆菌(Lysinibacillus fusiformis,N019a)、毛栓菌(Trametes hirsuta,MA)、米根霉(Rhizopus oryzae,imp)分别能高效降解烟草秸秆中的木质素,半纤维素和纤维素;N019a,MA和imp组成的复合菌群I用于烟秆粉末固态发酵25 d,半纤维素、纤维素和木质素降解率分别为67.23±0.73%,61.17±0.45%和60.12±0.48%;B. tequilensis(B4),B. subtilis(B26)和A. niger(M90)组成的复合菌群II降解半纤维素、纤维素和木质素降解率分别为72.15±0.35%,65.68±0.55%与38.15±0.76%,6个菌株组合成的复合菌群III降解半纤维素、纤维素和木质素降解率分别为83.32±0.45%,75.21±0.71%与66.13±0.53%。不同的降解菌降解木质纤维中不同成分具有一定的特异性,多功能菌株组合能显著提高烟草秸秆生物质降解效果。研究结果为开发烟草秸秆高效降解复合菌剂提供了依据。
关键词:烟草秸秆;复合菌群;木质素;纤维素
中图分类号:S572.01 文章编号:1007-5119(2019)06-0026-07 DOI:10.13496/j.issn.1007-5119.2019.06.004
Screening, Identification and Combination of High Efficiency Degrading Bacteria for Tobacco Stem
LI Chunli1, LI Wenhao1, YU Jun2*, SUN Jingguo2, WANG Changjun2, CHEN Shouwen1, YANG Yong1*
(1.College of Life Sciences, Hubei University, Wuhan 430062, China; 2. Tobacco Research Institute of Hubei Province, Wuhan 430030, China)
Abstract:In order to improve the degradation efficiency of lignin and cellulose in tobacco straw and shorten the decomposing time of tobacco straw, the strains with the ability to degrade lignin and cellulose were screened out by plate screening and enzyme activity determination experiments. The effects of different strain combinations on tobacco straw degradation were discussed. The results showed that the obtainedLysinibacillus fusiformis(N019a),Trametes hirsuta(MA), andRhizopus oryzae(imp) were effective in degrading lignin, hemicellulose, and cellulose in tobacco straw. The composite flora I composed of N019a, MA and imp was used for solid fermentation of tobacco stalk powder for 25 d. The degradation rates of hemicellulose, cellulose and lignin were 67.23±0.73%, 61.17±0.45% and 60.12±0.48%, respectively.B.tequilensis(B4),B.subtilis (B26) andA.niger (M90) composed a complex flora II with degradation rates of hemicellulose, cellulose and lignin being 72.15±0.35%, 65.68±0.55%, and 38.15±0.76%. The degradation rates of hemicellulose, cellulose and lignin by compound flora III composed of 6 strains was were 83.32±0.45%, 75.21±0.71% and 66.13±0.53%. Different degrading bacteria degrade different components in wood fiber with certain specificity, and the combination of multifunctional strains can significantly improve the biomass degradation effect of tobacco straw. The research results provide a basis for the development of a highly effective compound bacterial agent for tobacco straw degradation.
Keywords:tobacco straw; composite flora; lignin; cellulose
烟草(Nicotiana tabacumL.)是我国重要的经济作物,种植面积和产量均居世界首位,我国每年产生几百万吨烟草秸秆,鲜烟秆难以降解,含有大量病原菌和烟碱,直接还田会提高烟草病毒病的发生率,影响烤烟的品质和经济效益;同时烟碱等会污染土壤及水体,进而污染烟田环境;且烟草秸秆利用面临原料分散,收储困难,预处理耗能等问题,因此我国的烟草秸秆无法得到有效的利用[1-4]。
烟草秸秆中木质纤维是以大量的半纤维素和三维网状结构的木质素高分子聚合物包含着纤维素晶体形成的致密网状结构,难以被微生物分解利用。真菌的胞外纤维素酶活较强,特别是木霉属(Trichoderma sp.)与黑曲霉(Aspergillusniger),能产生3类纤维素酶并分泌到胞外,并且它们的菌丝具有机械穿插能力,能由内而外降解纤维素,在堆肥中起重要作用[5]。再如白腐菌是一種高效木质素降解功能微生物,能将木质素降解为CO2和H2O,侧耳菌(Pleurotus)和粗毛栓菌(Trametes gallica)产木质素降解酶能力强,且产酶较快。
目前已有不少关于高效菌株筛选的研究报道[6-7],KARMAKAR等[6]的研究表明,单一的细菌、真菌、放线菌,尽管活性较高,但在加速堆肥化进程中的效果却不如复合微生物菌群的共同作用。因而众多研究逐渐将热点转向复合菌系[8-10],以达到快速降解木质纤维的目的。复合菌在繁殖代谢和生物降解中具有优势,原因可能为其酶系的协同作用和营养需求的互补[11]。事实上,木质纤维是由纤维素,半纤维素,木质素和果胶等物质构成的复合体[12],然而多数研究构建的复合菌群主要是针对木质纤维中的单一成分进行降解[13-16],功能单一。
本研究主要通过筛选高效降解木质纤维中不同成分的功能菌,并将不同的功能菌进行组合,旨在研制出一种高效的烟秆复合降解菌群应用于烟秆堆肥中,以提高土壤的肥力以及减少水土污染,实现废弃资源的合理利用和资源可持续发展。
1 材料与方法
1.1 试验材料
1.1.1 试验样品 烟草秸秆收集自湖北省恩施州望城坡村,80 ℃烘干,粉碎过40目筛网备用。
菌种筛选样品:从海南三亚、江西庐山、湖北恩施和利川的烟田、烟秆自然堆体、木材加工厂、锯末堆场等采取烟秆、葡萄枝、朽木、白蚁肠道、腐烂木桩等56个样品,样品编号后放置4 ℃冰箱保存。
1.1.2 试验菌株 龙舌兰芽胞杆菌(B. tequilensis,B4),枯草芽胞杆菌(B. subtilis,B26)和黑曲霉(A. niger,M90)为本研究团队保藏[24]。其余菌株由1.2.1方法分离筛选得到。
1.1.3 培养基 固态(富集)培养基:过40目筛烟梗粉 50 g,无机营养液(NH4Cl 2.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,Na2HPO40.2 g,MnSO40.035 g,CuSO4·5H2O 0.007 g,FeSO4·7H2O 0.007 g,加蒸馏水定容至1000 mL)50 mL,pH 7.0。
PDA培养基:马铃薯200.0 g,蔗糖20.0 g,加蒸馏水定容至1000 mL,调节pH至7.0。
PDA-GU培养基:PDA培养基中加入愈创木酚(0.1%)。
PDA-AzureB培养基:PDA培养基中加入苯胺蓝(0.1%)。
刚果红纤维素培养基:微晶纤维素粉1.88 g,刚果红0.2 g,KH2PO40.5 g,MgSO4?7H2O 0.25 g,(NH4)2SO4 2.0 g,明胶2.0 g,加蒸馏水定容至1000 mL,调节pH至7.0。
孟加拉红培养基:蛋白胨5.0 g,葡萄糖 10.0 g,KH2PO4·3H2O 1.0 g,MgSO4·7H2O 0.5 g,0.1%孟加拉红溶液0.33 mL,链霉素溶液(10 000 μ/mL)0.33 mL,用蒸馏水定容至1000 mL。
1.2 研究方法
1.2.1 烟草秸秆降解菌的分离和筛选 纤维素降解菌和木质素降解菌的筛选方法分别参照石娜娜[17]和尹静等[18]的方法。
1.2.2 木质纤维降解相关酶活的测定 按照4块菌丝团(直径7 mm)/100 g培养基,或孢子悬浮液4 mL/100 g培养基的接种量将降解菌接种于PDA培养基,并在30 ℃静态培养16 d。每两天采样1次,分别参照石娜娜等[17]方法测定纤维素降解酶 CMC和FP活力,参照MARTINA[19]的方法测定木质素降解酶Lip,MnP和Lac活力。
1.2.3 烟草秸秆降解菌分子鉴定 木质纤维降解菌中细菌采用菌落PCR,挑选单菌落在100 μL EP管里搅匀,沸水浴10 min裂解菌,8000 r/min离心,
取上清液为模板。采用通用引物27F和1492R,对目的菌株的16S rDNA进行PCR扩增。真菌采用ITS(Internal Transcribed Spacer)DNA序列分析法進行鉴定,ITS1 和ITS4作为扩增和测序引物。所测序列利用 DNAstar软件对序列进行拼接,应用NCBI Genbank Blast 程序进行序列相似性比对分析,通过 MEGA(v 7.0.26)软件进行系统发育分析,用邻接法 (Neighbor-Joining) 构建系统发育树。
1.2.4 烟草秸秆降解菌株间拮抗试验 采用平板拮抗法[20]进行菌株间的拮抗试验。
1.2.5 烟草秸秆降解菌配伍及降解能力测定 在配伍研究中,将菌株N019a、MA和imp按1:1:1混合(组合I);菌株B4、B26和M90按1:1:1混合(组合II);将组合I和组合II按1:1混合(组合III)。
将菌株组合接入烟秸秆固态培养基中,发酵25 d后检测木质纤维降解率,每个菌液组合设置3个重复,接种孢子液总共3 mL,菌塞3块,真菌接种量为1%,即100 g烟秆粉接种1 g真菌发酵菌塞,细菌(1.0×109)则按照10 mL/g。
木质纤维含量的测定是参照文献[21]。
1.3 试验时间、地点
试验于2018年1月开始在湖北大学微生物工程实验室进行。
2 结 果
2.1 烟草秸秆降解菌的筛选
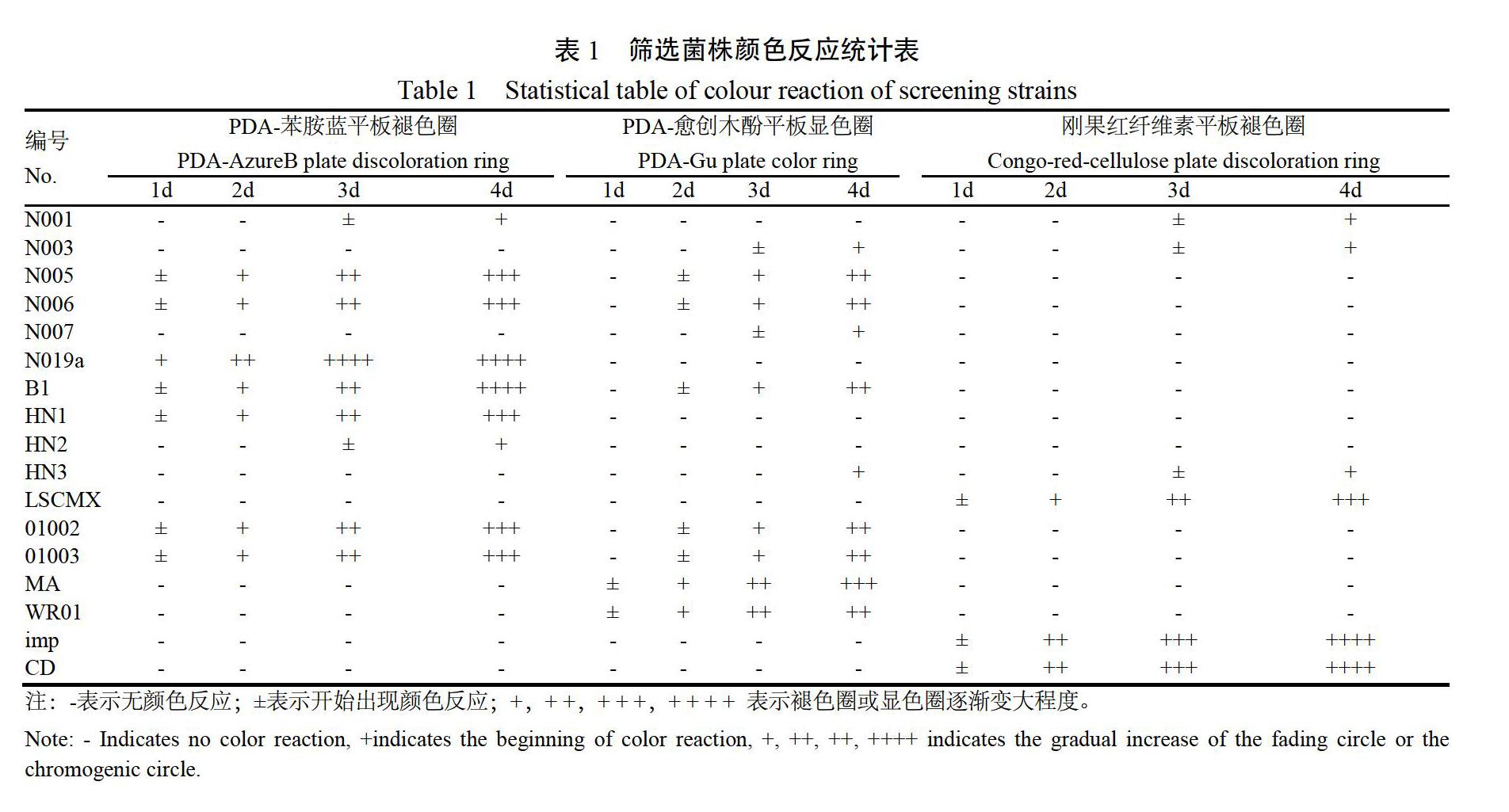
2.1.1 降解菌的初筛 筛选获得使PDA-AzureB产生褪色透明圈的菌株9个,其中菌株N019a在12 h 内开始产生褪色透明圈,48 h内平板全褪色;在 PDA-Gu平板上获得产生褪色圈的菌株8个,菌株MA产生褪色圈最快;菌株imp在48~72 h内刚果红纤维素培养基完全褪色(表1)。上述菌株经3次分离纯化后,将性状稳定菌株保存备用。
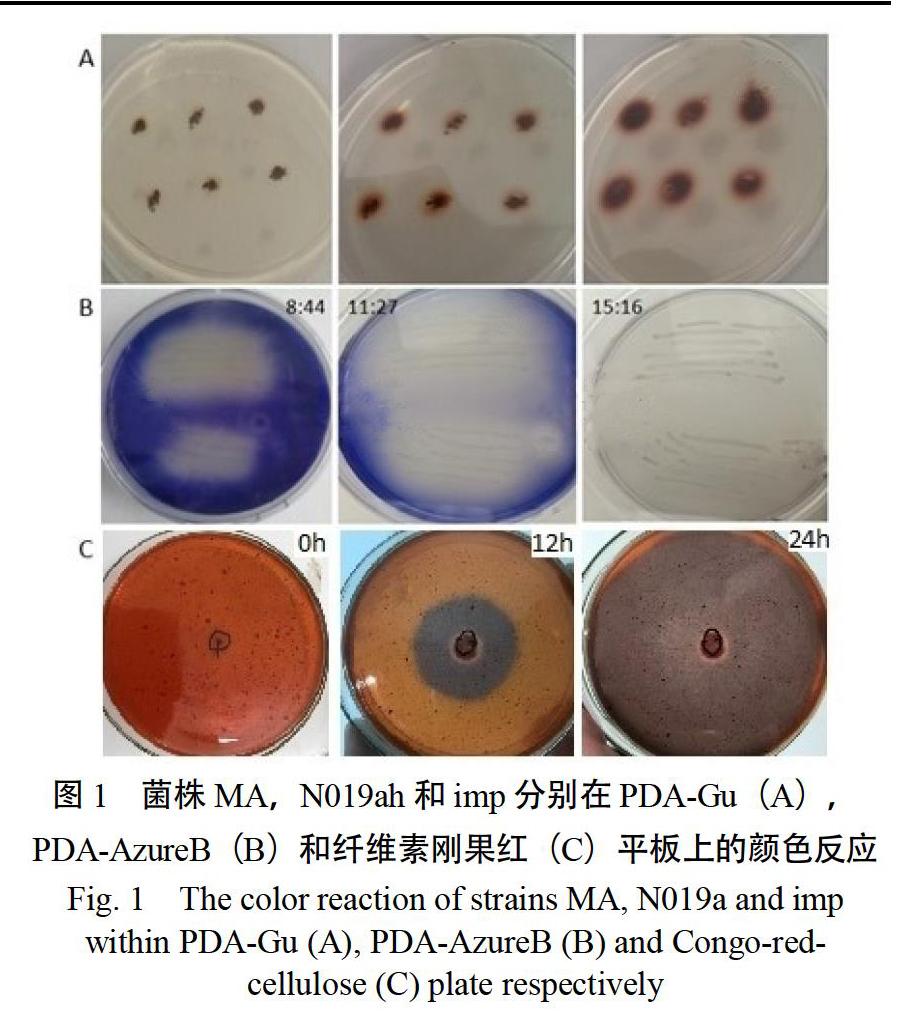
2.1.2 木质纤维降解菌复筛 在进一步分离纯化后,通过比较单菌株在24 h内显色圈与褪色圈变化速度,发现菌株MA在PDA-Gu平板接种4 h后发生显色反应,但显色较慢(图1A);菌株N019a接种后12 h内苯胺蓝全部褪色(图1B);菌株imp接种后,24 h内刚果红全部退色(图1C)。
从底物平板状态观察发现,菌株MA为白腐菌,生长速度较慢,但其显色反应快;菌株N019a与imp生长快,褪色反应快。因此,将菌株N019a、imp和MA作为后续研究木质纤维降解的主要菌株。
酶活性测定结果表明(表2),菌株N019a的LiP和MnP酶活性分别为76.12±1.34 U/g和15.16±1.45 U/g,但未检测到Lacc,CMCase和FPase
酶活性;菌株MA的LiP、MnP和Lacc酶活性分别为465.24 U/g、264.15 U/g和1818.23 U/g,未检测到CMCase和FPase酶活性;菌株imp的CMCase和FPase酶活性分别为750.12±3.92 U/g和328.18± 1.67 U/g,未检测到LiP、MnP和Lacc酶活性。
利用菌株MA,N019a和imp分别对烟草秸秆进行固态发酵25 d,测定不同菌株发酵后木质纤维中半纤维素,纤维素和木质素降解率(表3),结果表明,菌株N019a,MA和imp发酵25 d后烟草秸秆中半纤维素降解率分别为19.92±1.25%,57.17±5.35%和43.52±4.32%;纤维素降解率分别为18.55±2.39%,26.23±2.55%和63.33±4.81%;木质素降解率分为48.20±4.13%,35.65±4.11%和34.13± 0.53%。不同菌株对木质纤维中不同成分的降解率存在显著差异。
2.2 菌株分子鉴定结果
在NCBI的Genbank上对菌株N019a, MA和imp进行同源性比对并构建了系统发育树(图2)。菌株N019a 与梭形芽胞杆菌Lysinibacillus fusiformisstrain NFS-STR-1 (MF079349.1)相似性达到99% (GenBank:MH327493.1) (图2A);菌株MA与毛栓菌属Trametes hirsutastrain IFM62792 (LC317799.1) 相似性达到99.51% (GenBank:MK357894.1) (图2B);菌株imp与米根霉菌Rhizopus oryzaeR604 (JQ683246.1)相似性达到99% (GenBank: MK358185.1) (图2C)。
2.3 菌株间的拮抗性试验
平板对峙实验结果表明,菌株N019a,MA和imp之间没有拮抗作用(图3),且与本实验室保存的其他纤维素降解菌之间均不存在拮抗作用。
2.4 不同菌株組合的降解性能
从表4可以看出,组合I与组合II相比,组合Ⅱ对半纤维素的降解率显著优于组合Ⅰ,组合Ⅰ对木质素的降解率显著优于组合Ⅱ,而对于纤维素的降解,组合I与组合II无明显差异。组合III(组合Ⅰ+组合Ⅱ)对半纤维素、纤维素及木质素的降解率均显著高于组合Ⅰ和组合Ⅱ,降解效率明显提高。
3 讨 论
微生物降解法是一种安全、低能耗和高效的秸秆处理方式[22]。目前已有不少关于降解菌筛选的研究报道,孙玲等[23]从腐烂秸秆中筛选获得一株纤维素降解菌,发酵10 d对玉米秸秆纤维素的降解率可达24.14%;王洪媛等[24]筛选获得3株高效秸秆纤维素降解真菌,10 d内对小麦秸秆纤维素、半纤维素和木质素的分解率分别为59.06%、78.75%和33.79%。梁军锋等[25]筛选到凤尾菇菌株Tf1,其对小麦和玉米木质素的降解率分别达38.4%和47.7%。刘庆玉等[26]筛选出木质素降解菌X2,在培养第35天时其对木质素的降解率达到43.31%。本试验中菌株N019a能高效降解烟草秸秆中的木质素,降解率为48.20%;半纤维素高效降解菌MA降解率高达57.17%;菌株imp能高效降解烟草秸秆中的纤维素降解率为54.33%,与以前研究报道的结果基本一致[27-28]。所有结果表明,虽然单一菌株能产生降解木纤维不同成分的酶,但是仍然无法解决秸秆结构的复杂性及其内部木质纤维类型的多样性[29]。
随着对木质纤维降解研究的不断深入,发现不同菌群之间的协同作用能促进木质纤维降解效果。李静等[30]从川西高原贡嘎山区土壤中分离筛选菌株,构建了5组纤维素降解复合菌群;青格尔等[31]筛选获得一组高效产纤维素酶且在低温环境下稳定降解秸秆的复合菌群;宋云皓等[32]从内蒙古东部地区采集样品,分离筛选可降解纤维素的菌株,构建5个玉米秸秆降解复合菌群,复合菌群的酶活力值比单菌提高1.1倍以上。本实验将筛选获得的3株降解菌组合成复合菌群I(N019a∶MA∶imp=1∶1∶1),结果表明,组合I中木质素,半纤维素和纤维素的降解率与各自对应菌株N019a,MA和imp所降解的成分比较,分别提高了24.89%,17.59%和12.58%。将实验室保存的3株纤维素降解菌株组合成复合菌群II(B4∶B26∶M90=1∶1∶1),其对半纤维素、纤维素和木质素的降解率分别为72.15±0.35%,65.68±0.55%与38.15±0.76%。本实验将筛选获得的3株降解菌及实验室保存的3株纤维素降解菌株进行复配组合(复合菌群Ⅲ)。结果显示,复合菌群Ⅲ半纤维素、纤维素和木质素的降解 率分别为83.32±0.45%,75.21±0.71%和66.13±0.53%,明显高于本研究中的单菌,复合菌群I和II,也显明高于以前的其他研究结果。以上结果说明,复合菌群降解木质纤维的效果优于单一菌。
综上所述,本研究通过构建多功能复合菌群,显著提高了烟草秸秆木质纤维的降解效果,为农业秸杆废弃的资源化利用提供了新的思路。
参考文献
[1] 伍良伟. 降解烟碱微生物的筛选及在烟秆腐熟发酵中的应用[D]. 武汉:华中农业大学,2013.
WU L W. Isolation of nicotine degradation microbe and its application in the tobacco stalks composting fermentation [D]. Wuhan: Huazhong Agricultural University, 2013.
[2] 闫宁,郭东锋,姚忠达,等. 烟秆还田对烟草生长、产量、质量及病毒病发生的影响[J]. 江西农业学报,2016,28(7):68-72.
YAN N, GUO D F, YAO Z D, et al. Effects of tobacco stalk returning on growth, yield, quality and virus disease occurrence of tobacco[J]. Acta Agriculturae Jiangxi, 2016, 28(7): 68-72.
[3] 王敏. 废次烟草中有效成分的综合利用[J]. 中国资源综合利用,2003(2):16-18.
WANG M. Comprehensive utilization of active ingredients in waste tobacco[J]. Comprehensive Utilization of Resources in China, 2003(2): 16-18.
[4] 韩非,王瑞. 烟草秸秆生物有机肥产业化绿色发展的现状与策略[J]. 中国烟草学报,2016,22(3):126-132.
HAN F, WANG R. Status quo and development strategy of green development of tobacco stalks organic fertilizer industrialization[J]. Acta Tabacaria Sinica, 2016, 22(3); 126-132.
[5] 陈跃辉. 细菌 Novosphingobium sp B-7 和 Comamonas sp B-9 降解木质素及其降解基因研究[D]. 长沙:中南大学,2013.
CHEN Y H. Study on the lignin degradation and related genes of Novosphingobium sp. B-7 and Comamonas sp. B-9[D]. Changsha: Central South University, 2013.
[6] KARMAKAR S, GREENE H L. Oxidative destruction of chlorofuorocar- bonsby zeolite catalysts [J]. J Catal, 1992, l38: 364.
[7] 陈辰,朱润琪,倪新程,等. 一株新的尼古丁降解菌的分离鉴定及降解特性[J]. 中国烟草科学,2019,40(1):89-97.
CHEN C, ZHU R, NI X C, et al. Isolation, identification and characteristics of a new nicotine degrading strain[J]. Chinese Tobacco Science, 2019, 40(1): 89-97.
[8] GUTIERREZ-CORREA M, PORTAL L, MORENO P, et al. Mixed culturesolid substrate fermentation of Trichoderma reesei with Aspergillusniger on sugar cane bagass[J] Bioresour Tcchnol, 1999, 68 (2): 173-178.
[9] AWAFO V A, CHAHAL D S, SIMPSON B K. Evaluation of combinationtreatments of sodium hydroxide and steam explosion for the production of cellulose-systems by two T. reesei mutants under solid-statefermentation conditions[J]. Bioresour Technol, 2000, 73 (2): 235-245.
[10] 鄒芳. 烟草秸秆降解菌YC-2的分离鉴定、发酵参数、产酶条件及酶学特性研究[D]. 南京:南京农业大学,2015.
ZOU F. Isolation, Identification, Fermentation Conditions, Enzyme Production Conditions and Enzymatic Properties of The Tobacco Straw Degradation Strain Bacteria YC-2[D]. Nanjing: Nanjing Agricultural University, 2015.
[11] 梁朝宁,薛燕芬,马延和. 微生物降解利用木质纤维的协同作用[J]. 生物工程学报,2010,26(10):1327-1332.
LIANG C N, XUE Y F, MA Y H. Microbial degradation utilizes the synergistic effect of lignocellulose [J]. Chinese Journal of Biotechnology, 2010, 26(10): 1327-1332.
[12] 赵德清,戴亚,冯广林,等. 烟秆的化学成分, 纤维形态与生物结构[J]. 烟草科技,2016,49(4):80-86.
ZHAO D Q, DAI Y, FENG G L, et al. Chemical composition, fiber morphology and biological structure of tobacco stalks[J]. Tobacco Science & Technology, 2016, 49(4): 80-86.
[13] ZHANG D, WANG Y, ZHENG D, et al. New combination of xylanolytic bacteria isolated from the lignocellulose degradation microbial consortium XDC-2 with enhanced xylanase activity[J]. Bioresource Technology, 2016, 221: 686-690.
[14] PUENTES-T?LLEZ P E, SALLES J F. Construction of effective minimal active microbial consortia for lignocellulose degradation[J]. Microbial Ecology, 2018, 76(2): 419-429.
[15] BAI Y, M?LLER D B, SRINIVAS G, et al. Functional overlap of the Arabidopsis leaf and root microbiota[J]. Nature, 2015, 528(7582): 364.
[16] M?LLER D B, SCHUBERT O T, R?ST H, et al. Systems-level proteomics of two ubiquitous leaf commensals reveals complementary adaptive traits for phyllosphere colonization[J]. Molecular & Cellular Proteomics, 2016, 15(10): 3256-3269.
[17] 石娜娜. 煙秆纤维素降解菌的筛选及在烟秆堆肥上的应用[D]. 武汉:华中农业大学,2012.
SHI N N. Screening of cellulose degrading bacteria from tobacco straw and their application in tobacco straw composting[D]. Wuhan: Huazhong Agricultural University, 2012.
[18] 尹静,刘悦秋,于峰,等.一株木质素降解菌的筛选鉴定及其在堆肥中的应用[J]. 中国土壤与肥料,2019(3):
179-185.
YIN J, LIU Y Q, Y U F, et al. Screening and identification of a lignin-degrading bacterium and its application in composting[J]. Chinese Soil and Fertilizer, 2019(3): 179-185.
[19] MARTINA V, STANISLAVA V, VRATISLAV L. et al. Induction of laccase, lignin peroxidase and manganese peroxidase activities in white-rot fungi using copper complexes[J]. Molecules, 2016, 21(11):1553.
[20] 柳焕章,刘建钗,周敬霄. 微生物间拮抗的研究方法与农业应用[J]. 安徽农业科学,2011,39(3):1310-1314.
LIU H Z, LIU J H, ZHOU J X. Research methods and agricultural application of microbial antagonism[J]. Anhui Agricultural Science, 2011, 39 (3): 1310-1314.
[21] SLUITER A, HAMES B, RUIZ R, et al. Determination of structural carbohydrates and lignin in biomass[J]. Laboratory Analytical Procedure, 2008, 1617: 1-16.
[22] 李慧君. 秸秆纤维素降解菌的筛选及其利用研究[D]. 咸阳:西北农林科技大学,2010.
LI H J. Screening and utilization of straw cellulose degrading bacteria[D]. Xianyang: Northwest A & F University, 2010.
[23] 孫玲,吴景贵,李建明,等. 纤维素降解细菌对玉米秸秆的降解效果[J]. 吉林农业大学学报,2019,41(4):402-407.
SUN L, WU J G, LI J M, et al. Degradation effect of cellulose degrading bacteria on corn stalk [J]. Journal of Jilin Agricultural University, 2019, 41(4): 402-407.
[24] 王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报,2010,50(7):870-875.
WANG H Y, FAN B Q. Screening of three high-efficiency straw cellulose degrading fungi and their degradation effects [J]. Acta Microbiologica Sinica, 2010, 50 (7): 870-875.
[25] 梁军锋,张洪生,张克强,等. 木质素降解菌的筛选及对秸秆的降解研究[J]. 华北农学报,2009,24(5):206-209.
LIANG J F, ZHANG H S, ZHANG K Q, et al. Screening of lignin degrading bacteria and degradation of straw[J]. Journal of North China Agricultural, 2009, 24 (5): 206-209.
[26] 刘庆玉,陈志丽,张敏. 木质素降解菌的筛选[J]. 太阳能学报,2010,31(2):269-272.
LIU Q Y, CHEN Z L, ZHANG M. Screening of lignin-degrading bacteria [J]. Journal of Solar Energy, 2010, 31 (2): 269-272.
[27] SHAHID S, TAJWAR R, AKHTAR M W. A novel trifunctional, family GH10 enzyme from Acidothermus cellulolyticus 11B, exhibiting endo-xylanase, arabinofuranosidase and acetyl xylan esterase activities[J]. Extremophiles, 2018, 22(1): 109-119.
[28] 27RASTOGI G, BHALLA A, ADHIKARI A, et al. Characterization of thermostable cellulases produced by Bacillus and Geobacillus strains[J]. Bioresource Technology, 2010, 101(22): 8798-8806.
[29] HADAR Y, KEREM Z, GORODECKI B. Biodegradation of lignocellulosic agricultural wastes by Pleurotus ostreatus[J]. Journal of Biotechnology, 1993, 30(1): 133-139.
[30] 李静, 张瀚能, 赵翀, 等. 高效纤维素降解菌分离筛选, 复合菌群构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016, 22(4): 689-696.
LI J, ZHANG H N, ZHAO Y, et al. Isolation and screening of high-efficiency cellulose-degrading bacteria, construction of composite strains and analysis of straw degradation effect [J]. Journal of Applied and Environmental Biology, 2016, 22 (4): 689-696.
[31] 青格尔, 高聚林, 于晓芳, 等. 玉米秸秆低温高效降解复合菌群 GF-20 的菌种组成及降解稳定性研究[J]. 中国农业科学, 2016, 49(3): 443-454.
QING G E, GAO J L, YU X F, et al. Study on the strain composition and degradation stability of corn stalk at low temperature and high efficiency to degrade the composite strain GF-20 [J]. Chinese Agricultural Science, 2016, 49 (3): 443-454 .
[32] 宋云皓, 满都拉, 郜晋楠, 等. 玉米秸秆纤维素降解菌的筛选及复合菌群的构建[J]. 饲料工业, 2017, 38(19): 33-37.
SONG Y H, MAN D L, TONG J N, et al. Screening of corn straw cellulose degrading bacteria and construction of complex strains [J]. Feed Industry, 2017, 38 (19): 33-37.
