木质素清洁高效分离研究进展
2019-09-10金永灿谷峰
金永灿 谷峰



摘 要:当前的木质素分离技术已基本解决木质素分离的得率和纯度问题,但决定木质素最终高值化利用潜力的是其反应活性(通常指木质素中β O 4键的含量)。现有分离技术对木质素反应活性的保护能力还不够,在相当程度上影响了木质素产品的开发和应用。造成分离过程中木质素反应活性下降或不均一的原因主要有3点:原料中木质素自身结构复杂;木质素分离的具体方法多样;木质素分离反应条件的剧烈程度。本文聚焦后两点,对现有木质素分离方案进行综述,并通过对现有方案的比较,提出对木质素分离方法发展趋势的展望。
关键词:木质素;分离;β O 4含量;高值化;反应活性
中图分类号:TS721
文献标识码:A
DOI:10.11980/j.issn.0254 508X.2019.06.010
Research Progress in Clean and Efficient Separation of Lignin
JIN Yongcan1,* GU Feng2,3
(1. Jiangsu Provincial Key Lab of Pulp and Paper Science and Technology, Nanjing Forestry University, Nanjing, Jiangsu Province,
210037; 2. School of Chemistry and Chemical Engineering, Yancheng Institute of Technology, Yancheng, Jiangsu Province, 224051;
3. Jiangsu Provincal Key Lab of Biomass Engergy and Materials, Nanjing, Jiangsu Province, 210042)
(*E mail: jinyongcan@njfu.edu.cn)
Abstract:Current lignin separation strategies basically fulfill the demand of the separation yield and purity of lignin, however, the potential of lignin high value application depends on its reactivity (usually referring to the β O 4 content in separated lignin). The existing separation technologies are not good enough to protect the structural integrity of lignin during fractionation. The main reasons for the decrease or heterogeneity of lignin reaction activity in the separation process are as follows: the structure of lignin in raw materials is complex, the specific separation methods are various, and the intensity of separation conditions is severe. Focusing on the latter two points, this paper summarizes the existing lignin separation schemes, and puts forward the prospect of the development trend of lignin separation methods through the comparison of the existing ones.
Key words:lignin; fractionation; β O 4 content; valorization; reaction activity
木質纤维由纤维素、半纤维素及木质素组成,是一种储量大、分布广、碳中性、非粮竞争性的可再生能源,有望替代化石能源[1 2]。但其对化学、生物等转化具有天然抗性,直接利用效率低下。通过生物质炼制实现组分分离,再分别对各组分进行高效资源转化,是当前木质纤维生物质高值化利用最为有效的途径[3]。其中,纤维素和半纤维素结构相对简单,分离后通过化学催化或生物发酵可以得到纸制品、纳米纤维素材料、醇烃燃料、小分子化学品等[4 5]。而剩下的木质素,则由于自身天然结构复杂,且分离过程中常伴随芳基醚键断裂及C—C缩合结构生成,导致其网络结构坍塌,反应活性下降,在现有的工业分离条件下,无法实现有效分离及高值转化[6 7]。但是,木质素作为自然界中唯一可再生的芳香族化合物,可用于生产生物质燃料、轻质芳烃及其他芳香性小分子化合物等,应用潜力巨大、前景广泛[8]。因此,如何在保持原有结构特点的前提下,实现木质素的高效分离已成为当前国内外生物质炼制领域的研究热点。本文对当前木质素高效分离的研究进展进行综述,并对各分离方法的脱木质素率及分离后木质素的反应活性进行了比较。
1 木质素基本结构
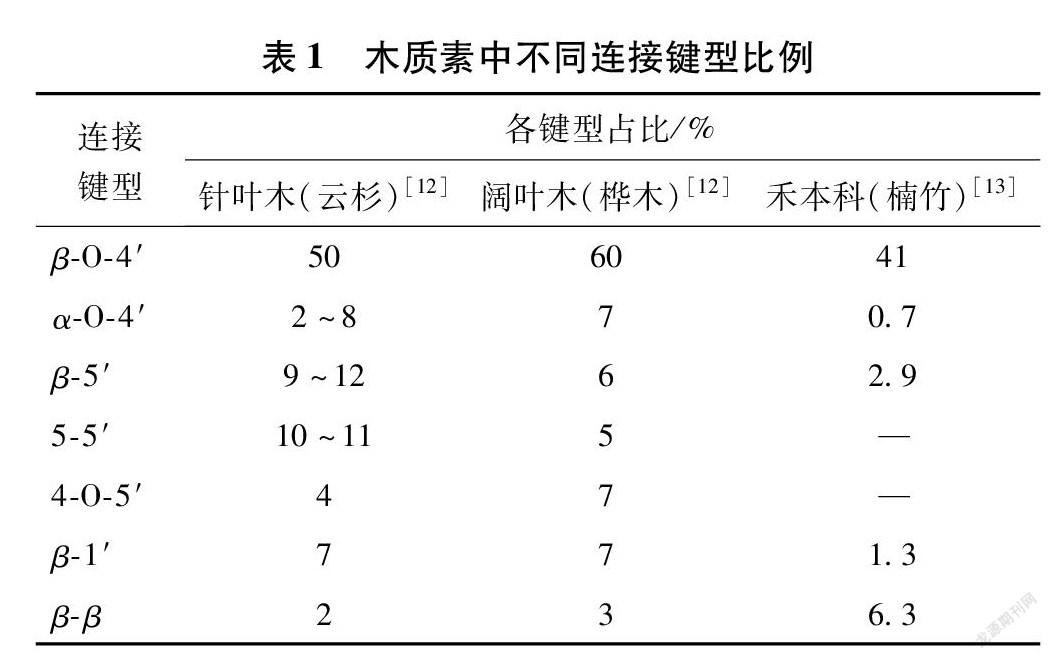
作为天然可再生芳香性聚合物,木质素是由三种前驱体(对香豆醇、松柏醇和芥子醇),在生物酶作用下经脱氢聚合及自由基偶合形成的无序大分子。其单体间主要存在β O 4′、β 5′、β β′、β 1′等连接键型(见图1与表1),其端基单元通常为醛基,如肉桂醛。木质素分子结构中还包含甲氧基、酚羟基、醇羟基,具有一定的化学反应活性[9]。不同物种木质素分子的苯环具有不同结构单元,针叶木木质素主要由愈创木基型(G型)构成,阔叶木木质素主要由愈创木基型和紫丁香基型(S型)单体聚合而成,而禾草类植物木质素除上述两种结构单元外,还含有对羟苯基型(H型)结构单元[10],当然木材中也含有少量H型木质素。同时,木质素与碳水化合物间存在一定程度的化学交联,主要连接类型有苄基醚键(BE)、γ 酯键(γ Est)、苯基糖苷键(PhGlc)等[11],其中,禾草类植物的木质素常通过阿魏酸与碳水化合物形成桥连。虽然木质素单元结构与连接键型已基本明确,但各键型之间无序的连接导致木质素缺乏明确的一级结构,从而使其难以高效分离及利用。
2 木质素的高效分离研究进展
木质素分离方法按用途可分为两类:基于定性分析的木质素分离和基于生物质炼制的木质素分离。前者分离的目的主要是为了对木质素进行定性分析,如磨木木质素(Milled wood lignin, MWL)、酶解木质素(Cellulolytic enzyme lignin, CEL)等。后者则是在木质纤维生物质加工转化过程中,对植物细胞壁中木质素进行组分分离,最典型的是木质纤维原料的化学制浆。虽然木质素分离方法多样,所得木质素产品特性及用途也不尽相同,但归根结底,其分离原理只有两种[14]:一是从原料中释放(溶解)出木质素,将纤维素、半纤维素保留在残渣中;二是将原料中纤维素、半纤维素降解溶出,从而使木质素得以保存。
2.1 基于定性分析的木质素分离
用于定性分析的木质素分离,通常要求分离的木质素具有得率高、结构变化小的特点。1954年Bjrkman[15]提出了磨木木质素(MWL)的制备方法,该方法至今仍广泛应用于木质素的结构分析与表征。但MWL也存在一些缺点,如得率相对较低、代表性不强,因此很多研究者致力于对该方法进行改进,以提高其分离得率。Pew等人[16]在Bjrkman方法的基础上,采用纤维素酶处理球磨木粉除去大部分碳水化合物,并将酶解残渣用96%的1.4 二氧六环抽提,得到CEL。CEL与MWL具有极其相似的化学结构,且CEL得率明显高于 MWL,因此被认为更能代表天然木质素。但CEL酶解过程用时较长,得到的粗木质素残糖含量较高,且部分酶蛋白与木质素结合,难以完全除去。
在传统MWL和CEL的基础上,研究人员也在不斷尝试新的木质素分离方法,以期获得代表性好、得率高、结构变化小的木质素制备物。Chen等人[17]用二甲基乙酰胺/氯化锂(DMAc/LiCl)预润胀球磨木粉,再利用反溶剂(水或乙酸乙酯)对木粉进行再生,随后用酶处理及二氧六环抽提,获得润胀酶解木质素(swelled enzyme lignin, SEL)。研究表明,润胀 再生处理步骤不仅缩短了酶解时间,而且提高了酶解效率,从而提高了木质素抽提得率。2003年,Wu等人[18]利用弱酸将木质素 碳水化合物复合体(Lignin carbohydrate complex, LCC) 连接先一步打断,再用85%的二氧六环水溶液对酶解残渣进行加温抽提(86℃),制得酶解 温和酸解木质素(EMAL)。相较于MWL和CEL,EMAL得率更高,且在 EMAL 提取过程中LCC连接键发生断裂,其糖含量也更少。此法适用于木材原料中木质素的分离,但不适用于禾草类原料中木质素的分离,主要原因是草类原料LCC连接较多。Chen等人[19]提出了一种基于两次球磨和两次酶解的残渣木质素制备方法,该法分离的木质素具有得率高、含糖量低、结构完整等优点。另外,一些学者提出利用全溶体系将植物细胞壁进行原位溶解,并用2D NMR对其中木质素、纤维素、半纤维素进行结构分析的方法。Lu等人[20]使用二甲基亚砜/四丁基铵(DMSO/TBA)或二甲基亚砜/甲基咪唑(DMSO/NMI)溶解木质纤维素,并对整个植物细胞壁溶液进行了NMR分析。Wang等人[21]报道了氯化锂/二甲基亚砜(LiCl/DMSO)溶剂系统,并将该溶剂用于2 h球磨木粉的溶解。虽然此类原位溶解获得几乎100%植物细胞壁溶液,但由于高聚糖、木质素同时存在,其内部结构极其复杂,现有仪器分析手段难以对其进行精确分析。为此,Meng等人[22]将球磨木粉溶于LiCl/DMSO溶剂中,再以水作为反溶剂对木粉进行再生,然后对再生木粉进行酶解、二氧六环抽提,获得再生酶解木质素(RCEL)。Gu等人[23]利用RCEL方法对麦草木质素进行抽提(见图2),从球磨4 h麦草粉中抽提出73.2%的木质素,比同等条件下CEL高出4%。2D HSQC分析表明,RCEL与CEL具有相似的结构,且RCEL中糖含量较低。上述木质素分离主要用于结构研究,由于其处理流程冗长,处理成本过高,虽然此类方法所得木质素得率高,结构完整性强,但并不适用于木质素高值转化。
2.2 基于生物质炼制的木质素分离
制浆导向的组分分离(如烧碱法、硫酸盐法、低沸醇法、甲酸法等),为保证高聚糖(纤维素、半纤维素)组分的有效利用,通常需要在剧烈反应条件下脱除木质素。此类方法木质素脱除率虽然高(≥90%),但所得木质素β O 4含量普遍较低(3%~10%),而β O 4含量与木质素反应活性呈正相关,标志着其高值化潜力[24]。新兴制糖导向的组分分离(如弱酸、弱碱预处理,酸、碱爆破预处理,有机溶剂预处理等),由于条件相对缓和,木质素脱除率一般较低(30%~50%),所得木质素中β O 4含量较高(30%~45%)[7]。显然,在木质素资源化潜力方面,预处理要优于传统制浆,但预处理中较低的木质素得率,同样限制其高值转化。高得率是木质素高值化应用的前提,高反应活性则标志着木质素高值化潜力。现有木质素分离无法兼顾木质素的得率与反应活性,这是造成木质素难以利用的直接原因。本文对现有生物质炼制导向的木质素分离方法进行综述,以寻求各方法间的内在联系,为高得率、高反应活性木质素分离方案的制定提供依据。
2.2.1 酸法分离木质素
使用72%的浓硫酸水解木质纤维原料分离出的酸不溶木质素,被称为Klason木质素。该法主要应用于木质素定量分析,不太适于木质素的结构研究。另外,盐酸、氢氟酸、甲酸、乙酸等[25],都曾被用来分离过木质素。通常来说,酸法分离木质素,得率较低、反应活性不高,但甲酸是一个特例。1982年Jordan首次研究了甲酸制浆,后来该法逐渐被欧洲、日本等地的学者所关注。甲酸对木质素具有良好的溶解性能,且甲酸和过氧化氢在室温下产生的过氧甲酸,还能在蒸煮过程中选择性脱除木质素,而不与纤维素发生反应。过氧甲酸对木质素的氧化作用增强了木质素的亲水性,使其溶解性能得到提高。王君等人[26]采用85%甲酸/3%过氧化氢体系处理麦草,在95℃下反应1 h后,麦草的木质素脱除率接近90%。研究指出,木质素在甲酸等的作用下发生化学反应,导致木质素β O 4断裂、酚羟基含量上升、C—C缩合结构产生及木质素侧链甲酰化。虽然该法分离的木质素得率高,但由于β O 4的大量断裂,极大地限制了其高值化潜力。近期,美国农业部林产品实验室[27 28],发现利用质量分数80%的对 甲苯磺酸在80℃、20 min条件下处理杨木即可从中分离出近90%的木质素。对 甲苯磺酸是一种酸性助溶剂,难溶于冷水但易溶于热水,当其在水中溶解至一定浓度时,可显著增加木质素在水中的溶解度[29 30],并且还可通过重结晶对其进行回收。但即使在该法如此温和的反应条件下,仍发现β O 4有一定程度的降解。
2.2.2 碱法分离木质素
硫酸盐法、亚硫酸盐法虽然可以用来分离木质素,但分离出的木质素β O 4含量(≤1%)过低。弱碱预处理,如NaOH、Ca(OH)2可以在160~180℃、2~3 h的蒸煮条件下分离木质素 [31],但是木质素分离效率较低(20%~40%)。利用绿液(Na2S+Na2CO3)对各类木质纤维素原料进行预处理[32 35],发现弱碱预处理对阔叶材及草类原料的木质素分离较为有效,对针叶材原料木质素分離效果较差。通常在8%~16%用碱量,20%~40%硫化度、140~160℃、1~2 h的预处理条件下,可以从阔叶木或草类原料中分离出30%~50%的木质素。绿液预处理之所以比普通弱碱预处理有效,是因为绿液中CO2-3与HS-能够产生一定的协同效应,即使在很弱的碱性条件下,也能够促进木质素β O 4键的部分断裂,从而增加木质素在绿液中的溶解度[36]。除此之外,氨水脱木质素也是一种重要的木质素分离方法。首先,氨水对木质素具有较好溶解性。其次,氨水为弱碱,可以在分离过程中部分降解木质素芳基醚键以及LCC键,从而提高木质素脱除率。另外,氨水易挥发,可通过蒸发回收药品。在所有氨法分离木质素工艺中,以氨爆法(AFEX)最为典型[37],这种方法尤其适合草类原料。利用AFEX在温度60~160℃的条件下,从麦草原料中分离出50%~65%的木质素,且分离木质素中的β O 4含量(≥30%)较高[38]。
2.2.3 有机溶剂法分离木质素
使用有机溶剂分离木质素与现有酸法、碱法相比具有以下优点:①有机溶剂易挥发,抽提后无需清洗,通过减压蒸馏即可将木质素快速分离;②有机溶剂易于回收及循环使用,减轻环境压力;③有机溶剂的酸碱性相对温和,与木质素的反应性较少。目前,用于分离木质素最成功的有机溶剂是脂肪醇。脂肪醇分离木质素,主要利用其对木质素的溶解性。同时分离过程中,木质素芳基醚键发生部分断裂,导致其发生碎片化,增加了其在有机溶剂中的溶解度。研究者通常在酸催化(0.1%HCl)、温度100~250℃条件下,利用甲(乙)醇对木质素进行溶解,并以水作反溶剂,使木质素从蒸煮液中再生出来,从而获得甲(乙)醇木质素[39]。研究结果表明,甲(乙)醇木质素相对分子质量较低,纯度较高,且木质素分子结构中羟基含量显著上升。另外,高沸醇也可以用于木质素的分离,如正丁醇和正戊醇就对木质素具有良好的脱除效果。Wang等人[40]利用体积比为80∶20的1.4 丁二醇/水为溶剂,在190℃、90 min的分离条件下提取木质素,木质素提取率高达94%,而且木质素具有较高的相对分子质量和热稳定性,但1.4 丁二醇不易回收,工业化难度较大。根据文献报道,脂肪醇分离的木质素β O 4含量(12%~16%)要优于传统酸碱蒸煮(3%~10%)[7]。这是因为在高浓脂肪醇蒸煮时,脂肪醇可以与木质素的α位发生烷氧基化反应,保护木质素的α位,阻止其发生进一步降解。Luterbacher等人[41]发现γ 戊内酯/水体系,在0.5%硫酸催化下能溶解木质纤维素,冷却后自动分层,得到含碳水化合物的水相和含γ 戊内酯有机相,同时析出具有高反应活性的木质素,但该法所得高聚糖组分为低聚糖、单糖及其衍生物,其高值化存在一定局限。
2.2.4 离子液体法分离木质素
离子液体可以选择性地断裂纤维素、半纤维素和木质素之间的连接键,根据其选择性差异,可以将离子液体分离木质素的方法分为两类:①离子液体全溶体系。该体系可利用离子液体将纤维素、半纤维素、木质素全部溶解,再利用反溶剂将纤维素、木质素分别再生,从而获得木质素产品[42];②离子液体部分溶解体系。该体系可利用离子液体将原料中半纤维素、木质素抽提出来,再利用反溶剂,使木质素沉淀,从而达到木质素分离的效果[43]。离子液体中阴、阳离子的不同对木质素的溶解都有一定的影响。在离子液体木质素分离过程中,硫酸根、乙酸根、磷酸根可通过亲核取代,促进木质素β O 4连接键的断裂[44]。随着烷基链长的增加,阳离子的聚合度随之增加,从而阻碍阳离子、阴离子与木质素的接触,使得木质素的溶解性降低[45]。经研究发现,由于离子液体分离木质素通常需要高温长时间等剧烈条件,其分离所得木质素β O 4含量(≤10%)同样较低,与脂肪醇木质素接近[7]。同时离子液体价格高昂,毒性较大,难以工业化。为了克服这一问题,一种低毒、可生物降解、价格低廉、易于制备的新型溶剂,低共熔体系(DES,也被称为第三代离子液体)进入研究者的视野。Francisco等人[46]发现胆碱类低共熔溶剂(DESs)具有溶解木质素但不溶解纤维素的特性。常杰等人[47]报道了氯化胆碱/乳酸体系,在摩尔比1∶9、90℃、12 h的条件下,可将桉木中90%木质素溶解出来,且纯度为96%。但是Shen等人[48]研究相同体系,发现在摩尔比1∶10、90℃、6 h 的条件下,桉木木质素中61.3%的β O 4发生降解。当温度升至130℃时,β O 4几乎消失。本课题组的最新研究结果(未发表数据)显示,利用对 甲苯磺酸/氯化胆碱体系,在75%对 甲苯磺酸/25%氯化胆碱、80℃、20 min的条件下,分离出南荻中77%的木质素。由于反应条件温和,木质素中β O 4含量达到33.2%,而南荻MWL中β O 4含量为35.8%,即采用对 甲苯磺酸/氯化胆碱体系分离制备的木质素,绝大部分的β O 4得以保留。
2.2.5 木质素分离过程中的淬灭手段
除了开发新型溶剂、运用温和处理条件外,还可适当的利用物理、化学淬灭手段,实现高得率、高活性木质素的分离。Kim等人[4]研制了一种氨循环渗流(Flow through)工艺,在150~170℃下使氨水通过装有生物质原料的柱状反应器,将被溶解的木质素瞬间带离反应区域,此工艺使木质素脱除率可达75%,且木质素产品反应活性较高,其中β O 4含量高达45%。此过程氨水可循环利用,在一定程度上减少了环境污染及能源消耗,节约了生产成本。利用同样的技术,在稀酸预处理的条件,也可以分离出原料中24%的木质素,若不使用该技术,其木质素脱除率仅为12%[49]。Ferrini和Rinaldi[50]在木质素β O 4降解时,利用同步催化加氢阻止木质素C—C缩合,获得了26%得率的木质素油,2D NMR表明该木质素油具有较高反应活性。Shuai等人[51]在木质素解聚过程中加入甲醛,可以使木质素侧链的α羟基和γ羟基迅速发生缩醛反应,形成稳定的1.3 二氧六环结构,抑制木质素自缩合反应。以上研究表明,在木质素分离过程中,即使无法阻止β O 4的断裂,也可以通过适当淬灭手段阻止其发生进一步C—C缩合反应,从而提高分离后木质素的反应活性。
3 对木质素分离方法的展望
以上研究说明,当前的木质素分离技术已基本解决木质素分离的得率和纯度问题,如甲酸法、低共熔溶剂法、对 甲苯磺酸法均可脱除阔叶木或草类原料中80%~90%的木质素,且所获木质素组分纯度极高(≥90%)[25]。但决定木质素最终高值化利用潜力的是其反应活性,现有木质素分离技术对木质素反应活性的保护能力还不够。造成分离过程中木质素反应活性下降的原因主要有3个:①原料中木质素自身结构复杂;②木质素分离的具体方法多样;③木质素分离反应条件的剧烈程度。研究表明,相较于强酸性、强碱性溶剂而言,中性有机溶剂更加有利于在木质素分离过程中保持木质素的结构完整性及反应活性。通过对22种有机溶剂木质素样品的研究发现,用于分离木质素的溶剂及分离木质素的反应条件,与分离木质素中β O 4含量具有强烈的相关性。提高溶剂的酸度、提升反应温度以及延长反应时间,均不利于β O 4的保护[52]。但是在木质素分离过程中,不提高反应剧烈程度,木质素又难以发生降解及溶出,致使得率偏低。在大多数研究中,木质素样品的得率与反应活性往往呈反比[8]。因此如何保持木质素降解与溶解的平衡,使分离后木质素产品高值利用潜力最大化,是木质素高效分离研究领域亟待解决的一个核心问题。未来新型木质素分离体系的开发思路,可以从下列两个角度考虑。
(1)利用计算机模拟研究木质素微观溶解机理,指导新型溶剂体系研发。木质素分离是一个由降解、溶解协同作用组成的相转移过程。首先木质素分子内作用力被破坏,即β O 4醚键发生断裂,使木质素碎片化,而后木质素碎片与溶剂产生更稳定的弱相互作用,即木质素由固相转移至液相。Zhang等人[53]通过密度泛函理论(DFT)计算离子液体与木质素的交互作用,认为当木质素与离子液体间弱相互作用(氢键与π—π堆叠)大于木质素分子间弱相互作用时,即发生溶解。Xia等人[54]也曾利用DFT计算并结合K T溶剂染料显色法设计出氯化胆碱/甘油/氯化铝三元低共熔溶剂体系,并获得高得率的杨木木质素。所以利用计算机模拟技术,设计开发适用于木质素溶解的溶剂体系,能够使得木质素高效分离的研究事半功倍。
(2)研究脱木质素反应动力学,促进木质素降解调控机制完善。木质素在碱性条件中的β O 4醚键断裂,主要通过邻基参与(NGP)反应完成,而酸性条件下,可能存在Prins逆反应路径和Hibbert酮反应路径。并且β O 4醚键断裂的同时,会发生C—C缩合反应,降低木质素反應活性及高值化潜力。从脱木质素热力学角度来看,木质素发生β O 4断裂的同时,其C—C缩合反应是不可避免的,但可以从动力学角度出发,对β O 4降解反应进行淬灭,即通过适当的物理、化学手段中断反应。即使无法阻止β O 4降解,但是可通过在恰当的时机引入淬灭手段,及时终止C—C缩合反应,同样可以达到保护分离后木质素反应活性的效果。
4 结 语
本文中所述木质素分离方案,如甲酸法、低共熔溶剂法、对 甲苯磺酸法,均可解决木质素分离的得率和纯度问题。得率和纯度仅仅是木质素利用的基础,决定木质素高值化利用潜力的是其反应活性。但是,迄今为止未见能够同时兼顾木质素分离得率、纯度以及反应活性的方案。笔者对文中所述木质素分离方案,进行总结分析,认为一个高效的木质素分离方案须满足以下3点:具有一定酸碱强度,以确保木质素发生部分降解;具有强大的木质素溶解性和选择性,以确保木质素高效溶出;具备调控(淬灭)机制,以防木质素过度降解,影响其后续高值转化。在充分考虑以上几点的基础上,选择合适的溶剂及分离条件,有望最终实现木质素的高效清洁分离。
参 考 文 献
[1] Cao L C, Yu I K M, Liu Y Y, et al. Lignin valorization for the production of renewable chemicals: State of theart review and future prospects[J]. Bioresource Technology, 2018, 269: 465.
[2] Zhu C J, Zhang H Y, Xiao R, et al. Research progress in catalytic valorization of lignocellulose[J]. Scientia Sinica Chimica, 2015, 45(5): 454.
朱晨杰, 张会岩, 肖 睿, 等. 木质纤维素高值化利用的研究进展[J]. 中国科学: 化学, 2015, 45(5): 454.
[3] Mimini V, Kabrelian V, Fackler K, et al. Lignin based foams as insulation materials: a review[J]. Holzforschung, 2019, 73(1): 117.
[4] Kim J S, Lee Y Y, Kim T H. A review on alkaline pretreatment technology for bioconversion of lignocellulosic biomass[J]. Bioresource Technology, 2016, 199: 42.
[5] Wen J L, Yuan T Q, Sun R C. Biorefining and multistage utilization of lignocellulosic biomass[J]. Biotechnology and Business, 2017(3): 94.
文甲龍, 袁同琦, 孙润仓. 木质纤维素生物质炼制和多级资源化利用技术[J]. 生物产业技术, 2017(3): 94.
[6] Renders T, Van Den Bosch S, Koelewijn S F, et al. Lignin first biomass fractionation: the advent of active stabilisation strategies[J]. Energy & Environmental Science, 2017, 10(7): 1551.
[7] Schutyser W, Renders T, Van Den Bosch S, et al. Chemicals from lignin: an interplay of lignocellulose fractionation, depolymerisation, and upgrading[J]. Chemical Society Reviews, 2018, 47(3): 852.
[8] Rinaldi R, Jastrzebski R, Clough M T, et al. Paving the way for lignin valorisation: recent advances in bioengineering, biorefining and catalysis[J]. Angewandte Chemie, 2016, 55(29): 8164.
[9] Adler E. Lignin chemistry past, present and future[J]. Wood Science and Technology, 1977, 11(3): 169.
[10] Guragain Y N, Herrera A I, Vadlani P V, et al. Lignins of bioenergy crops: a review[J]. Natural Product Communications, 2015, 10(1): 201.
[11] Balakshin M, Capanema E, Gracz H, et al. Quantification of lignin carbohydrate linkages with high resolution NMR spectroscopy[J]. Planta, 2011, 233(6): 1097.
[12] Adler E. Lignin chemistry—past, present and future[J]. Wood Science and Technology, 1977, 11(3): 169.
[13] Huang C X, He J, Du L T, et al. Structural characterization of the lignins from the green and yellow bamboo of bamboo culm(Phyllostachys pubescens)[J]. Journal of Wood Chemistry and Technology, 2016, 36(3): 157.
[14] Ponnusamy V K, Nguyen D D, Dharmaraja J, et al. A review on lignin structure, pretreatments, fermentation reactions and biorefinery potential[J]. Bioresource Technology, 2019, 271: 462.
[15] Bjrkman A. Isolation of lignin from finely divided wood with neutral solvents[J]. Nature, 1954, 174(4440): 1057.
[16] Pew J C, Weyna P. Fine grinding, enzyme digestion, and the lignin cellulose bond in wood[J]. Tappi Journal, 1962, 45(3): 247.
[17] Chen J Y, Shimizu Y, Takai M, et al. A method for isolation of milled wood lignin involving solvent swelling prior to enzyme treatment[J]. Wood Science and Technology, 1995, 29(4): 295.
[18] Wu S, Argyropoulos D S. An improved method for lsolating lignin in high yield and purity[J]. Journal of Pulp and Paper Science, 2003, 2003(29): 235.
[19] Chen T Y, Wang B, Wu Y Y, et al. Structural variations of lignin macromolecule from different growth years of triploid of Populus tomentosa Carr[J]. International Journal of Biological Macromolecules, 2017, 101: 747.
[20] Lu F, Ralph J. Non degradative dissolution and acetylation of ball milled plant cell walls: high resolution solution state NMR[J]. Plant Journal, 2003, 35: 535.
[21] Wang Z G, Yokoyama T, Chang H M, et al. Dissolution of beech and spruce milled woods in LiCl/DMSO[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6167.
[22] Meng L Y, Kang S M, Zhang X M, et al. Isolation and physico chemical characterization of lignin from hybrid poplar in DMSO/LiCl system induced by microwave assisted irradiation[J]. Cellulose Chemistry and Technology, 2012, 46(5/6): 409.
[23] Gu F, Wu W J, Wang Z G, et al. Effect of complete dissolution in LiCl/DMSO on the isolation and characteristics of lignin from wheat straw internode[J]. Industrial Crops and Products, 2015, 74(703): 711.
[24] Lancefield C S, Rashid G M M, Bouxin F, et al. An Investigation of the chemocatalytic and biocatalytic valorisation of a range of different lignin preparations: the importance of β O 4 content[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(12): 6921.
[25] Wen J L, Chen T Y, Sun R C. Research progress on separation and structural analysis of lignin in lignocellulosic biomass[J]. Journal of Forestry Engineering, 2017, 2(5): 76.
文甲龙, 陈天影, 孙润仓. 生物质木质素分离和结构研究方法进展[J]. 林业工程学报, 2017, 2(5): 76.
[26] WANG Jun, FAN Yongming, GUO Fenghua, et al. Structural Changes of Lignin in Formic Acid Cooking of Wheat Straw[J]. Transactions of China Pulp and Paper, 2005, 20(s1): 267.
王 君, 樊永明, 郭奉华, 等. 麥草甲酸法蒸煮过程中木素结构变化研究[J]. 中国造纸学报, 2005, 20(s1): 267.
[27] Chen L H, Dou J Z, Ma Q L, et al. Rapid and near complete dissolution of wood lignin at ≤80℃ by a recyclable acid hydrotrope[J]. Science Advances, 2017, 3(9): e1701735.
[28] Ma Q L, Chen L H, Wang R B, et al. Direct production of lignin nanoparticles(LNPs) from wood using p toluenesulfonic acid in an aqueous system at 80℃: characterization of LNP morphology, size, and surface charge[J]. Holzforschung, 2018, 72(11): 933.
[29] Bian H Y, Chen L H, Gleisner R, et al. Producing wood based nanomaterials by rapid fractionation of wood at 80℃ using a recyclable acid hydrotrope[J]. Green Chemistry, 2017, 19(14): 3370.
[30] Ma Q L, Zhu J J, Gleisner R, et al. Valorization of wheat straw using a recyclable hydrotrope at low temperatures(≤90℃)[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 14480.
[31] Singh J, Suhag M, Dhaka A. Augmented digestion of lignocellulose by steam explosion, acid and alkaline pretreatment methods: A review[J]. Carbohydrate Polymers, 2015, 117: 624.
[32] Jin Y C, Jameel H, Chang H M, et al. Green Liquor Pretreatment of Mixed Hardwood for Ethanol Production in a Repurposed Kraft Pulp Mill[J]. Journal of Wood Chemistry and Technology, 2010, 30(1): 86.
[33] Gu F, Wang W X, Jing L, et al. Effects of green liquor pretreatment on the chemical composition and enzymatic digestibility of rice straw[J]. Bioresource Technology, 2013, 149: 375.
[34] Gu F, Yang L F, Jin Y C, et al. Green liquor pretreatment for improving enzymatic hydrolysis of corn stover[J]. Bioresource Technology, 2012, 124: 299.
[35] Wu S F, Chang H M, Jameel H, et al. Novel green liquor pretreatment of loblolly pine chips to facilitate enzymatic hydrolysis into fermentable sugars for ethanol production[J]. Journal of Wood Chemistry and Technology, 2010, 30(3): 205.
[36] Gu F, Posoknistakul P, Shimizu S, et al. Synergistic contribution of hydrosulfide and carbonate anions to the β O 4 bond cleavage of lignin model compounds in a green liquor pretreatment for enzymatic hydrolysis of lignocellulosic materials[J]. Journal of Wood Science, 2014, 60(5): 346.
[37] Lee J M, Jameel H, Venditti R A. A comparison of the autohydrolysis and ammonia fiber explosion(AFEX) pretreatments on the subsequent enzymatic hydrolysis of coastal Bermuda grass[J]. Bioresource Technology, 2010, 101(14): 5449.
[38] Mathew A K, Parameshwaran B, Sukumaran R K, et al. An evaluation of dilute acid and ammonia fiber explosion pretreatment for cellulosic ethanol production[J]. Bioresource Technology, 2016, 199: 13.
[39] Aziz S, Sarkanen K. Organosolv pulping: a review[J]. Tappi Journal, 1989, 72(3): 169.
[40] Wang Q, Liu S S, Yang G H, et al. Characterization of high boiling solvent lignin from hot water extracted bagasse[J]. Energy & Fuels, 2014, 28(5): 3167.
[41] Luterbacher J S, Rand J M, Alonso D M, et al. Nonenzymatic sugar production from biomass using biomass derived gamma valerolactone[J]. Science, 2014, 343(6168): 277.
[42] Leskinen T, King A W T, Argyropoulos D S. Fractionation of lignocellulosic materials with ionic liquids[M]// Fang Z, Smith Jr R L, Qi X H, Production of Biofuels and Chemicals with Ionic Liquids. Springer, Dordrecht Heidelberg Newyork London, 2014.
[43] Zhang P, Dong S J, Ma H H, et al. Fractionation of corn stover into cellulose, hemicellulose and lignin using a series of ionic liquids[J]. Industrial Crops and Products, 2015, 76: 688.
[44] Chang K L, Chen X M, Wang X Q, et al. Impact of surfactant type for ionic liquid pretreatment on enhancing delignification of rice straw[J]. Bioresource Technology, 2017, 227: 388.
[45] Maki Arvela P, Anugwom I, Virtanen P, et al. Dissolution of lignocellulosic materials and its constituents using ionic liquids A review[J]. Industrial Crops and Products, 2010, 32(3): 175.
[46] Francisco M, van den Bruinhorst A, Kroon M C. New natural and renewable low transition temperature mixtures(LTTMs): screening as solvents for lignocellulosic biomass processing[J]. Green Chemistry, 2012, 14(8): 2153.
[47] Chang J, Liu J, Guo S J, et al., Investigation into selective separation of lignin in novel deep eutectic solvent[J]. Journal of South China University of Technology(Natural Science Edition), 2016, 44(6): 14.
常 杰, 劉 钧, 郭姝君, 等. 新型深度共熔溶剂选择性分离木质素的研究[J]. 华南理工大学学报(自然科学版), 2016, 44(6): 14.
[48] Shen X J, Wen J L, Mei Q Q, et al. Facile fractionation of lignocelluloses by biomass derived deep eutectic solvent(DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization[J]. Green Chemistry, 2019, 21(2): 275.
[49] Liu C, Wyman C E. The effect of flow rate of very dilute sulfuric acid on xylan, lignin, and total mass removal from corn stover[J]. Industrial & Engineering Chemistry Research, 2004, 43(11): 2781.
[50] Ferrini P, Rinaldi R. Catalytic biorefining of plant biomass to non pyrolytic lignin bio oil and carbohydrates through hydrogen transfer reactions[J]. Angewandte Chemie, 2014, 53(33): 8634.
[51] Shuai L, Amiri M T, Questell Santiago Y M, et al. Formaldehyde stabilization facilitates lignin monomer production during biomass depolymerization[J]. Science, 2016, 354(6310): 329.
[52] Deuss P J, Lancefield C S, Narani A, et al. Phenolic acetals from lignins of varying compositions via iron(III) triflate catalysed depolymerisation[J]. Green Chemistry, 2017, 19(12): 2774.
[53] Zhang Y Q, He H Y, Dong K, et al. A DFT study on lignin dissolution in imidazolium based ionic liquids[J]. RSC Advances, 2017, 7(21): 12670.
[54] Xia Q, Liu Y, Meng J, et al. Multiple hydrogen bond coordination in three constituent deep eutectic solvent enhances lignin fractionation from biomass[J]. Green Chemistry, 2018, 20(12): 2711.CPP
